1. 引言
鲜辣椒在发酵制成泡菜的过程中,原料中的大部分营养成分没有被破坏 [1] [2],如丰富的膳食纤维、硫胺素等,其中存在的这些物质还具有保肝利胆、降低胆固醇等作用 [3] [4] [5],益于身体健康。尽管发酵辣椒对人体有诸多益处,但仍然存在自然发酵为主的发酵辣椒中亚硝酸盐的积累引起的发酵辣椒产品稳定性、安全性问题,存在亚硝酸盐(nitrites, NIT)形成及过量残留等问题;有研究指出单次摄入0.3~0.5 gNIT就可导致中毒,摄入超过3 g会导致死亡 [6],NIT进入人体后,与食物或胃中的胺产生反应,生成亚硝胺等亚硝基化合物,此类化合物是一种很强的致癌物质,且可诱发各种部位的癌症,如鼻咽癌、胃食道癌及肝癌等 [7] [8] [9] [10]。
植物乳杆菌、短乳杆菌等均具有较强的降解NIT的能力 [11],王笋张二康等筛选出乳杆菌属、肠膜明串珠菌属等作复合发酵菌剂,可以缩短蔬菜发酵周期、降低NIT的含量 [12] [13],发酵蔬菜口感更佳 [14]。因此筛选具有优良的NIT能力的乳酸菌,并制成复合发酵剂进行发酵,是降低发酵蔬菜中NIT含量,保证产品品质的有效方法。本研究以贵州自然发酵的辣椒为实验材料,以产酸能力、亚硝酸盐降解能力、生长能力为指标,对其进行筛选,筛选优势菌株,再结合研究团队前期研究得到的一株性能同样优良且生长习性相近的植物乳杆菌LP-7501S进行复配,探究综合发酵性能最优配比组合,为发酵辣椒直投式发酵剂提供实践基础。
2. 材料与仪器
2.1. 试验材料
试验原料:鲜辣椒、大蒜、食盐(食品级)、生姜,贵阳花溪沃尔玛超市;植物乳杆菌LP-7501S (Lactobacillus plantarum 7501S),贵州大学发酵工程与生物制药重点实验室,菌株CCTCC NO:M 2019535。
实验主要试剂:MRS培养基,上海博微生物科技有限公司;碳酸钙、过氧化氢、亚硝酸钠葡萄糖、硫酸镁、硫酸锰、磷酸氢二钾,乙酸钠、柠檬酸氢二铵、硼酸钠、亚铁氰化钾、乙酸锌、对氨基、苯磺酸钠、盐酸萘乙二胺,均为分析纯,北京索莱宝科技;吐温80分析纯,中国医药上海化学试剂公司。
2.2. 主要试验仪器与设备
YX280B手提式不锈钢蒸汽灭菌锅,上海三申医疗器械;VORTEX涡旋混合器,上海达姆有限公司;722型722分光光度计,上海佑科仪表;GZX-GF101-3-BS-II电热鼓风恒温干燥箱,上海贺德;GL-20G-II高速冷冻离心机,上海安亭科学仪器厂;LS-1F超净工作台,上海索普仪器;78-1磁力加热搅拌器,常州博远实验分析仪器厂。
3. 试验方法
3.1. 试剂的配制
0.1 mol/L NaOH标准滴定溶液:参照 GB/T601—2016化学试剂标准滴定溶液的制备 [15];测定亚硝酸盐所需试剂的配制方法参照GB/T5009.33-20161 [16]。
3.2. 菌种的分离和纯化
将贵州品质较好的发酵辣椒,连同发酵液各取50 g,匀浆,取5 ml匀浆液于试管,加入5 ml灭菌生理盐水混匀,然后梯度稀释10−2~10−9,将各稀释液分别涂布于加有1% CaCO3的MRS固体培养基上,于37℃恒温培养48 h,挑取有溶钙圈且直径在2~4 mm的菌落,反复划线纯化得到单菌落后,进行革兰氏染色和过氧化氢酶试验,将革兰氏染色阳性、过氧化氢酶试验阴性菌种保存备用。
3.3. 菌种初筛
将各菌株接种于50 mL MRS液体培养基中,37℃培养24 h,测定其pH及OD600值。
3.4. 菌种复筛
将初筛得到的菌种接种于含150 mg/L亚硝酸钠的150 ml MRS培养基中,于37℃恒温培养箱中培养24 h后,测定发酵液中亚硝酸盐含量,计算亚硝酸盐降解率 [17]。
3.5. 生长曲线测定
将活化后的LJ1和LJ8分别接种至MRS液体培养基进行培养,以不接种的MRS液体培养基作为空白对照,每隔2 h测定其OD600值,以培养时间为横坐标,OD600值为纵坐标,绘制各菌株生长曲线。
3.6. 分子生物学鉴定
将菌株LJ1和菌株LJ8送至工生物工程(上海)股份有限公司测定进行16S rRNA序列测定;用MEGA7.0软件使构建系统发育树。
3.7. 复合发酵剂配比的确定
挑选优质新鲜的红辣椒洗净、烫漂处理后放入泡菜坛,将LF-8001、LF-8002、LP-7501S进行活化培养后按表1的菌种配比进行辣椒发酵,其中食盐添加量为4%,辅以适量大蒜、生姜、酒等辅料,辣椒:卤水 = 1:1.5,菌剂接种量为4%,30℃恒温发酵 [18],发酵成熟时(72 h)测定发酵辣椒中的亚硝酸盐含量、pH、总酸,同时进行感官评定,以自然发酵72 h和自然发酵成熟的两种辣椒作为对比,筛选出最佳菌种配比。

Table 1. Fermentation strains combination
表1. 发酵菌种组合
3.8. 测试方法
1) pH:使用酸度计进行测定。
2) OD600值:用722分光光度计,于波长600 nm处进行测定。
3) 亚硝酸盐标准曲线的绘制及亚硝酸盐含量的测定
根据文献 [19] 盐酸萘乙二胺比色法绘制标准曲线。
发酵辣椒中的亚硝酸盐的测定采用分光光度计法,参照食品安全国家标准GB/T 5009.33—2010《食品中亚硝酸盐与硝酸盐的测定》中的盐酸萘乙二胺比色法测定发酵辣椒中的亚硝酸盐含量 [16]。
4) 总酸:根据GB/T 12456-2008,选用pH电位法测定发酵液中总酸的含量 [20]。
5) 发酵辣椒的感官评分:根据表2进行感官评价。

Table 2. The sensory evaluation standard of fermented pepper
表2. 发酵辣椒的感官评价标准
4. 结果与分析
4.1. 菌种的分离与初筛
通过MRS培养基培养观察是否产生溶钙圈,革兰氏染色,过氧化氢酶试验,从自然培养的发酵辣椒及其发酵液中分离出80株疑似乳酸菌,乳酸菌在生长过程中会产生乳酸,在相同培养条件下,pH越低其乳酸含量越高,因此为加快试验效率,可通过pH的高低来反映这80株疑似乳酸菌产酸能力的强弱,比较这80株疑似乳酸菌的pH和OD600值,以对比其产酸能力和生长能力,实验结果如表3。

Table 3. Strain of the pH and OD600 value
表3. 菌株pH值及OD600值
根据表3可知,分离得到的80株疑似乳酸菌37℃培养24 h后,其pH都集中在4.18~5.96之间,OD600值都在0.215~1.851之间,在这80株菌中,菌LJ 1、LJ 3、LJ 5、LJ 6、LJ 8、LJ 10、LJ 32、LJ 52、LJ 59、LJ 69在培养24 h后,其pH较低,都在4.21以下,且增殖能力较强,OD600值都在1.700以上。接种前,MRS液体培养基的pH在6.2~6.4之间,接种疑似乳酸菌后,菌在其生长过程中产生乳酸,导致发酵体系pH下降,MRS培养基是乳酸菌选择性培养基,乳酸菌在MRS培养基中生长良好,且可以抑制其他细菌的生长,因此初步选定产酸能力、繁殖能力优于菌株LJ 1、LJ 3、LJ 5、LJ 6、LJ 8、LJ 10、LJ 32、LJ 52、LJ 59、LJ 69这10株菌进行亚硝酸盐降解能力的试验。
4.2. 菌种复筛
按照2.9的方法绘制出亚硝酸盐标准曲线,如图1,得到的标准曲线其R2为0.99953,即所有观测点中有99.953%的点落在这条直线上,因此标准曲线具有较高的可信度。
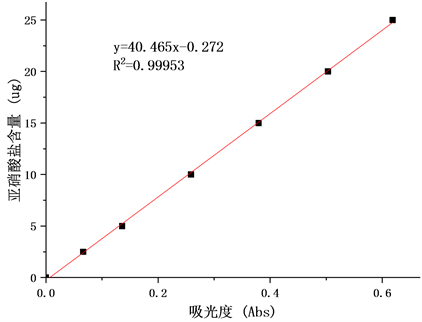
Figure 1. The standard curve of Sodium nitrite content determination
图1. NIT含量测定标准曲线
初筛得到的10株菌株接种于含150 mg/L亚硝酸钠的150 ml MRS培养基中,于37℃恒温培养箱中培养24 h后,测定培养液中亚硝酸盐剩余含量,计算得到各菌株的亚硝酸盐降解率 [17],结果如图2所示。
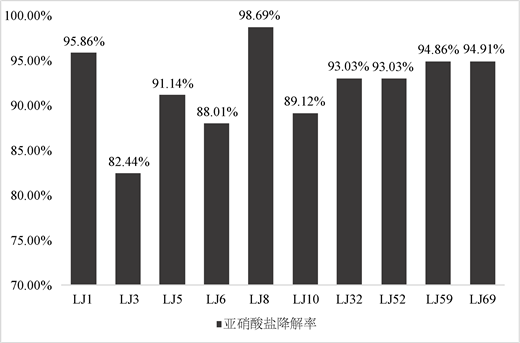
Figure 2. Nitrite degradation rate in screening strain
图2. 亚硝酸盐降解率
根据图2可以看到,初筛后的菌株对亚硝酸钠都有比较高的降解能力,其亚硝酸盐降解率都在80%以上,但不同菌株之间降解亚硝酸盐的能力有差异,降解能力最低LJ3在24 h内亚硝酸盐降解率为82.44%,而LJ8在24 h的降解率达到了98.69%,亚硝酸盐降解能力强的菌,制成发酵剂后,能在较短的时间内将亚硝酸盐含量降低到一个安全的水平,因此取亚硝酸盐降解率在95%以上的两株菌LJ1和LJ8进行下一步生长曲线的测定与鉴定。
4.3. 分离菌株生长曲线
LJ1和LJ8的生长曲线如图3所示,从图中可以看出,LJ1在9 h之前处于对数生长期,在此期间大量繁殖,其OD600达到了1.8,此时的活菌数为1.12 × 109 CFU/mL,9 h之后开始进入稳定期;LJ8的生长曲线与LJ1大致相同,都是在9 h之前处于对数生长期,在此期间大量繁殖,其OD600达到了1.82,此时的活菌数为1.42 × 109 CFU/mL,9 h之后开始进入稳定期。结合LP-7501S的生长曲线 [21],三株菌株进入稳定期的时间相差不大,且生长习性相近,说明这三株菌株适宜进行复配。
4.4. 分离菌株的鉴定
将筛选得到的两株生长习性相近的疑似乳酸菌LJ1和LJ8进行分子生物学鉴定,结果如下。
由图4的电泳图谱可以看出,LJ1和LJ8在1500 bp均处出现了清晰且无杂带的荧光条带,说明此次PCR扩增成功,可用于后续的16S rDNA序列的测定。
1) 菌LJ1 16SrDNA测序结果及同源性对比分析
将LJ1的16SrDNA序列在核糖体数据库RDP (http://rdp.cme.msu.edu/index.jsp)上比对,并在NCBI上进行BLAST序列比对,菌LJ1跟发酵乳杆菌属10个不同菌种的BLAST序列进行比较,其匹配度较高,覆盖率都为100%,E值为零,即完全匹配,匹配一致性均在99%以上,最高可达到99.93%,因此可以证明菌株LJ1属于发酵乳杆菌属的亚种,命名为LF-8001。
2) 菌LJ816SrDNA测序结果及同源性对比分析
将LJ8的16SrDNA序列在核糖体数据库RDP (http://rdp.cme.msu.edu/index.jsp)上比对,并在NCBI上进行BLAST序列比对,菌LJ2跟发酵乳杆菌属8个不同菌种的BLAST序列进行比较,其匹配度较高,覆盖率都为99%,E值为零,即完全匹配,匹配一致性均在99%以上,最高可达到99.93%,因此可以证明菌株LJ2也属于发酵乳杆菌属的亚种,命名为LF-8002。
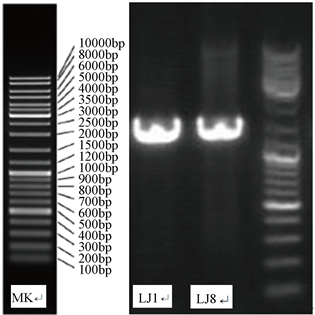
Figure 4. Electrophoresis map of PCR products of strains LJ1 and LJ8
图4. 菌株LJ1和LJ8的PCR产物电泳图谱
由图5可以看出,采用The Neighbor-joining Method法构建发育树,菌株LF-8001和LF-8002与NCBI数据库中Lactobacillus fermentum属进行对比,可信任度达到100%,基因相似性大于99.93,确定菌株LF-8001和LF-8002属于乳酸菌属发酵乳杆菌亚种。
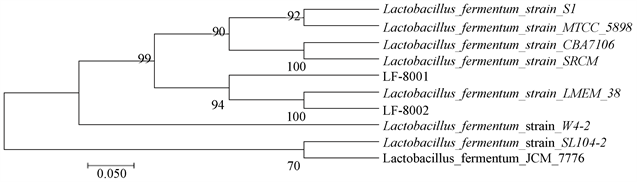
Figure 5. The phylogenetic tree of lactic Lactobacillus fermentum based on 16S rRNA gene sequences
图5. 发酵乳杆菌16SrRNA基因序列的系统发育树
4.5. 复合发酵剂配比对辣椒发酵效果的影响
按照3.8的方法,得出复合发酵剂不同菌种配比对发酵辣椒成熟时pH、总酸、亚硝酸盐含量影响的结果见表4,复合发酵剂不同配比对发酵辣椒成熟时感官影响的结果见表5。
由表4和表5可以看到,在相同发酵时间(72 h)内,自然发酵辣椒与接种发酵辣椒相比其总酸较低、亚硝酸盐含量较高,且基本无发酵辣椒的风味;发酵成熟时,自然发酵的辣椒和接种发酵的辣椒其亚硝酸盐含量均低于国标,且第14组试验其亚硝酸盐含量最低,结合感官评价可以看到,单一菌种发酵制备的辣椒感官评分低于接种复合发酵剂制备的辣椒,其主要是香气和滋味不足;按照第14组试验的菌种配比,接种发酵辣椒进行发酵,其感官评价最接近于自然发酵至成熟的辣椒,其得到的发酵辣椒颜色呈自然鲜红色,发酵香味浓郁,酸辣适中,风味协调,质地较为均匀。因此,综合考虑产酸能力、亚硝酸盐降解能力和感官评价等指标,最佳复合发酵剂配方菌种比例为:LF-8001:LF-8002:LP-7501S = 3:3:2。

Table 4. The influence of fermentation strains combination for physical and chemical properties of Fermented Pepper
表4. 发酵剂不同配比对发酵辣椒理化性质的影响

Table 5. The influence of fermentation strains combination for Sense of Fermented Pepper
表5. 发酵剂不同配比对发酵辣椒感官的影响
5. 结论
本研究从发酵辣椒中分离的两株发酵乳杆菌,分别命名为LF-8001和LF-8002,其亚硝酸盐降解能力都在95%以上,分别为95.86%和98.69%;而OD600分别为1.811和1.800,pH分别为4.20和4.19,其生长能力和产酸能力均优于分离得到的其它菌株,对其生长曲线进行测定发现与本研究团队前期筛得的植物乳杆菌LP-7501S生长习性相近,以LF-8001:LF-8002:LP-7501S = 3:3:2此比例发酵时,得到发酵辣椒亚硝酸盐含量远低于单一菌种发酵和自然发酵的辣椒,且按此复合发酵剂配方进行发酵的辣椒其感官评价明显优于单一菌种发酵,接近自然发酵至成熟的辣椒,发酵辣椒颜色呈自然鲜红色,质地较为均匀,具有发酵辣椒特有的发酵香气,香味浓郁,酸辣适中,风味协调,可为后期直投式发酵剂制备提供科学支撑。
基金项目
项目名称:贵州省科技计划项目(项目编号:黔科合成果[2020] 1Y025)。
项目名称:中央引导地方科技发展专项资金(项目编号:项目编号黔科中引地[2018] 4020)。
NOTES
*通讯作者。