摘要: 为探索急性马兜铃酸肾病(Aristolochic Acid Nephropathy, AAN)过程中细胞损伤后的再生与修复,本实验将40只KM小鼠分为5组:对照组、AAI暴露2、4、6、8天组,AAI组小鼠以5 mg/kg/2d AAI灌胃模拟AAN,使各组小鼠AAI累积剂量分别为5、10、15、20 mg/kg。分别于AAI暴露2、4、6、8天处死,观察肾脏病理学改变,并进行免疫组化染色观察C-myc和Cyclin D1蛋白表达情况。结果显示,与对照组相比,AAI组小鼠C-myc于第2天开始下降,第4天、6天、8天上升;Cyclin D1于AAI暴露第2天、4天下降,第6天、8天升高。本研究可得出结论暴露于AAI的小鼠C-myc和Cyclin D1蛋白表达随AAI累积剂量增加呈“先降后升”趋势。
Abstract:
In order to explore the regeneration and repair of cells after cell injury in the course of acute aristolochic acid nephropathy (AAN), 40 KM mice were divided into five groups in this experiment: the control group, the AAI-exposed group for 2, 4, 6, and 8 days, and the mice in the AAI group were simulated by gavage with 5 mg/kg/2d AAI to mimic the acute aristolochic acid nephropathy (AAN), so that the cumulative dose of AAI in each group was 5, 10, 15 and 20 mg/kg, respectively. Mice in the AAI group were put to death on 2, 4, 6 and 8 days of AAI exposure to observe the pathological changes in the kidneys, and immunohistochemistry staining was carried out to observe the protein expression of C-myc and Cyclin D1. The results showed that compared with the control group, C-myc started to decrease on day 2 and increased on days 4, 6, and 8 in the AAI group of mice; Cyclin D1 decreased on days 2 and 4 and increased on days 6 and 8 of AAI exposure. In this study, it can be concluded that the protein expression of C-myc and Cyclin D1 in AAI-exposed mice showed a tendency of “decreasing and then increasing” with the cumulative dose of AAI.
1. 引言
上世纪90年代,百余名比利时女性因服用了含马兜铃科“广防己”的减肥药而患上严重肾病,其中66人被迫进行肾移植,部分患者还发现了尿道癌症 [1] 。后来将此类情况称为“AAN”。课题组前期研究发现,AAI早期暴露可能引发小鼠肾细胞损伤,以激活细胞中再生修复相关基因的表达变化 [2] 。本研究为探索急性AAⅠ中毒小鼠肾细胞损伤和修复过程,建立急性AAN小鼠模型,检测与细胞周期、细胞分裂和细胞增殖 [3] 相关的C-myc和Cyclin D1蛋白表达情况,以期为AAN的预防和临床治疗策略提供基础研究数据。
2. 材料和方法
2.1. 动物和主要试剂、设备
从斯贝福生物技术有限公司购入SPF级雄性8周龄KM小鼠40只(合格证号:NO. 110324230102468973),体重为28~32 g,在贵州中医药大学实验楼动物房常温环境中饲养,自由摄食、饮水。
苏木精–伊红染色(Hematoxylin-Eosin Staining, HE)试剂盒(G1120)购于北京索莱宝科技有限公司;免疫组化通用二步法检测试剂盒(PV-9000)购于北京中杉金桥生物技术有限公司。C-Myc Antibody (AF6054)购于江苏亲科生物有限公司;Cyclin D1 Antibody (MA5-14512)购于赛默飞世尔科技公司。组织包埋盒(REF31050102W)购自江苏世泰实验器材有限公司;石蜡包埋机(KD-BM II)、组织切片机(KD-3368AM)、摊片机(KD-H)、冷冻台(KD-BL)均购于浙江省金华市科迪仪器设备有限公司;光学显微镜(DM750)购于德国LEICA。
2.2. 动物处理
将适应性喂养3天后的40只KM小鼠随机分为五组(n = 8),分别为对照组、AAI灌胃2 d、4 d、6 d、8 d组 [3] 。对照组每两天灌胃0.2 mL 0.4% CMC-Na;AAI组按照AAI 5 mg/kg/2d灌胃给药,分别于2天、4天、6天、8天处死 [2] 。
2.3. 样本采集
配制1%戊巴比妥钠溶液,以50 mg/kg腹腔注射麻醉后,脱颈处死,取双侧肾组织生理盐水清洗,沿矢状面一分为二装入组织包埋盒置于4%多聚甲醛(Paraformaldehyde)中4℃浸泡过夜固定24 h。
2.4. HE
肾组织固定过夜后,乙醇梯度脱水,二甲苯透明,浸蜡后包埋、切片。脱蜡复水,进行HE染色,中性树脂封片后显微镜下观察并拍照。
2.5. 免疫组织化学染色
将制备好的切片进行脱蜡和水化。取适量1×柠檬酸钠抗原修复液淹没组织,微波炉高火煮沸20 min,冷却至室温。滴加内源性过氧化物酶阻断剂,室温10 min;PBS浸洗。滴加一抗,37℃ 60 min;PBS浸洗。滴加反应增强液37℃ 20 min;PBS浸洗。滴加增强酶标羊抗小鼠/兔IgG聚合物37℃ 20 min;PBS浸洗。DAB显色后苏木素复染、脱水、透明、封片。在光学显微镜下观察其蛋白组织学定位,并利用Image J获取其阳性表达占比数据。
2.6. 统计学分析
使用SPSS26.0软件对所有数据进行正态性检验,GraphPad Prism 8绘图。符合正态性分布数据使用t检验,偏态分布数据用非参数检验检验,P < 0.05表示差异有统计学意义。
3. 结果
3.1. 急性AAN肾脏的病理学改变
HE (图1)结果显示:AAI处理2 d (图1(B))肾小管上皮细胞出现微绒毛脱落(黑色箭头);4 d (图1(C))肾小管上皮细胞出现细胞水肿和空跑样变性(红色箭头);6 d (图1(D))肾小管上皮细胞坏死脱落(红色圆圈);8 d (图1(E))肾小管出现基底膜裸露(蓝色箭头),并见到管腔内红色均染的蛋白尿(绿色方框)。
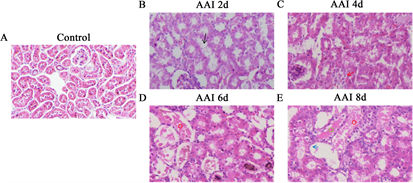
Figure 1. HE staining of kidney tissues from various groups in mice
图1. 各组小鼠肾组织HE染色
3.2. 急性AAN肾脏C-Myc表达改变
对AAI处理后的小鼠肾脏组织,进行C-myc免疫组化染色(图2)。IHC结果显示:小鼠肾脏C-myc阳性表达占比面积随AAI暴露累积剂量增加呈“先降后升”趋势(图2(F))。对照组小鼠(图2(A)) C-myc表达于细小髓袢细胞质和细胞核内;与对照组相比,AAI暴露第2天(图2(B))小鼠肾脏C-myc表达显著减少(P < 0.05),仅在髓袢可见少量阳性表达;第4天(图2(C))开始升高;第6天(图2(D))、第8天(图2(E))肾小管表达显著增加(P均 < 0.05),第8天时达到最高,增高约为对照组3倍。图2(E)蓝色箭头所指为再生扁平上皮细胞处。
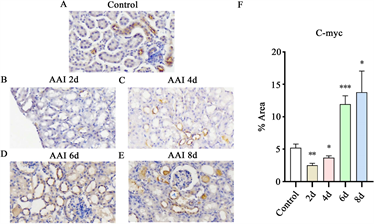 *P < 0.05,**P < 0.01,***P < 0.005。
*P < 0.05,**P < 0.01,***P < 0.005。
Figure 2. Immunohistochemical staining of C-myc in renal tissues of various groups of mice
图2. 各组小鼠肾组织C-myc免疫组化染色
3.3. 急性AAN肾脏Cylcin D1表达改变
 **P < 0.01,***P < 0.005。
**P < 0.01,***P < 0.005。
Figure 3. Immunohistochemical staining of Cyclin D1 in renal tissues of various groups of mice
图3. 各组小鼠肾组织Cyclin D1免疫组化染色
对AAI处理后的小鼠肾脏,进行Cyclin D1免疫组化染色(图3)。结果显示:模型组小鼠Cyclin D1阳性表达占比面积随着AAI暴露累积剂量呈“先降后升”趋势(图3(F))。对照组(图3(A)) Cyclin D1表达于肾小管上皮细胞细胞核内;与对照组相比,AAI暴露第2天(图3(B))、第4天(图3(C))小鼠肾脏Cyclin D1阳性表达面积显著下降;但是,第6天(图3(D))、8天(图3(E)),Cyclin D1的阳性表达占比面积增高;其中,第8天时达到最高(P > 0.05),约为对照组2倍。8 d时可见浓染再生扁平上皮细胞核呈阳性表达(图3(E))。
4. 讨论
AAN是一种药物性肾病,最初表现为急性肾损伤(Acute Kidney Injury, AKI),若未加干预,会导致肾纤维化甚至尿路上皮细胞癌(Urothelial Carcinoma, UC) [4] 。所以,明确急性AAN早期的病理变化有利于其临床诊断,探索其损伤后细胞再生修复机制,对AAN的临床治疗具有重要价值。
本研究中小鼠暴露于AAI后出现肾小管上皮细胞微绒毛脱落,随后细胞水肿、坏死、脱落直至基底膜裸露,出现蛋白管型。说明AAN模型构建成功。研究表明,损伤后的肾小管上皮细胞具有显著的再生能力 [5] ,再生的小管上皮细胞特征是细胞质嗜碱性,细胞扁平,核增大,核仁染色质增粗浓染,聚集于受损小管段 [6] ,C-myc和Cyclin D1均有在再生扁平上皮细胞处表达。C-Myc在促进细胞增殖、自我更新和存活方面起着关键作用,还通过抑制细胞周期检查点加速细胞周期进展,从而使细胞无限增殖 [7] [8] [9] 。在本研究中,对照组、AAI暴露第2天、第4天C-myc仅少量表达,但在第6天、第8天显著升高,提示随着暴露累积剂量持续增加,AAI导致肾脏细胞损伤加重同时促进上皮细胞周期进程,启动上皮细胞有丝分裂,修复增殖。Cyclin D1是一种重要的细胞周期调节因子,主要功能是促进细胞增殖 [10] 。研究表明,肾小管细胞损伤,DNA可能受损时,会进入短暂的G1细胞周期停滞期 [11] 。所以,我们推测在AAI暴露初期,细胞周期相关蛋白Cyclin D1和C-myc表达下调与短暂的细胞周期停滞相关。而持续损伤会促使肾小管细胞周期进展,从而促使急性损伤后的细胞增殖再生与修复 [10] 。提示我们此时可能是一个重要的临床治疗节点。
综上,本研究提示AAN过程中肾小管上皮细胞具有损伤后再生修复的能力,而重建健康小管关键在于细胞增殖 [12] ,细胞增殖修复基于细胞周期的进展 [10] 。所以,在AAN中,保护肾小管上皮细胞关注细胞周期是治疗重点。
NOTES
*通讯作者。