1. 引言
从考试、演讲到发生意外等等,人类在日常生活中不可避免地经历着各种应激事件。所谓应激是指当个体所感知到的挑战超过了自身应对能力时所产生的一种心理状态 [1] 。当个体暴露于急性应激源下,自主神经系统以及下丘脑–垂体–肾上腺(HPA)轴相互作用,引发一系列神经内分泌反应,进而促使大脑重新调配资源到那些对维持生存至关重要的功能上,它增强了我们的感官,使我们维持高度唤醒的状态 [2] ,但对应的,它也削弱了我们缜密思考与规划的能力 [3] 。这种大脑功能的转变,实际上是通过大规模神经网络的相互作用而实现的 [4] 。然而,应激所诱发的变化并不均衡,自主神经系统和HPA轴的动态交互导致应激后大脑所发生的变化也会随时间有所波动 [5] 。因而有必要从动态的角度探讨个体重复暴露于应激源下所诱发的大脑大规模脑网络间交互模式的变化。
人脑本质上是由不同的相互连接的功能网络组成的,这些网络协调复杂的认知和情感过程 [6] 。有三个核心神经认知系统对认知和情感加工至关重要 [7] 。突显网络(SN)包括前脑岛、扣带回背侧前皮质(dACC)和杏仁核,在发现显著的内部或外部事件并将其分配给它们方面起着关键作用 [8] ;默认模式网络(DMN),包括mPFC和PCC中的重要节点,对自我参照心理加工至关重要 [9] ;中央执行网络(CEN)包括背外侧前额叶皮质(DLPFC)和后顶叶皮质(PPC)的枢纽节点,对工作记忆、注意力和调节等高级认知功能非常重要 [8] 。这三个网络中的缺陷与一系列与压力相关的精神障碍有关,如焦虑、抑郁和创伤后应激障碍 [10] 。值得注意的是,受急性应激影响的脑区主要与关键的SN、DMN和CEN节点重叠,这表明急性应激对大脑的影响可能远远超出单个区域和区域间的成对连接,并进入大规模的脑网络重构。
最近一项采用特里尔社会应激测试(TSST)以及图论分析表征急性应激诱发的脑功能网络的拓扑变化,结果表明急性应激下大脑网络重组为额顶模块、默认模块、枕叶模块、皮质下模块和中央–穹隆模块,对应于支持认知控制、自我参照心理加工、视觉、突显加工、感觉和运动功能的几个众所周知的功能系统,急性应激削弱了额顶模块的内部连通性,强化了默认模块的连通性,应激反应与模块化程度呈负相关 [4] 。然而不同的功能网络并非独立发挥作用,它们之间存在相互依赖或拮抗的作用模式 [11] ,而这种作用模式在急性应激的影响下又会呈现出怎样的变化尚有待探讨。
Gray提出当个体对环境刺激进行反应时,存在两种不同的神经系统,即行为抑制(BIS)与行为激活(BAS)系统 [12] 。行为抑制系统控制焦虑情绪,对惩罚信号敏感,BIS的激活意味着个体向目标靠近的行动受到抑制,并在这一过程中产生焦虑的情绪。BAS对奖励,不惩罚或者逃避惩罚的信号很敏感,它的激活会使得个体更倾向于朝着目标努力,并在这一过程中体会到希望与幸福。因此,我们认为,个体BIS以及BAS对不同环境线索的敏感度的差异可能反映了不同的注意定向模式,而这一模式和敏感化的动态神经活动相互作用,共同对应激反应产生影响。这有助于揭示过激或者钝化的应激反应背后的可能的神经机制以及个体差异。
我们使用ScanSTRESS范式诱导急性应激,该范式采用社会评价威胁和高错误率压力下的动机任务诱导急性应激 [13] 。在这个范式中,应激情境被诱导了4次。采用yeo等人2011年开发的脑网络模板,通过对比两个RUN之间神经活动的显著差异探究应激的重复施加是否诱发了不同脑网络间连通性的显著改变。我们假设从VN,SMN到SN以及DAN的连通性在两个RUN之间会发生显著的上升,这种上升趋势对急性应激反应的影响会受到行为激活与抑制系统个体差异的调控。
2. 方法
2.1. 被试
本研究通过发布广告招募在校大学生77名(平均年龄为19 ± 2岁,男性42名)。所有被试无严重生理疾病、头部损伤、无酗酒和吸毒状况。所有女性被试均处于黄体期(月经期前十天左右)。所有被试在实验前1小时内被禁食、禁烟酒咖啡、剧烈运动以及刷牙。所有被试在实验结束后获得一定报酬。
2.2. 实验范式以及实验流程
本研究采用ScanSTRESS范式用以在功能性磁共振(fMRI)环境下诱发被试的应激体验(Streit et al., 2014)。该范式包含两个条件,实验条件与控制条件。实验条件指的是被试需要在有限时间内完成一系列的具有挑战性的认知任务,包括连续减法与心理旋转任务,同时伴随研究者的监控与负面评价。在控制条件下,被试在没有时间限制的条件下完成较为简单的认知任务(图形或数字匹配),并不伴随来自主试或屏幕的负面反馈
本实验中,ScanSTRESS采用block设计,包括2个run,每个run包含应激和控制两个条件,在第一个run,刺激按照“控制–实验–控制–实验”的顺序呈现,在第二个run,刺激按照“实验–控制–实验–控制”的顺序呈现。具体流程见图1。
为了调节皮质醇节律对实验结果的影响,被试被要求在中午十二点至下午三点期间到达实验室。到达后首先休息60分钟,期间进行实验流程的介绍并收集完成人口信息的问卷,然后进入MRI扫描仪。首先获取T1像,随后进行第一个静息态扫描(rest1),八分钟后,开始ScanSTRESS范式任务诱导应激体验。整个范式分成两个run,每个run持续680秒,应激任务结束后,进行第二次静息态扫描(rest2)、DTI扫描,在被试离开实验室之前,将进行十分钟的问询阶段(图2)。
2.3. 数据收集与处理
2.3.1. 主观应激测量
通过主观报告衡量被试所体验到的主观应激程度、不可控感与社会评价威胁。采用Likert-7点量表,其中1 = 根本不,7 = 非常严重。
2.3.2. 客观应激测量
用Salivette唾液收集器(SARSTEDT)进行唾液收集。所得唾液样本放置在−20℃的冰箱里保存。唾液皮质醇浓度采用酶联免疫测定法(ELISA,IBL-Hamburg,德国)进行分析。皮质醇测定的敏感度为0.005 ug/dl,皮质醇测定的内部、外部变异系数为3.2%和6.1%。
2.3.3. 行为激活与抑制量表(BAS/BIS)
目前评估BIS/BAS应用最广泛的量表是由Carver等人开发的BIS/BAS量表 [1] 。BIS/BAS量表包括四个分量表,首先是惩罚敏感性量表(BIS),涉及到个体对惩罚预期的反应,例如“我担心我会犯错”。与BIS相对应,BAS包括了三个维度,分别是奖赏反应(Reward Response, BASR),衡量个体对可能发生的奖赏所产生的积极反应,例如“当我把某件事情做得很好时,我会喜欢继续做它”;驱力(Drive, BASD),表明个体对理想目标的不懈追求,例如“我会以排除万难的态度追求我想要的东西;愉悦追求(Fun Seeking, BASF),反映了个体对新异奖励的渴望以及冲动之下接近奖励活动的意愿,例如“我喜欢刺激以及新鲜感”,三个维度的总和得分反映了行为激活系统对奖赏刺激的敏感程度以及在追求奖赏过程中体会到的积极情绪 [1] 。采用Likert四点计分,1 = 完全不符合,4 = 完全符合
2.3.4. fMRI数据采集
使用西门子3 Tesla TRIO MRI扫描仪进行数据采集。平面回波成像脉序列(EPI)参数如下:脉冲重复时间2000 ms,回波时间30 ms,视场224 × 224 mm2,层厚2.0 mm,层数192,翻转角90˚。为了空间解剖参考,获取了高分辨率T1加权 3D 快速场回波序列,具体参数如下:脉冲重复时间2530 ms,回波时间2.98 ms,视场256 × 256 mm2,层厚1.0 mm,层数192,翻转角7˚。
2.4. 数据分析
2.4.1. fMRI数据预处理与数据分析
使用基于MATLAB的CONN工具包(https://www.nitrc.org/projects/conn, RRID: SCR_009550)对功能磁共振数据进行预处理和后续分析。fMRI预处理包括:将三维图像转为四维,对每个切片进行时间层矫正,头动矫正,将功能图像与T1结构图像进行配准,使用Dartel segments进行分割,然后标准化到T1 MNI模板上,最后对标准化的数据进行空间平滑(平滑核为4 mm)。
对每个被试,CONN采用CompCor方法 [2] 对BOLD信号中潜在的混淆变量进行线性回归以及带通滤波,滤波参数为0.008~0.09 hz。随后采用生理心理交互作用(PPI)观察被试由于重复应激所诱发的脑网络间的动态变化,在单样本T检验中获取了RUN2 > RUN1的对比图像。为了进一步计算整个应激诱发过程中的大脑动态变化水平,使用yeo等人2011年开发的17个脑网络模板 [3] ,具体包括:默认模式网络(Default, DMN)、执行控制网络(Control, CEN)、边缘系统(Limbic)、背侧注意网络(Dorsal Attention, DAN)、腹侧注意/突显网络(Salience/Ventral Attention, SN)、感觉运动网络(Somatomotor, SMN)、视觉网络(Visual, VN)、颞顶联合区(TempPar)。在本研究中,采用“VN(a)”“VN(b)”等来表示不同网络。
通过ROI-to-ROI分析方法计算不同脑网络之间互相预测的PPI系数,通过t检验计算第一个和最后一个block之间功能连通性的差异,以估计整个应激诱发过程中ROI之间功能连通性的动态变化。为了探究急性心理应激大脑功能连接动态变化与行为的关系,进行了相关与调节分析。
2.4.2. 心理和生理指标的分析
我们计算曲线下面积(the Area Under the Curve with Respect to Ground)以及曲线下面积增量(the Area under the cuRve with Respect to increase, AUCi)作为衡量应激主客观水平(内分泌、主观应激报告)变化的指标。AUCg是指应激指标不同时间点变化连线与坐标0之间的总面积,用于反应整体应激水平,而AUCi忽略了坐标0点到基线的距离而更强调随时间的变化量,用来衡量应激反应的敏感性。
3. 结果
3.1. 行为结果

Table 1. Correlation between behavioural activation-inhibition sensitivity and acute stress
表1. 行为激活–抑制敏感度和急性应激的相关
*p < 0.05, **p < 0.01
共77名被试完成了实验,其中两名被试因为头动过大而被删除,最终共75名被试(男性42人)纳入分析。
分别计算唾液皮质醇与主观应激报告在应激任务期间的曲线下面积(AUCg)与曲线下面积增量(AUCi)作为衡量应激反应程度的指标。选取行为趋近量表(BAS)中的奖赏反应(BASR)、驱力(BASD)、以及愉悦追求(BASF)三个分量表以及行为抑制量表(BIS)的得分探究影响急性心理应激反应的可能因素。结果表明BIS同急性应激任务期间的主观压力感(AUCg)呈显著负相关(r = −0.247, p = 0.032)。其余分量表和应激指标不存在直接的相关(见表1)。
3.2. 应激诱发有效性
被试唾液皮质醇和主观应激报告的结果在图3中呈现,使用重复测量方差分析,以不同时间点的皮质醇浓度为被试内变量,结果显示时间点主效应显著(F = 4.13, p = 0.005)。事后分析结果显示唾液皮质醇水平在应激诱发后显著上升(ptime2-time1 < 0.05, ptime3-time1 < 0.05),并在应激任务结束后维持在一个较高的水平(ptime4-time1 < 0.05),在应激诱发结束后显著下降(ptime5-time4 < 0.05)。
以不同时间点的主观应激报告为被试内变量,时间点主效应显著(F = 47.58, p < 0.005)。事后分析结果显示主观应激水平在应激诱发后显著上升(ptime2-time1 < 0.05, ptime3-time1 < 0.05),并在应激诱发结束后显著下降(ptime5-time3 < 0.05)。
结果显示,在唾液皮质醇和主观报告上,急性心理应激任务ScanSTRESS都较好地诱发了被试的急性心理应激反应。
3.3. 重复应激下的脑网络的动态变化
ROI-to-ROI分析揭示了在VN,DAN,SMN与SN之间的功能连接在RUN2-RUN1条件下发生了显著的变化。从每个block中提取其功能连接值,进行重复测量方差分析,结果显示,他们之间的功能连接随着应激源的重复施加有所增强,具体如图4所示。
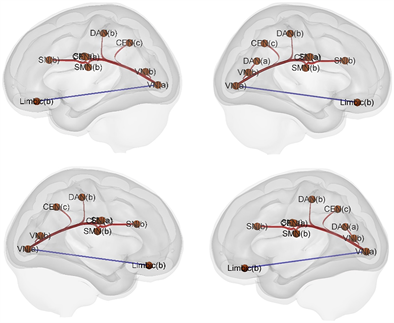
Figure 4. Dynamics of interaction patterns between brain networks under stress conditions
图4. 应激条件下脑网络之间交互模式的动态变化
3.4. 相关分析
将动态神经活动同应激反应、以及行为数据做相关,试图揭示个体在急性应激过程中神经活动的变化所具备的表征意义。结果如图5所示,在RUN2 > RUN1的对比条件下,VN(b)-SN(a)的功能连接增强同应激任务期间的主观压力感呈显著负相关(r = −0.294, p = 0.011);SN(a)-SN(b)的功能连接增强同BASD得分显著正相关(r = 0.240, p = 0.039);SMN(b)-SN(b)的功能连接增强同BASR,BASD,BAS_sum呈显著正相关(rBASR = 0.274, p = 0.018, rBASD = 0.233, p = 0.046, rBAS_sum = 0.273, p = 0.019)。
3.5. 调节分析
以急性应激期间的动态神经活动(block4-block1)为自变量,以急性应激反应为因变量,以两种动机系统的个体差异为调节变量进行调节分析。结果如图6所示,发现BASR,BASD,BASF以及BIS的得分能够调节持续敏化的脑网络交互活动与增加的应激反应之间的关系。
4. 讨论
为了探究个体在重复应激下脑网络的动态变化,本研究采用了ScanSTRESS范式,被试在核磁舱内反复进行演讲任务,并伴随社会评价威胁和不可控感。结果发现,VN与SMN充当网络间传递信息的核心节点,VN-DAN,VN-SN,SMN-SN,SN(a)-SN(b)的功能连接在重复应激诱发下出现了显著上升,这种动态变化和唾液皮质醇以及主观应激报告的关系受到个体行为激活与抑制系统的调节。
习惯化是指对重复刺激的反应性降低 [4] 。过往研究证明,重复暴露于相同的社会心理应激源会诱发由HPA轴介导的应激反应的快速习惯化 [5] 。此外,交感神经激活的标志(例如血压、肾上腺素)在重复进行的应激任务中也表现出一致的激活模式 [6] 。然而,为了进一步解释这种习惯化背后的神经机制,并更好地理解急性应激如何增加一些易感个体的患病风险,研究人类大脑在急性应激期间的动态调控模式是有必要的。
Groves等人最早提出了行为可塑性的双过程理论 [4] 。该理论认为重复刺激施加存在两个过程,一个是反应的递减过程,称之为习惯化;另一个是反应的递增过程,称之为敏感化。其中,习惯化依赖于传统强化学习理论中的刺激–反应(S-R)系统,而敏感化则依赖于由于刺激呈现所诱发的觉醒、兴奋与行为倾向的状态系统。换句话说,习惯化依赖于对刺激做出离散反应的运动通路,而敏感化则更强调刺激诱发所产生的一般觉醒状态。因此这两个过程并非彼此排斥,而是需要在做出反应前的某个临界点上相互作用才能产生特定的行为结果。在习惯化的形成过程中,个体对刺激的敏感化表现出先增长后衰退的模式,而这与刺激的强度和频率直接相关。这一理论提出后在动物和人类研究中得到了广泛的验证,因此,对于急性应激期间HPA轴的快速习惯化反应,我们认为脑中同样存在习惯化与敏感化两条并行的动态反应过程对其产生影响。
先前研究证明应激源重复施加的过程中,大脑前额叶到边缘系统区域表现出持续的失活,主要涉及vmPFC,dlPFC,ACC以及海马等这些同积极情感、激励、动机调控、以及和皮质醇反应直接相关的脑区,这种下降被认为是个体由于面对反复的失败和负面反馈而造成的动机脱离。根据双过程理论,这有可能反映了个体在S-R系统中的习惯化过程,即个体习惯于重复出现的失败刺激,从而降低了完成任务的动机,表现为相关脑区活动的持续下降。
现有研究发现,急性应激期间,突显网络(SN)与背侧注意网络(DAN)的内部连通性发生显著上调 [7] [8] [9] 。其中SN的重要意义在于,当外界环境不安全时,能够快速将注意力转移到潜在威胁上,调动资源,及时采取行动 [10] 。因此,严重的应急暴露会促使大脑将资源重新分配到SN,从而促进恐惧和警惕,但代价是执行控制网络(CEN)的下调,表现为急性应激下高级认知功能(例如工作记忆)受到抑制 [11] 。背侧注意网络(DAN)以顶下小叶(IPL)为核心节点,参与对空间线索的注意控制,涉及自上而下的外向行为与感知过程 [8] 。DAN中心性的上调意味着个体将注意力更多集中在外部刺激上。
此外Zhang等人的研究发现,在急性应激期间与视觉相关的枕骨内连通性发生显著改变,感觉运动系统同其他系统的沟通增强,这可能暗示了一种超敏感的知觉–动作系统,有助于个体及时做出战斗或逃跑的反应 [12] 。因此,视觉网络(VN)与感觉运动网络(SMN)在应激期间也发挥着不可替代的重要作用。
基于此,我们认为这样一种动态活动模式可能和急性应激下发生敏化的觉醒状态有关:即由VN和SMN感知并传入刺激信息,SN以及DAN完成对刺激评估以及注意定向,这些网络彼此的连通性在重复应激施加的过程中逐步上升,使得个体获得高度唤醒的状态,并产生特定的行为倾向。
此外,我们证明了这一敏化的过程会受到个体两种不同动机系统的影响,即行为激活与抑制系统(BAS/BIS)。当BAS对奖赏刺激敏感度高时,随着SN内部、VN-DAN、SMN-SN功能连接的上升,应激反应减弱。个体BAS对不同环境线索的敏感度的差异可能反映了不同的注意定向模式,而这一模式和敏感化的动态神经活动相互作用,共同对应激反应产生影响。
本研究报告了在重复应激过程中不同脑网络之间交互模式的动态变化,研究表明,VN与SMN在急性应激下充当连接模块的作用,同DAN与SN在四个block间皆表现出显著上升的功能连接模式。其中,VN-DAN的功能连接同应激反应阶段的主观应激报告呈负相关,SN内部以及SMN-SN的功能连接同BAS以及三个分量表的得分呈显著正相关。BAS负向调节了SN内部,VN-SN,SMN-SN的功能连接变化和应激反应的关系。然而,默认模式网络(DMN)与执行控制网络(CEN)作为急性应激的三大网络,在本研究中并没有表现出同其他网络的交互模式变化,因此未来有必要进行网络内功能连接的研究,进一步探寻重复应激下大脑功能网络的动态变化模式。
致谢
感谢所有为本研究做出贡献的被试、同学和老师。