摘要: 高等植物分生组织中细胞由快速分裂向分化过渡是器官发育的一个关键步骤,其调控机理一直备受关注。本文简要介绍了在拟南芥根尖分生组织中目前提出的有关该步骤分子调控机理的几个假说,包括生长素-PLTs假说,生长素最小值假说和PLTs和ARRs双向抑制假说,以期为相关领域的研究者提供参考。
Abstract:
The transition from rapid division to differentiation of cells in meristems is a key step in organogenesis of higher plants, and its regulatory mechanisms have always been a focus of research. This paper briefly introduces several hypotheses about the molecular regulation mechanism of this step in the Arabidopsis root apical meristem, including the auxin-PLTs hypothesis, auxin minimum hypothesis and PLTs and ARRs mutul inhibition hypothesis, with the aim of providing a reference for researchers in related fields.
1. 引言
高等植物中的器官发育是一个持续的过程,贯穿于整个生命周期。这一发育特性主要归功于植物具有终生维持干细胞的能力。这些干细胞位于植物体内特定的部位称之为分生组织,它们通过不对称分裂为器官发育提供新的细胞。干细胞每次分裂产生的两个子细胞中只有一个维持原来的干细胞特性,另一个会分化成特定的组织。在大多数情况下,该细胞会在分化前继续进行数轮有丝分裂。由于器官生长的速度和器官的大小主要取决于分生组织中快速分裂的细胞数量,因此控制细胞从分裂到分化的过渡是器官发育调控的一个关键步骤。
在高等植物的根尖分生组织中,细胞分裂与分化活动在不同组织间高度同步,以至于形成以不同细胞活动类型为特征的区。以拟南芥根尖分生组织为例(见图1),干细胞位于静止中心及其周围,是根尖分生组织的组织中心;干细胞的下方(远端)为根冠,其中的细胞一般不继续分裂而直接进入分化;干细胞区的上方(近端)为分生区,该区中的细胞处于快速分裂状态,是根尖分生组织中新细胞产生的主要场所;分生区上方为伸长区,其中的细胞处于分裂到分化的过渡阶段,主要特征为或已退出分裂或正在退出的途中,开始沿纵轴方向快速伸长和加速分化。伸长区的上方为成熟区,这里的细胞已经完成了分化过程,形成了根中的各种成熟组织 [1] [2] 。
2. 生长素-PLTs假说
如前所述,根尖分生组织中细胞从分裂到分化的过渡是根器官发育中一个非常重要的节点,其调控机理一直备受关注,至今已提出了多个假说。如Galinha等 [3] [4] [5] [6] [7] 提出的“生长素-PLTs”假说(图1(a))。该假说基于如下实验观察:1) 生长素是拟南芥根尖分生组织的重要调控因子,在根尖分生组织中其浓度呈梯度分布,其最高浓度区与干细胞区基本重叠;2) PLETHORA家族蛋白是根尖分生组织功能维持所必需的,其蛋白浓度在根尖分生组织中呈梯度分布,其梯度与生长素的浓度梯度非常相似,即其浓度最高值处对应干细胞区,分生区的浓度次之,成熟区的浓度最低,而伸长区的浓度处于分生区与成熟区浓度的之间;3) PLT基因的转录水平受生长素调控。基于上述观察,他们提出PLETHORA家族蛋白的浓度决定细胞活动类型的假说,PLT蛋白浓度最高处为干细胞,稍低于干细胞区浓度的区域为快速分裂的细胞,而低浓度PLT蛋白区细胞主要进行分化活动 [3] [4] [5] [6] [7] 。
3. 生长素最小值假说
Dello Ioio等 [7] [8] 发现细胞分裂素在调控拟南芥根尖分生组织细胞由分裂向分化过渡中也有重要的作用。他们发现细胞分裂素合成或细胞分裂素信号响应通路受阻的突变体幼苗的根尖分生组织中分生区比野生型幼苗中的要长,而外源提供细胞分裂素可以导致野生型根尖分生组织中的分生区缩短,表明细胞分裂素可促进拟南芥根尖分生组织中细胞从分裂向分化过渡。他们还发现细胞分裂素的上述调控功能由两个细胞分裂素响应因子ARR1和ARR12介导,ARR1和ARR12蛋白在伸长区(细胞分裂到细胞分化的过渡区)内高浓度积累。
Di Mambro等 [9] 找到了细胞分裂素与生长素之间相互调控的证据,他们发现细胞分裂素通过ARR1正调控两个和生长素有关的基因的表达,GH3.17和SHY2。GH3.17编码一个生长素降解酶,而SHY2编码一个参与生长素信号响应的转录调控因子,后者对多个生长素转出蛋白(PINs)的编码基因有负调控作用。因此细胞分裂素通过对上述基因的正调控作用导致在过渡区生长素降解速度加快和生长素运输减弱,最终导致过渡区里生长素浓度降到最小值。而实验数据和计算机模型模拟显示过渡区生长素浓度的最小值可导致细胞从快速分裂向分化过渡(图1(b))。
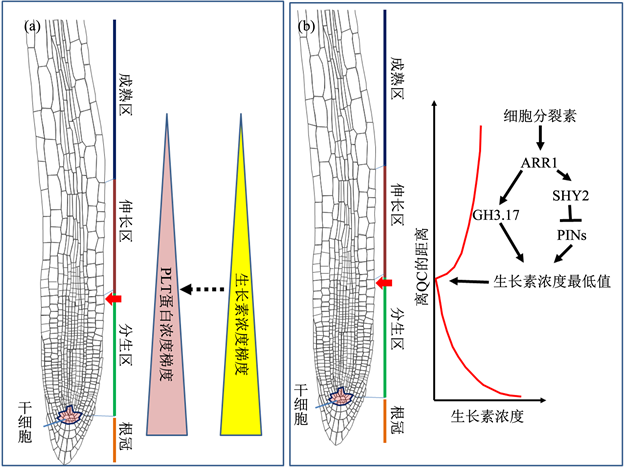
注:(a) 生长素-PLTs假说:该假说认为拟南芥根尖生长点中细胞的活动受生长素浓度梯度所决定,生长素浓度梯度通过对PLT家族基因的剂量转录调控转化为PLTs蛋白浓度梯度,后者以剂量调控方式决定细胞的活动模式:在干细胞区高PLTs蛋白浓度决定此处细胞的干细胞特性,分生区中PLTs蛋白中等浓度决定细胞快速分裂,而伸长区和成熟区中低PLTs蛋白浓度导致细胞进行分化。细胞从分裂模式向分化模式过渡是因为生长素或PLTs浓度低于维持细胞分裂所需要的阀值的结果,此图为作者依据参考文献 [3] [4] [5] [6] [7] 自绘;(b) 生长素最小值假说:该假说认为拟南芥根尖分生组织中细胞从分裂向分化过渡是过渡区内生长素浓度最小,而导致过渡区成生长素浓度最小是细胞分裂素调控的结果。细胞分裂素通过其信号转导通路中的重要转录因子ARR1正调控GH3.17和SHY2两个基因在过渡区表达上升,前者编码一个生长素降解酶,后者编码一个参与生长素信号响应通路中的转录因子,该转录因子可下调多个生长素转出蛋白PIN的编码基因的表达。因此细胞分裂素对上述两个基因的上调导致过渡区生长素降解速度加快和PIN蛋白量降低/生长素运输量减少,最终导致过渡区里生长素浓度降到最小值,实验结果分析与计算机模拟实验表明生长素最小值足够导致细胞从快速分裂向分化过渡,此图为作者依据参考文献 [10] 绘制。
图1. 两个有关拟南芥根尖生长点中控制细胞从分裂向分化过渡的分子机理的假说
4. PLTs/ARRs双向抑制假说
Salvi等 [10] [11] 和Shtin等 [12] 的最近发现了调控拟南芥根尖分生组织中细胞从分裂向分化过渡的另一条生长素与细胞分裂素相互作用的途径,即PLTs与ARR1/ARR12之间的相互抑制(见图2)。他们发现一方面ARR1和ARR12可抑制PLT1和PLT2基因的表达,其中ARR12可以直接与PLT1和PLT2基因的启动子结合 [10] [11] [12] ,而ARR1对PLT基因表达的抑制机理目前尚不清楚;另一方面,PLT蛋白可以上调KMD家族(KMD1, KMD2, KMD4)基因的表达。由于MKD蛋白的功能是介导ARR蛋白的降解 [13] ,由此KMD家族的上调会降低ARR1和ARR12蛋白的稳定和抑制它们的累积(图2)。ARRs和PLTs的相互抑制因此形成一个相互反馈调控机制(见图2),在过渡区内该机制平衡的结果导致细胞从快速分裂向分化过渡。
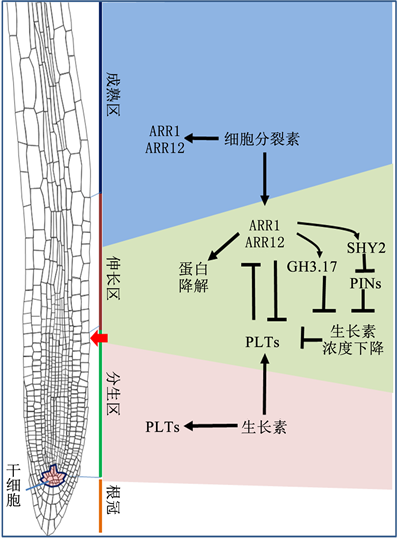 注:该假说认为拟南芥根尖分生组织中PLTs和ARR1/ARR12之间存在相互抑制,且该相互抑制关系可以解释细胞分裂向细胞分化过渡。该相互抑制作用体现在:ARR1和ARR12可以抑制PLT1和PLT2基因的转录;PLT可以直接与KMD1,KMD2,KMD4基因的启动子结合上调这些基因的表达,这些基因的产物直接参与ARR1和ARR12蛋白的降解 [13] 。此图为作者参考文献 [13] 绘制。
注:该假说认为拟南芥根尖分生组织中PLTs和ARR1/ARR12之间存在相互抑制,且该相互抑制关系可以解释细胞分裂向细胞分化过渡。该相互抑制作用体现在:ARR1和ARR12可以抑制PLT1和PLT2基因的转录;PLT可以直接与KMD1,KMD2,KMD4基因的启动子结合上调这些基因的表达,这些基因的产物直接参与ARR1和ARR12蛋白的降解 [13] 。此图为作者参考文献 [13] 绘制。
Figure 2. The PLTs/ARRs mutual-inhibition hypothesis
图2. PLTs/ARRs双向抑制假说
本文简要介绍了目前有关拟南芥根尖分生组织中细胞从快速分裂向快速分化过渡的分子调控机理的3个假说,其中PLTs/ARRs双向抑制假说为最新。该假说既综合了“生长素-PLTs假说”和“生长素最小值假说”的内容,同时又补充了最新发现的有关PLTs与ARRs之间的相互抑制作用的实验数据。随着研究的深入,将会发现更多有关拟南芥根尖分生组织中细胞从快速分裂向快速分化过渡的分子调控机理的新知识,进一步深化我们对该调控机理的认识。
基金项目
本研究得到了重庆师范大学人才基金(12XLR36)的资助。
NOTES
*通讯作者。