摘要: 微藻–真菌共生体在净化废水和生物固碳方面已成为一种具有潜力的新型生物处理技术。相比单一微藻而言,藻菌共生可实现微藻和真菌在代谢功能互补,强化废水中营养物质摄取和CO
2固定以及利于收获和降低成本。本文以普通小球藻和螺旋聚孢霉为实验材料,以成球率、生物量和叶绿素a (Chl-a)含量为考察指标,筛选不同转速、藻菌接种比、光强和GR24 (一种独脚金内酯人工合成类似物)浓度等因素对小球藻–螺旋聚孢霉共生体系构建的影响。结果发现,在160 rpm转速下,藻菌接种比为1:30时,藻菌球成球率和均一性最佳;在6000 lux光强下,添加10
−7 M GR24可有效提高小球藻光合性能和藻菌生物量。这为人工构建微藻–真菌共生体提供了一定的技术支撑。
Abstract:
Algal-bacteria symbiote has become a potential biological treatment technology for wastewater purification and carbon sequestration. Compared with a single microalgae treatment technology, algal-bacteria symbiote can realize complementary metabolic functions between algae and fungi, enhance nutrient uptake and CO2 fixation in wastewater, and facilitate harvest and cost reduction. In this paper, Chlorella vulgaris and Clonostachys rosea were used as experimental materials, and the pellet formation rate, biomass and chlorophyll a (Chl-a) content were used as inves-tigation indexes to screen the effects of rotating speeds, algal/bacterial inoculation ratio, light intensity and GR24 (a synthetic analog of strigolactone) concentration on the construction of the symbiosis system. The results showed that when the inoculating ratio was 1:30 at 160 rpm, the pellet formation rate and uniformity of algal bacteria were the best. Under a light intensity of 6000 lux, adding 10−7 M GR24 can effectively improve the photosynthetic performance and biomass. The result can provide technical support for the artificial construction of algal-bacteria symbiote.
1. 引言
近年来,我国大力发展清洁能源产业,2020年计划建成超130,000处大中小型沼气工程,农村沼气池普及4300余万户,沼气利用约达440亿m3 [1] [2] 。与此同时,随着国家工业化程度的提高,工业废水也仍然是我国水环境污染的重要来源。来自不同行业的工业废水成分差异巨大,其中重金属污染受到越来越多的关注。随着国内经济的进一步发展,废水处理问题成为重中之重。
当前,针对沼液的传统污水处理工艺主要有活性污泥法、膜浓缩法、化学絮凝法等,但提高处置效率有待进一步研究和细化,而重金属处理方法包括化学沉淀法、离子交换技术、吸附法、膜过滤技术、混凝–絮凝重金属处理法、气浮法和电化学处理法,传统的处理方法使用不同原理,因此也有在成本和处理能力等方面有不同的优点和劣势 [3] 。利用藻、菌等生物材料净化废水是具有潜力且运行稳定的新型污水处理工艺,目前已经证实细菌、真菌、酵母和藻类都有对重金属的生物吸附的能力,且吸附后具有隔离金属的能力,能够高效、快速地处理溶液中的重金属,使其从水中分离出来,达到净化的效果,是处理低浓度、大容量的废水的最佳选择 [4] 。此外,构建藻菌共生体对沼液进行净化,对比传统生化法,对氮的去除效率可提高约20% [5] 。通过使用栅藻与野生真菌构成的藻菌体系处理废水,结果发现,可以达到100%的总氮和96%的磷酸盐的去除率,并积累了2.74 g/L的生物量 [6] 。藻菌共生体系在去除氮、磷、重金属、难降解的有机物方面都具有明显优势 [7] 。由于微藻可以通过光合作用固定大量二氧化碳,不仅可以将废水中的污染物转化为有机物,还可以帮助缓解全球变暖 [8] 。构建藻菌共生体不仅可以提高微藻、真菌的生长效率,提高废水处理效率,同时还可以解决微藻难以回收的问题,但是目前对于藻菌之间的相互关系、代谢机制以及各自所发挥的作用尚不明确。
目前发现GR24 (一种新型植物激素,独脚金内酯的人工合成类似物),能够根据环境变化和养分的可利用性调控植物的发育过程 [9] [10] ,可以促进丛枝菌根真菌的分支 [11] [12] 。独脚金内酯成功地诱导单针藻积累油脂,将独角金内酯成功应用到藻类中 [13] 。目前已经证实,独角金内酯类似物GR24对藻类生长性能、光合性能都有促进作用 [14] 。
藻菌共生体作为一种新兴的重金属生物吸附材料,目前还没有系统地研究报道人工微藻–真菌共生体的构建工艺研究。目前已经有报道成功构建的藻菌共生体,但是目前藻菌共生体的数量有限,所以本文通过构建全新的藻菌共生体,并对其进行构建工艺研究,以便于将该项技术更广泛地应用于环境治理。
2. 材料与方法
2.1. 微藻与真菌的培养
实验所用菌种从土壤(采自青海玉树地区)中筛选,经划线分离法筛选出单一菌种后送至上海生工生物工程技术服务有限公司鉴定,鉴定结果为螺旋聚孢霉(Clonostachys rosea),采用PDB培养基于28℃,160 rpm条件下扩培,备用。普通小球藻(购自中科院武汉水生生物研究所),采用BG-11培养基于25℃,2000 lux,光暗比为12 h:12 h条件下进行扩培,备用。
2.2. 小球藻–螺旋聚孢霉共生体的构建
将培养至对数期的小球藻和螺旋聚孢霉按照不同的实验条件(转速、藻菌接种比、光强、GR24浓度)接种到BG11培养基,进行小球藻–螺旋聚孢霉共生体的构建。
2.3. 生物量的测定
收集培养藻菌共生体培养液,在4000 rpm离心10 min,收集沉淀物于60℃真空干燥至恒重,称量。
2.4. 叶绿素a含量的测定
取4 mL藻菌培养液,8000 rpm离心10 min,弃去上清液,向沉淀中加入4 mL体积分数为90%的丙酮,用漩涡混合器将沉淀与丙酮混匀使沉淀溶解完全。之后置于4℃黑暗环境中处理24 h,然后8000 rpm离心15 min,取上清液用紫外分光光度计分别测量630 nm、645 nm、663 nm和750 nm波长下上清液的吸光度,90%丙酮做空白对照。叶绿素a含量通过公式(1)计算。
(1)
式中,
表示叶绿素a含量,单位为mg/L;OD663、OD750、OD645、OD630分别为对应波长下测得的样品吸光度值。
2.5. 光合性能参数的测定
取5 mL藻菌培养液黑暗处理5 min后,迅速放入藻类叶绿素荧光测定仪测定光合性能参数。
3. 结果与分析
3.1. 不同转速对藻菌共生体成球率的影响

Figure 1. Algae-fungus symbiote cultured at 160 rpm for 4 days
图1. 160 rpm培养4d的藻菌共生体
采用140 rpm、160 rpm、180 rpm转速,按照1:30藻菌接种比,在25℃、2000 lux、LED光源、光暗比为12 h:12 h条件下进行藻菌共生体成球率的比较,结果发现,140 rpm和160 rpm成球率均达到180 ± 5颗/L,差异性不显著,但160 rpm藻菌球均一性较好,大小为0.3 ± 0.1 cm (如图1所示),140 rpm成球的均一性不佳且有菌丝沾底现象,180 rpm成球率较低,基本全部为藻菌沉淀物,因此确定160 rpm为最佳转速。
3.2. 不同藻菌接种比对藻菌共生体构建的影响
藻菌共生体的相互关系受到接种比的影响,不仅会影响微藻的生长效率,同时也会影响微藻的产脂率和废水处理效果 [15] 。在160 rpm按照1:10、1:30、1:60藻菌干重接种比,在25℃、2000 lux、LED光源、光暗比为12 h:12 h条件下培养4 d,结果如表1所示。当接种比为1:30时,藻菌共生体成球率较好,均一性最佳,其光合性能指标Fv/Fm达到0.68 ± 0.02。

Table 1. Photosynthetic performance parameters and morphological characteristics of algae-fungus symbiote
表1. 藻菌共生体的光合性能参数和形态特征
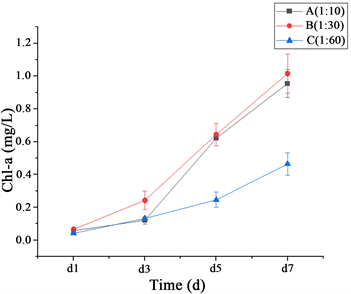
Figure 2. Chl-a content of the symbiote of Clonostachys rosea and Chlorella vulgaris with different inoculation ratios
图2. 不同接种比的螺旋聚孢霉–小球藻共生体Chl-a含量
如图2,实验结果表明,A、B组两个接种比中小球藻Chl-a的提升效果均优于C组。由于体系中螺旋聚孢霉生长优势导致对藻生长产生拮抗作用,从而使系统中总的小球藻生长明显迟缓。结合不同接种比下的藻菌共生体光合性能和成球优良性,最终确定1:30为藻菌共生体生长的最佳接种比。
3.3. 不同光强对藻菌共生体生物量和Chl-a含量的影响
由于小球藻附着在菌丝球上,对于光的吸收与正常在分散在培养基中时不同,所以需要探究不同光照强度对藻菌共生体生长条件的影响。实验考察藻菌共生体在2000 lux、4000 lux、6000 lux光强下,按照1:30藻菌接种比、160 rpm、25℃、LED光源、光暗比为12 h:12 h条件下培养4 d、6 d、8 d测定藻菌共生体生物量和Chl-a含量,结果图3和图4所示。在6000 lux光强下,其藻菌共生体生物量和Chl-a含量均达到最高,分别是514.85 ± 16.87 mg/L和2.27 ± 0.27 mg/L。最终确定在6000 lux光强下培养8 d,藻菌共生体生长达到最佳状态。
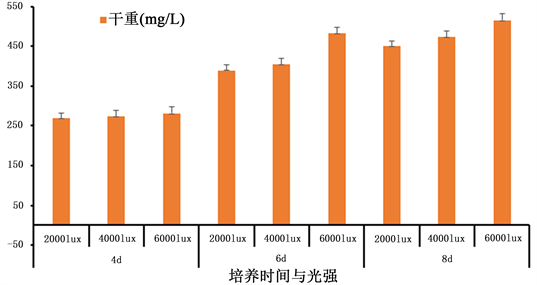
Figure 3. Changes of dry weight of algae-fungus symbiote under different light intensity and culture time
图3. 不同光强和培养时间下藻菌共生体干重变化
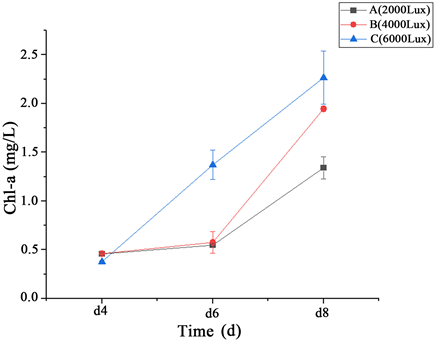
Figure 4. Changes of Chl-a content of algae-fungus symbiote under different light intensity and culture time
图4. 不同光强和培养时间下藻菌共生体Chl-a含量变化
微藻作为生态系统中的生产者,光合作用是其最重要的生理活动之一,光照强度会在一定程度下影响微藻的生长。产氧光合作用的光反应是由类囊体膜上的蛋白质–色素复合体催化的,主要包括光系统II (PSII)、细胞色素b6/f复合体、光系统I (PSI)和ATP合成酶 [16] 。光合作用的第一步是由LHC家族蛋白捕获光并传递激发能量到光合作用的反应中心,由LHCI和LHCII分别将能量传递到PSI和PSII,并且LHCII蛋白同时参与光保护机制,在强光条件下可以迅速可逆的切换到光保护状态,在这种状态下,多余的能量以热量的形式消散 [17] [18] 。所以当光照强度过高时,会触发LHC的光保护机制,反而影响光合作用,在一项使用小球藻构建藻菌共生体的研究中,发现光照强度升高6000 lux的藻菌共生体对氨氮的处理效果反而会下降 [19] 。而实验使用的光照强度升高到6000 lux藻菌共生体仍然可以正常生长,说明螺旋聚孢霉通过共生关系降低了光合作用光保护机制的阈值,或者是通过提高光合作用的光系统或者ATP合成从而提高光的利用率。
3.4. 不同GR24浓度对藻菌共生体光合性能参数的影响
从表2可以看出,添加GR24对藻菌共生体光合性能参数指标都有所提高,其中10−5 M和10−9 M对藻菌共生体光合性能影响不显著,10−7 M对藻菌共生体光合性能参数指标提升显著。另外,添加10−7 M GR24还能显著提高藻菌共生体的成球率和均一性,这可能是GR24改变了藻菌的代谢途径,进而影响其结合方式而使得其共生体系更加优良和稳定。因此,在构建藻菌共生体系时,采用GR24的最佳添加量为10−7 M。
根据文献报道,在单一微藻系统中,GR24会促进小球藻的生长性能和光合性能,并且随着GR24浓度的升高到10−7 M时达到最好生长效果,随后增加GR24会有所降低 [20] 。从图5中可以看到,在GR24浓度为10−5 M时,藻菌共生体的菌丝球大小和均一性均明显变差。在高浓度下的GR24,猜测一方面是过高的GR24可能会影响真菌的生长,影响真菌成粒的大小;另一方面可能由于藻菌共生体依靠的共生关系受到高浓度的GR24影响,而使藻菌共生体的成球均一性变差。

Figure 5. Algae-fungus symbiote with different concentrations of GR24 were added
图5. 加入不同GR24浓度的藻菌共生体

Table 2. Effects of different GR24 concentrations on photosynthetic performance parameters of algae-bacteria symbiote
表2. 不同GR24浓度对藻菌共生体光合性能参数的影响
4. 结论与展望
通过上述单因素实验设计,确定在25℃、LED光源、光暗比为12 h:12 h条件下,以160 rpm、藻菌接种比1:30、光照强度为6000 lux构建的小球藻–螺旋聚孢霉共生体生长状态良好,成球率达到180 ± 5颗/L,大小均一,直径为0.3 ± 0.1 cm,生物量和Chl-a含量均达到最高,分别是514.85 ± 16.87 mg/L和2.27 ± 0.27 mg/L。另外,添加10−7 M GR24可显著改善藻菌共生体的光合性能,在成球率和均一性上也有所提高。因此,在上述筛选的最优条件下,构建的小球藻–螺旋聚孢霉共生体生长稳定,为该技术在环境治理方面的研究奠定了材料基础,同时,可为进一步开展其他微藻–真菌共生体的构建提供工艺参考。