摘要: 利用三维荧光光谱(EEMs)结合平行因子分析法(PARAFAC),分析了太湖河网夏季的真溶液态及胶体态的可溶性有机物(DOM)含量及组分变化。结果表明:PARAFAC识别出3类荧光组分,分别是C1 (Ex = 255 nm,Em = 451 nm,类腐殖质组分),C2 (Ex = 240 nm,Em = 392 nm,类腐殖质组分),C3 (Ex = 230 (275) nm,Em = 337 nm,类蛋白质物质)。其中主要的可溶性有机物为C1组分,胶体态中,类腐殖质C1组分的相对贡献率在32.1%~49.2%之间,均值为39.1%。真溶液态中,类腐殖质C1组分的相对贡献率在38.0%~55.5%之间,均值为48.6%;其中C1、C2组分表现出外源、陆源双重特性,C3属于生物降解的类蛋白质物质。
Abstract:
Three-dimensional fluorescence spectroscopy (EEMs) combined with parallel factor analysis (PARAFAC) was used to analyze the soluble organic matter (DOM) content and composition changes in the true solution and colloidal states of the Taihu River Network in summer. The results showed that PARAFAC identified three types of fluorescent components, C1 (Ex = 255 nm, Em = 451 nm, humus-like component), C2 (Ex = 240 nm, Em = 392 nm, humus-like component), C3 (Ex = 230 (275) nm, Em = 337 nm, protein-like substance). The main soluble organic matter was the C1 component. In the colloidal state, the relative contribution rate of humus like C1 component is 32.1%~49.2%, with an average of 39.1%. In the true solution state, the relative contribution rate of humus like C1 component is between 38.0% and 55.5%, with an average of 48.6%. Among them, the C1 and C2 components showed the dual characteristics of exogenous and terrestrial, and C3 was a biodegradable protein-like substance.
1. 前言
溶解有机物(dissolved organic matter, DOM)是水生生态系统中一种重要的化学组分,主要由亲水性有机酸、类蛋白、类氨基酸、类腐殖酸和碳水化合物等组成。不同环境特征的可溶性有机物种类和特征具有明显的差异 [1]。一般认为,水生生态系统中的DOM主要来源于水体内源(水生植物、浮游植物和微生物的原位生产和分解)和外源输入(包括降水、径流和废水) [2]。由于DOM广泛存在水生生态系统并具有环境效应,对DOM的质量和数量的监测可以帮助人们可以更好地了解水生环境 [3]。因此,人们更加意识到对于水生生态系统中DOM的来源、质量和数量以及与DOM相关的环境因素研究的重要性。三维荧光光谱分析有着高灵敏的特点,也因此成为研究DOM的组成和光谱特征的重要手段,目前广泛应用于河口 [4] 和沉积物 [5] 等环境中DOM的特征研究。
太湖是中国第三大淡水湖,位于长江三角洲,面积2338.1 km2 [6]。太湖流域面积为36,900 km2,为流域内约1000万人口提供饮用水 [7]。它是一个典型的浅水富营养化湖泊,其北部和西北部以浮游植物为主,东南部以大面积的大型水生植物为主。湖泊的高度空间异质性被认为是过去30年湖泊流域经济繁荣的结果 [6] [8]。太湖北部和西北部子流域的特点是高度城市化的城镇和高人口密度,而西南部支流的特点是流经山地森林和农田 [9]。与太湖相连的河流或渠道有172条 [6],大部分入湖河流主要分布在流域的西部和西北部;然后水向东向南流动,通过太浦河排入中国东海。太湖是附近城市家庭以及工业和农业活动的污水储存库 [7]。由于湖水的高营养负荷,藻类水华发生在整个夏季,覆盖范围相对较大,尤其是在太湖北部和西北部海湾 [8],太湖高DOM负荷对太湖流域的水质和安全构成威胁 [10]。太湖河网作为太湖水体的主要来源,其DOM含量与组成对太湖水质等理化指标的变化有着重大的作用,太湖河网的DOM组成和特性的研究,对评估太湖水体有机物来源具有重要意义。因此本文以太湖河网为研究对象,采用三维荧光光谱结合平行因子分析法,分析太湖河网水体中不同粒级的DOM组成结构特征,揭示DOM空间分布规律,丰富太湖河网的DOM相关资料,为更进一步的研究DOM在太湖中的相关特性提供基础信息。
2. 材料与方法
2.1. 采样点设置及样品采集
本研究于2020年7月对太湖河网水体进行采样,为了探究太湖河网胶体与真溶液的CDOM特征,共设置了22个采样点,样点设置均匀分布于太湖河网,采样点分布如图1所示。采集后的水样放于清洗过的聚乙烯瓶中,将采样瓶放置于4℃保温箱内避光保存,寄回实验室分析测试。
2.2. 样品分析方法
2.2.1. 不同粒级分离
将采集回的水样使用真空泵进行初滤(过0.7 µm滤膜),随后将初滤后的水样使用超滤杯充入氮气进行超滤,其中超滤杯中的膜选用1KDa的滤膜,超滤后的截留液即为胶体态样品(1 KDa~0.7 µm),过滤液为真溶液态样品(<1 KDa)。随后对以上两种样品进行三维荧光光谱测定。
2.2.2. 荧光光谱检测
三维荧光光谱测定采用F97 Pro荧光分光光度计进行三维荧光光谱的测定。设置参数如下:激发波长(Ex)设置范围200~450 nm,波长间隔5 nm;发射波长(Em) 250~600 nm,波长间隔为1 nm,扫描速度为10,000 nm·min−1,激发和发射带宽设定为5 nm。使用超纯水的三维荧光光谱作为空白对照,所有样品的三维荧光光谱均需进行空白扣除及去除拉曼散射。
3. 结果与讨论
3.1. 三维荧光光谱
利用PARAFAC方法解析不同水期水样三维荧光图谱,对胶体态及真溶液态水样进行解析,共鉴别出3种组分(图2),其中包括两个类腐殖质组分(C1和C2)和一个类蛋白质组分(C3)。结合前人相关研究成果(表1),综合分析得到:组分C1 (Ex = 255 nm,Em = 451 nm)为类腐殖质物质,具有一个激发峰和发射峰,对应荧光峰A峰(250~260 nm/380~480 nm)区域,该类物质为外部输入的陆源类腐殖质。组分C2 (Ex = 240 nm, Em = 392 nm)具有一个激发峰和发射峰,与组分A一样同为外部输入的陆源类腐殖质。组分C3 (Ex = 230 (275) nm, Em = 337 nm)具有两个激发峰和一个发射峰,位于传统的T峰区域(220~230 (275)/320~350 nm),该荧光组分与类色氨酸物质产生的光谱峰相似 [11] [12],属于生物降解的类蛋白质物质,大多数是陆生植物或土壤有机质自生源产生过程生成的蛋白质成分,或其降解出来的较少的色氨酸 [12]。
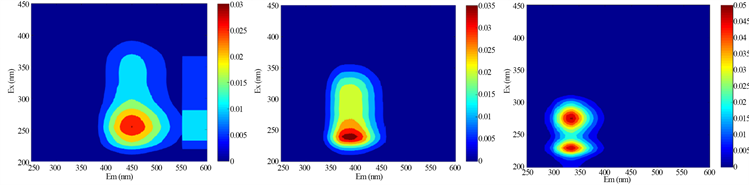
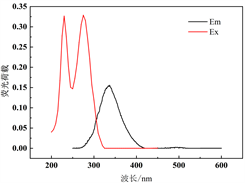
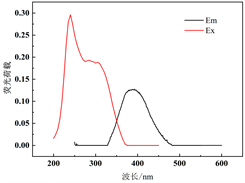
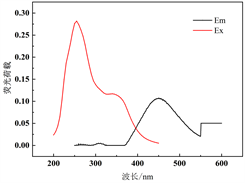
Figure 2. PARAFAC resolves three fluorescence components and their excitation emission wavelength positions
图2. PARAFAC解析出3个荧光组分及其激发发射波长位置

Table 1. Spectral characteristics of three fluorescence components
表1. 3种荧光组分光谱特征
为了明确DOM组分的相对贡献情况,对各组分荧光强度数据进行分析计算,得出太湖河网22个样点胶体态和真溶液态各组分荧光强度及相对贡献率(图3)。整体来看,真溶液态的C1组分荧光强度相较胶体态C1组分略高,真溶液态的C2组分荧光强度相较胶体态的C2组分略低。胶体态类腐殖质C1组分的相对贡献率在32.1%~49.2%之间,均值为39.1%;胶体态类腐殖质C2组分的相对贡献率在27.2%~39.1%之间,均值为33.5%;胶体态类蛋白质物质C3组分的相对贡献率在15.3%~36.5%之间,均值为27.4%。真溶液态类腐殖质C1组分的相对贡献率在38.0%~55.5%之间,均值为48.6%;真溶液态类腐殖质C2组分的相对贡献率在22.7%~31.4%之间,均值为27.6%;真溶液态类蛋白质物质C3组分的相对贡献率在13.1%~35.6%之间,均值为23.9%。真溶液态中C1组分相较C2、C3组分丰度较高,在6号点位达到最低值之后逐步升高保持在较高比例,C2、C3丰度基本维持在同一水准。胶体态中C1组分丰度优势降低,但相较C2、C3组分仍处于优势地位。在真溶液态及胶体态中,各个点位的C1、C2、C3组分的变化基本一致,在6号点处C1组分相对比例最低,C3组分相对比例最高。在20号点处C1、C2组分相对比例最高,C3组分相对比例最低。
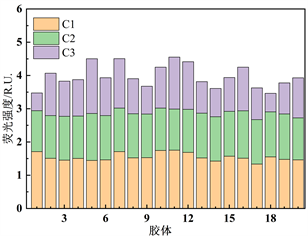
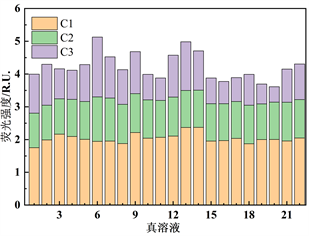
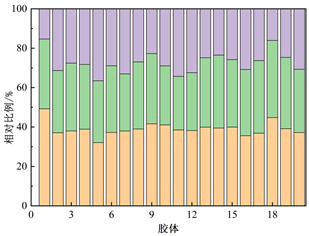
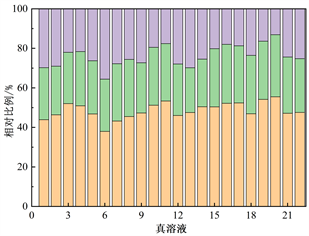
Figure 3. Fluorescence intensity and relative proportion of DOM components in colloidal state and real solution
图3. 胶体态、真溶液态DOM组分荧光强度及相对比例
3.2. 各荧光组分之间相关性分析
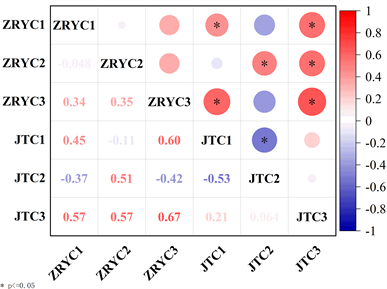
Figure 4. Correlation analysis of DOM fluorescence components in colloidal state and real solution
图4. 胶体态、真溶液态DOM荧光组分相关性分析
DOM的组成和结构参数的相关性变化可以解释内外源输入机制与变化,为了进一步研究太湖河网水体样品的DOM特征,本研究对胶体态和真溶液态共44个表层水体样本进行了皮尔逊相关性分析,探究了DOM各荧光组分的关系(图4)。结果表明,胶体态的C1、C2和C3组分分别与真溶液态的C1、C2、C3组分呈正相关关系(P < 0.05),这说明胶体态与真溶液态的C1、C2、C3组分具有一致性。胶体态C1组分与胶体态C2组分呈负相关(P < 0.05),说明在胶体态中C1、C2组分可能不是同一来源。
4. 结语
通过三维荧光光谱分析太湖河网DOM 的组成结构,太湖河网中的DOM主要是有三种组分,其中两类为类腐殖质物质一类为类蛋白质物质,其中C1、C2组分表现出外源、陆源双重特性,C3属于自源产生的类蛋白质物质。整体来看,C1组分在真溶液态所占相对比例略高于胶体态,C2组分胶体态所占相对比例略高于真溶液态,C3组分在两种状态下相对比例差别不大。