1. 引言
动脉粥样硬化(Atherosclerosis, AS)是一种大、中动脉的慢性炎症性疾病 [1]。AS可引起缺血性心脏病、中风和外周血管疾病,这些疾病统称为心血管疾病 [2]。中国心血管疾病流行病学的一个重要特征是动脉粥样硬化性心血管疾病负担逐年增加且日益迅速。2016年约有240万人死于动脉粥样硬化性心血管疾病,占心血管疾病死亡人数的61%和所有死亡人数的25% [2]。动脉粥样硬化性心血管疾病包括缺血性心脏病和缺血性中风。目前,在中国和国际心血管病防治的指南中,动脉粥样硬化性心血管疾病风险评估已在很大程度上取代了缺血性心脏病的风险评估,并已广泛应用于临床实践 [3]。动脉粥样硬化最初是从内皮对损伤的反应开始,然后是血管壁中的脂质堆积,持续性炎症的消退受损,以及斑块破裂和血栓形成 [4]。基于动脉粥样硬化发展的“脂质”和“炎症”假说,降脂他汀类药物和抗炎药成为动脉粥样硬化治疗的基石 [5]。然而,某些患者对他汀类药物的反应较差 [6]。因此,动脉粥样硬化的新疗法依然在发展中。
中药在治疗动脉粥样硬化疾病中应用广泛 [7]。降脂通脉胶囊含五味药材:决明子、姜黄、泽泻、三七、铁线草。该胶囊具有降脂通脉护肝、寒温兼顾、辛开苦降、渗湿泻热、活血化瘀、祛风活络及行气通经等功效,可化痰祛湿,活血通脉 [8]。可用于高脂血症、非酒精性脂肪性肝炎的治疗 [9] [10]。另外,还可以用于防止动脉粥样硬化,治疗颈动脉硬化 [11]。降脂通脉胶囊还可降低颈动脉内膜厚度,减少颈动脉斑块大小和厚度,在一定程度上可阻断和逆转颈动脉粥样斑块,特别是不稳定斑块 [12]。但其使用仍存在许多困难,如成分复杂、药理机制不明确,这阻碍了其在临床的广泛使用和推广 [12]。
本文运用网络药理学方法(Network pharmacology) [13] 对降脂通脉胶囊的有效活性成分和动脉粥样硬化疾病相关靶点进行检索、筛选、预测分析,为降脂通脉胶囊在动脉粥样硬化中的后续研究提供基础(研究过程见图1)。
2. 材料与方法
2.1. 降脂通脉胶囊药物成分的筛选
分别以决明子、姜黄、泽泻、三七为关键词检索TCMSP数据库(https://old.tcmsp-e.com/index.php)。对所得成分按口服生物利用度OB ≥ 30%、类药性DL ≥ 0.18进行筛选,汇总符合条件的成分。检索已发表的文献口服生物利用度和药物相似性不达标但具有良好治疗作用的成分进行补充。根据已发表的文献对铁线草的成分进行汇总和筛选。
2.2. 降脂通脉胶囊药物成分–靶点网络构建
通过TCMSP数据库、Herb数据库和CTD数据库查找降脂通脉胶囊有效成分的作用靶点。利用Uniprot蛋白质数据库,限定物种为“Homo Sapiens”,对活性成分的靶点进行基因标准化处理。利用Cytoscape 3.7.1软件构建药物–活性成分–靶点网络图。
2.3. 动脉粥样硬化相关靶点筛选
以“atherosclerosis”为关键词检索Gene Cards数据库获取动脉粥样硬化的相关靶点基因,获得对动脉粥样硬化相关靶点。利用Venny 2.1将降脂通脉胶囊作用靶点与动脉粥样硬化靶点的重合部分绘制韦恩图,得到共同靶点。
2.4. PPI网络分析
将所获得的重合靶点导入STRING平台,使用选择“multipleproteins”模式,种属设置为“Home sapiens”。分析结果设置最低相互作用阈值“highest confidence (≥0.900)”,network type为“physical subnetwork”,network display options为“hide disconnectednodes in the network”,其余参数保持默认,建立药物–疾病靶标PPI相互作用网络。
2.5. GO功能富集分析及KEGG通路富集分析
将所获得的重合靶点以Ensembl ID形式导入OmicShare云平台,进行GO功能和KEGG信号通路进行可视化分析。
2.6. 药物成分–靶点–通路网络构建
将STRING平台获得的tsv文件导入Cytoscape 3.7.1软件,利用内置分析工具的MCC法进行分析,选取度值前10的作用靶点,回溯寻找这些靶点的活性成分和下游通路,构建“药物成分–靶点–通路”网络图。
3. 结果
3.1. 降脂通脉胶囊活性成分
利用TCMSP数据库结合网络文献检索降脂通脉胶囊中的五味中药,即:决明子、姜黄、泽泻、三七、铁线草,按照OB ≥ 30%、DL ≥ 0.18共检索得到31个活性成分,其中决明子获得14个活性成分,姜黄获得3个活性成分,泽泻获得10个活性成分,三七获得8个活性成分,铁线草获得1个活性成分,具体见表1。

Table 1. Active components of Jiangzhi Tongmai Capsules (OB ≥ 30%, DL ≥ 0.18)
表1. 降脂通脉胶囊活性成分(口服生物利用度 ≥ 30%、类药性 ≥ 0.18)汇总
3.2. 降脂通脉胶囊活性成分–靶点网络分析
利用TCMSP、Herb数据库和CTD数据库收集降脂通脉胶囊中药物活性成分的作用靶点,去重后共得到248个潜在靶点。利用Cytoscape软件根据构建药物–活性成分–靶点网络。如图2所示,共包含287个节点,邻居的平均数量(average number of neighbors)为3.422。
3.3. 药物–疾病靶点收集
通过GeneCards数据库得到动脉粥样硬化相关靶点4848个。通过Venny 2.1将当降脂通脉胶囊活性成分的靶点与动脉粥样硬化靶点绘制韦恩图取交集(图3),得到共同靶点186个,占靶点总数的3.8%。

Figure 2. A network of Jiangzhi Tongmai Capsules active compounds and the corresponding targets. Pink nodes stand for herbs of Jiangzhi Tongmai Capsules, green nodes stand for active compounds, yellow nodes represent the targets
图2. 降脂通脉胶囊活性成分–靶点网络图。粉色代表中药名称,绿色代表活性成分,黄色代表作用靶点

Figure 3. The Venn diagram of overlapped targets between Jiangzhi Tongmai Capsules active targets and atherosclerosis-related targets
图3. 降脂通脉胶囊活性成分靶标对动脉粥样硬化相关靶标的Venn图
3.4. 靶点蛋白互作网络构建及拓扑分析
为进一步明确降脂通脉胶囊潜在靶点与AS靶点间的相互作用关系,将两者共有靶基因上传至STRING平台获得PPI网络,经过“highest confidence (≥0.900)”和去除单独节点后,共得到边数215条,平均节点度值为1.81,平均本地聚类系数为0.374,见图4。将所得的short TSV文件导入cytoscape软件,利用cytohubba寻找hubgene,前10位hubgenes为VEGFA、AKT1、MMP9、TNF、IL6、PTGS2、CASP3、EGF、IL1B、IL10 (见表2)。
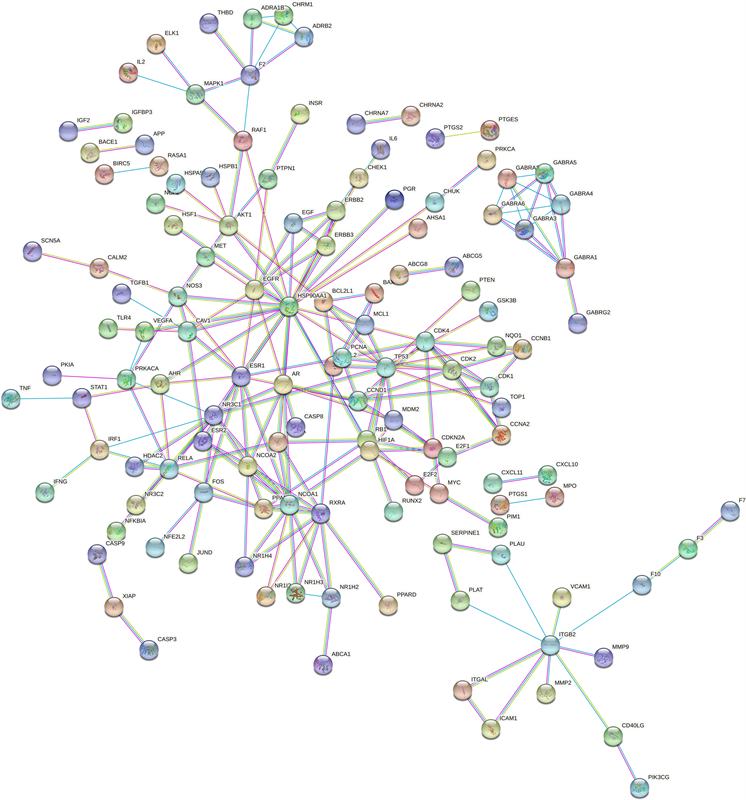
Figure 4. PPI network diagram of the targets of Jiangzhi Tongmai Capsules and atherosclerosis
图4. 降脂通脉胶囊对动脉粥样硬化靶点的PPI网络

Table 2. The top 10 hub genes
表2. 前10位hub genes
3.5. 降脂通脉胶囊涉及的GO功能与KEGG通路的富集分析
运用OmicShare云平台对筛选到的靶点进行GO注释分析,获得GO-BP生物过程(biological process, BP) 6249个,GO-CC细胞组成(cellular component, CC) 534个,GO-MF分子功能(molecular function, MF) 967个(见图5)。经过分析,结果可见生物过程涉及对刺激的反应、生物过程的正/负向调控、免疫系统过程、代谢、生物粘附、细胞聚集等;细胞组成主要涉及细胞外区部分、膜封闭腔、细胞外区、细胞器部分、大分子复合物、细胞连接、超分子纤维等;分子功能主要体现在信号传感器激活、催化活性、分子换能器活性、分子功能调节剂、抗氧化活性、趋化活性等。
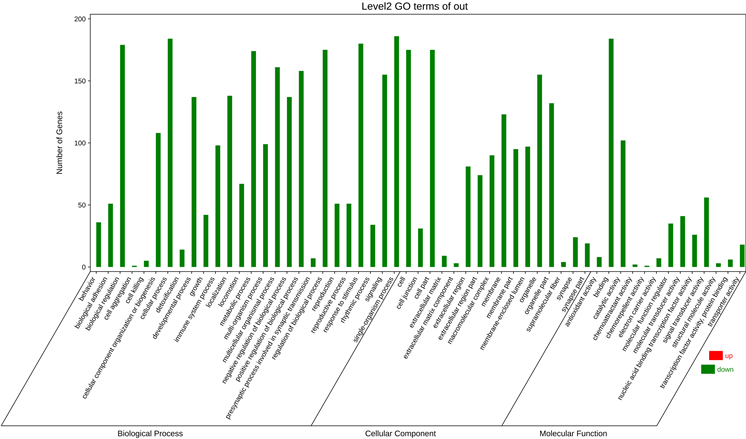
Figure 5. GO enrichment analyses of potential targets of Jiangzhi Tongmai Capsules against atherosclerosis
图5. 降脂通脉胶囊对动脉粥样硬化潜在靶点的GO富集分析
KEGG通路富集结果显示,潜在的降脂通脉胶囊抗动脉粥样硬化的靶点富集在261条通路上。选取排名前25通路,运用OmicShare平台绘制气泡图,其中气泡大小表示基因数目,颜色差异代表基因富集的显著性。图6可以看出,降脂通脉胶囊抗动脉粥样硬化的相关通路有PI3K-Akt signaling pathway (37个靶点)、AGE-RAGE signaling pathway in diabetic complications (30个靶点)、Fluid shear stress and atherosclerosis (30个靶点)、IL-17 signaling pathway (23个靶点)、TNF signaling pathway (23个靶点)等,提示降脂通脉胶囊的活性成分主要是通过这些通路在动脉粥样硬化过程中发挥作用的。

Figure 6. Bubble chart of KEGG pathway potential analysis of targets of Jiangzhi Tongmai Capsules against atherosclerosis
图6. 降脂通脉胶囊对动脉粥样硬化潜在靶点的关键KEGG富集分析的气泡图
3.6. 降脂通脉胶囊药物–靶点–通路网络图
采用Cytoscape软件对筛选出的活性成分、hubgenes、及通路进行可视化分析(图7)。

Figure 7. Network of herb-compound-target-pathway
图7. 药物–成分–靶点–通路网络图
4. 讨论
动脉粥样硬化是一种与高发病率和死亡率相关的慢性炎症性疾病 [14]。随着我国老龄化进程,动脉粥样硬化引起的心脑血管疾病的发病率逐年上升,因此迫切需要加强治疗动脉粥样硬化的药物研发。动脉粥样硬化患者通常使用他汀类药物、阿司匹林、硝酸甘油等类型的药物进行治疗 [15]。他汀类药物主要用于血脂高的动脉粥样硬化,阿司匹林主要作用是抗血小板聚集,硝酸甘油作用于血管平滑肌的松弛 [16]。但这些药物疗效不完善,长期服用常导致心肌梗塞和脑卒中,严重影响患者的生活质量 [7]。中医药治疗动脉粥样硬化已有多年历史,研究人员发现一些中药及其活性成分似乎是治疗动脉粥样硬化的重要来源 [17]。开发安全有效的多靶点治疗动脉粥样硬化的药物仍是当务之急。本文使用网络药理学的方法,对降脂通脉胶囊在动脉粥样硬化中的作用机制进行了预测,以期为后续研究提供基础。
本研究首先通过网络药理学方法,筛选了降脂通脉胶囊的有效成分,其中包含大黄酸(rhein)、芦荟大黄素(aloe-emodin)、槲皮素(quercetin)、木犀草素(luteolin)等活性成分。大黄酸可通过线粒体依赖性细胞凋亡抑制TNF-α诱导的人主动脉平滑肌细胞增殖,而且可保护内皮细胞免受氧化损伤,具有抗动脉粥样的潜力 [18] [19]。芦荟大黄素可增强AMBRA1介导的内皮自噬产生抗动脉粥样硬化作用 [20]。槲皮素可抑制树突状细胞活化预防动脉粥样硬化,可降低高胆固醇饮食喂养的动脉粥样硬化大鼠中TLR和TNF-α的升高,抑制人外周血单个核细胞中细胞因子的释放,是预防动脉粥样硬化的有前途的药物 [21] [22]。木犀草素主要通过抑制炎症与氧化应激发挥抗动脉粥样硬化的作用 [23]。
本研究通过网络药理学方法发现,降脂通脉胶囊可能通过多靶点、多通路对动脉粥样硬化发挥调控作用。PPI分析发现RXRA、CDK1、GABRA1、GABRA4、GABRA6、NR3C1等基因为降脂通脉胶囊在动脉粥样硬化中的关键靶基因。RXRA附近基因区域SNP之间的相互作用会抑制血脂异常患者接受非诺贝酸治疗后的apoB减少 [24]。降脂通脉胶囊对该基因的靶向性使其具有替代他汀类药物的潜力。GO富集分析结果显示降脂通脉胶囊靶向动脉粥样硬化的蛋白功能主要体现在对刺激的反应、生物过程的正/负向调控、代谢、细胞聚集、信号传感器激活、催化活性、分子换能器活性、分子功能调节剂、抗氧化活性等。这些功能与动脉粥样硬化疾病进展密切相关。KEGG通路分析主要涉及PI3K-Akt信号通路、AGE-RAGE信号通路、IL-17信号通路、TNF信号通路等。其中PI3K-Akt信号通路包含靶点数目较多。PI3K-Akt通路在巨噬细胞的存活、增殖和迁移中起着至关重要的作用,影响动脉粥样硬化的发展 [25]。AGE-RAGE信号通路是高胆固醇血症和糖尿病引起动脉粥样硬化的重要途径 [26] [27]。IL-17是动脉粥样硬化的调节剂,在小鼠模型中可能影响动脉粥样硬化斑块大小 [28]。TNF通路抑制剂可降低动脉粥样硬化事件发生率 [29]。因此,降脂通脉胶囊极有可能通过介导这些通路起到抗动脉粥样硬化作用。
本研究仅仅使用网络药理学探讨了降脂通脉胶囊在动脉粥样硬化中的可能机制。后续需要更多的体外和体内实验验证这些机制。
本文通过网络药理学及分子互作网络,初步预测降脂通脉胶囊的有效成分及其在抗动脉粥样硬化的作用中发挥作用的可能靶点,结果显示降脂通脉胶囊可通过多成分、多靶点、多通路的方式发挥抗动脉粥样硬化的作用。本研究为后续开展实验验证降脂通脉胶囊抗动脉粥样硬化机制研究奠定基础,为降脂通脉胶囊片的临床应用提供一定的参考价值。
NOTES
*通讯作者。