1. 引言
海草床因能净化水质、为其它海洋生物提供索饵场和庇护所等生态功能而倍受重视 [1],其碳汇功能也引起了学者们的兴趣 [2],故海草床的养护、恢复得到了广泛关注,其生态修复行动也在全球兴起 [3]。鳗草(Zostera marina),也称大叶藻,是北温带近海海草床的优势种,广泛分布于我国黄、渤海泥沙底质的近海。鳗草种群因陆源污染、围填海等原因遭受破坏、衰退严重 [4],因此,如何有效恢复鳗草种群成为一个重要的问题。
在水流、潮汐、风浪,大型底栖生物等的作用下,潮间带会出现不同的微生境 [5]。这些微生境的显著特征之一是沉积物容重不同 [6]。潮间带沉积物在潮汐等物理作用下会发生水平扩散、垂向混合,会使沉积物中鳗草种子的埋深发生变化。容重不同的沉积物中粒径、有机质含量也不同,这些差异会导致沉积物微生境中大型底栖生物群落的异质性 [7],研究表明大型底栖动物的生物扰动可影响鳗草种子的埋深 [8],种子埋深和沉积物的类型又会影响鳗草的种子萌发和幼苗建成 [9] [10],因此,作者推测潮间带沉积物容重微生境会影响鳗草种子的萌发和幼苗的出土。种子萌发、实生苗建成是鳗草种群恢复的关键阶段,相关研究多以实验生态学的方法进行 [11],野外调查多关注鳗草花枝密度及其影响因素 [12]、鳗草的种子产力 [13]、沉积物种子库中种子的保存时限 [14]、营养盐补充对实生苗补充的作用及其对幼苗觅食行为的影响 [15]、幼苗存活的生境(含大型底栖生物种类、水层、遮荫、硫化物等要素)及遗传因素的作用 [16] [17] [18]。对鳗草实生苗分布的调查相对罕见,偶见对山东省天鹅湖鳗草海草床的研究,研究虽划分了连续性海草床、边缘区域及鳗草斑块等微生境,但研究关注点是实生苗发育的物候学特征 [19]。沉积物容重所致的微生境在潮间带鳗草海草床中普遍存在,且这些微生境中鳗草的盖度存在差异。然而,尚未见有研究关注不同沉积物容重微生境中鳗草幼苗的出土和分布情况。此外,作者长期观察发现,潮间带鳗草新出土的幼苗多成簇生长。故,本文对威海杨家湾潮间带鳗草海草床开展野外调查,明确潮间带沉积物不同容重微生境下鳗草幼苗的分布模式、并解析沉积物容重对鳗草幼苗出土的影响,研究结果将为从沉积物容重的角度评估鳗草海草床自然恢复潜力、决策利用播种恢复其种群可行性等提供理论依据。
2. 研究方法
2.1. 研究海域
研究地山东威海杨家湾地理位置见图1,该湾为面积54 km2的威海湾的一个小内湾,潮汐类型为不规则半日潮,年均水温12℃,潮间带冬季不结冰,低潮潮位0.45 m,高潮潮位2.56 m,落潮后潮间带受阳光直射时间可达3.5 h。鳗草在潮间带形成连续分布的海草床,于5月底进入花期,种子于7月进入成熟期并开始脱落进入沉积物,形成种子库。鳗草种子库为暂时种子库,种子于1月开始萌发,在3月进入萌发高峰期。
2.2. 幼苗的采集和测定
2021年3月20日,在大潮低潮时,于杨家湾潮间带随机设置29个0.25 m2 (0.5 m× 0.5 m)的样方,用环刀法测定每个采样点的沉积物容重,用铁锨将出土幼苗连同沉积物完整铲出,将样方内所有出土幼苗带回实验室,计数并测定轴状胚轴的长度。此外,在现场随机测定51株幼苗的轴状胚轴长度和相应的种子埋深(从片状胚轴到沉积物表面的距离)。
2.3. 计算方法
测定每个样点的沉积物容重,据其将这29个采样点划分为不同的微生境。
以单位面积内幼苗的数量为幼苗密度;以每类微生境中幼苗的变异系数作为幼苗库的离散系数(Cv),
(1)
其中,m为每类微生境中幼苗的平均数量,sd为每类生境中幼苗数量的标准方差。
幼苗的平均拥挤度指数(
)按下式计算,
(2)
其中,Q是每类微生境下的样方数,N是每个样方中所有幼苗的数量,
为每类微生境下的第i个样方的幼苗数量。若
,幼苗均匀分布;若
,幼苗随机分布;若
,幼苗集群分布。
以出土幼苗发生频率
(%)表征每类微生境下幼苗在不同埋深i时的分布,
(3)
其中,
是某一微生境下的埋深i的幼苗数量,m是埋深的类别数。
2.4. 统计方法
以现场随机测定的51株幼苗的轴状胚轴长度(cm)为因变量、种子埋深为自变量,进行线性回归,获得轴状胚轴长度和种子埋深的数量关系。据SPSS中描述统计模块计算
的95%的置信区间;以
或幼苗库密度为因变量,满足方差齐性时,进行单因素方差分析,确定微生境对
或幼苗库密度作用,以LSD法进行多重比较。如方差齐性不能满足,以Dunnett T3检验进行多重比较。显著差异性水平为0.05。此外,数值均以样本均值 ± 样本的标准误差的形式体现。
3. 结果
3.1. 微生境类型
在随机调查的29个样点中,据沉积物的容重可将杨家湾潮间带鳗草草床划分为6类微生境:沉积物容重分别为1.4、1.5、1.6、1.7、1.8和1.9 g·cm−3的微生境,它们分别有3、2、11、5、7和1个调查样点。
3.2. 幼苗轴状胚轴长度和埋深的关系
现场随机实测的51株幼苗埋深范围为0.90~10.10 cm,轴状胚轴长度为0.50~7.20 cm,种子埋深(D)和轴状胚轴长度(L)的均值分别为4.21和2.92 cm,轴状胚轴长度和种子埋深间的数量系为:
(R2 = 0.90, p < 0.05) (4)
因此,鳗草幼苗轴状胚轴长度可以直接反映种子埋深,下文用此式由轴状胚轴长度计算出相应的种子埋深。
3.3. 幼苗密度
沉积物容重1.9 g·cm−3的微生境仅1处,故其幼苗密度表示为单一样本的取值,在讨论各类微生境间的差异时,不考虑该微生境。沉积物容重1.4、1.5、1.6、1.7、1.8和1.9 g·cm−3的微生境的鳗草幼苗密度分别为94.67 ± 4.81、110.00 ± 34.29、120.73 ± 23.33、206.40 ± 80.23、103.43 ± 12.90和72 株·m−2,各类微生境的幼苗密度无差异(p > 0.05),见图2。
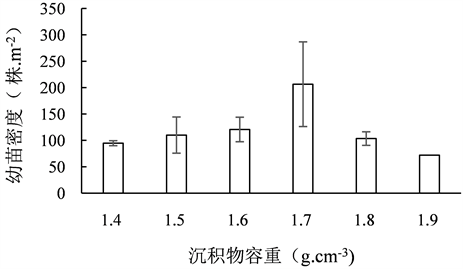
Figure 2. The seedling density of eelgrass in microhabitats with different sediment bulk density
图2. 不同容重微生境中鳗草幼苗密度
3.4. 幼苗库的集群特性
不同容重微生境中鳗草幼苗库特征指数见表1。沉积物容重1.4 g·cm−3的微生境中,鳗草幼苗均匀分布,其离散性也最小;其余微生境(不含沉积物容重1.9 g·cm−3的微生境)中,幼苗呈集群分布模式,其离散程度较大。

Table 1. The characteristics of eelgrass seedling bank in microhabitats with different sediment bulk density
表1. 不同容重微生境中鳗草幼苗库特征指数
注:沉积物容重1.9 g·cm−3的微生境仅1处,故不计算该微生境中幼苗库的特征指数。
3.5. 出土幼苗发生频率
不同沉积物容重微生境中的幼苗发生频率见图3。

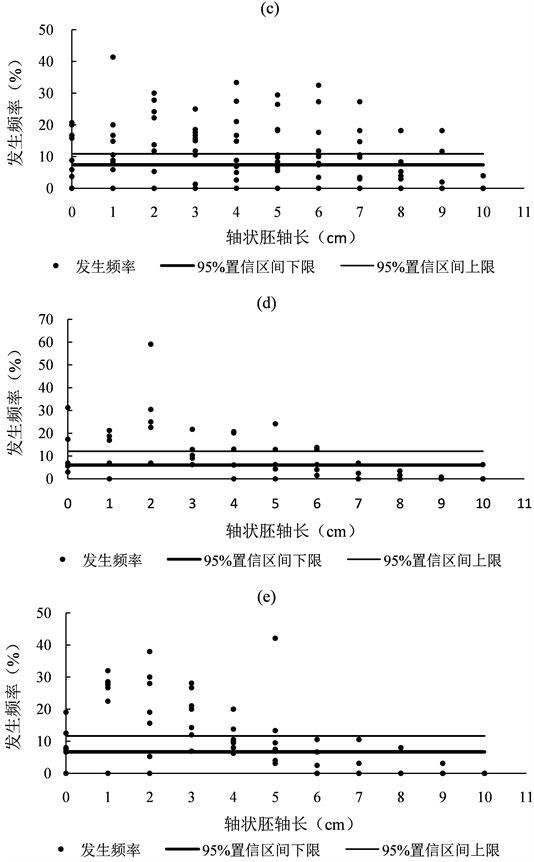
Figure 3. The occurrence frequency of eelgrass seedling in microhabitats with different sediment bulk density (Axial hypocotyls of 0, 1, …, 12 cm representing the range of axial hypocotyls with (0, 1.5), [0.5, 1.5), …, [11.5, 12.5) cm, respectively. Moreover, a, b, c, d and e representing the sediment bulk density 1.4, 1.5, 1.6, 1.7 and 1.8 g·cm−3, respectively)
图3. 幼苗发生频率(轴状胚轴轴长0,1,…,12 cm分别表示轴状胚轴的长度(0, 1.5),[0.5, 1.5),…,[11.5, 12.5) cm;a,b,c,d和e分别表示沉积物容重为1.4,1.5,1.6,1.7和1.8 g·cm−3)
沉积物容重为1.4 g·cm−3的微生境中,轴状胚轴长度(0, 1.5)、[0.5, 1.5)、[1.5, 2.5)、[2.5, 3.5)、[3.5, 4.5)、[4.5, 5.5)、[5.5, 6.5)、[6.5, 7.5)、[7.5, 8.5)、[8.5, 9.5)、[9.5, 10.5) cm的出土幼苗发生频率分别为12.21 ± 6.13、19.08 ± 6.31、18.44 ± 1.84、16.75 ± 1.65、17.65 ± 11.67、8.49 ± 0.42、4.35 ± 4.35、3.03 ± 3.03、0.00 ± 0.00、0.00 ± 0.00和0.00 ± 0.00%。轴状胚轴长度小于4.5 cm时,出土幼苗的发生频率较高,见图3(a)。轴状胚轴长度为[2.5, 3.5) cm的幼苗的发生频率高于[7.5, 8.5)、[8.5, 9.5)、[9.5, 10.5) cm,即种子埋深为[3.56, 4.38) cm时,幼苗发生的频率高于埋深[11.24, 15.13) cm的(p < 0.05),见图3(a)。
在沉积物容重为1.5 g·cm−3的微生境中,轴状胚轴长度(0, 1.5)、[0.5, 1.5)、[1.5, 2.5)、[2.5, 3.5)、[3.5, 4.5)、[4.5, 5.5)、[5.5, 6.5)、[6.5, 7.5)、[7.5, 8.5)、[8.5, 9.5)、[9.5, 10.5) cm的出土幼苗的发生频率分别为2.63 ± 2.63、8.51 ± 3.25、3.95 ± 3.95、16.41 ± 4.64、6.58 ± 6.58、16.10 ± 10.22、16.72 ± 0.93、10.14 ± 7.51、10.14 ± 7.51、5.88 ± 5.88和2.94 ± 2.94%。不同轴状胚轴长度的鳗草幼苗的发生频率间并无差异,见图3(b) 。
在沉积物容重为1.6 g·cm−3的微生境中,轴状胚轴长度(0, 1.5)、[0.5, 1.5)、[1.5, 2.5)、[2.5, 3.5)、[3.5, 4.5)、[4.5, 5.5)、[5.5, 6.5)、[6.5, 7.5)、[7.5, 8.5)、[8.5, 9.5)、[9.5, 10.5) cm的出土幼苗的发生频率分别为9.84 ± 2.51、11.49 ± 3.63、13.33 ± 3.42、12.01 ± 2.51、13.22 ± 3.19、12.12 ± 2.97、11.67 ± 3.15、7.90 ± 2.75、5.17 ± 2.11、2.89 ± 1.86和0.36 ± 0.36%。此外,轴状胚轴长度[2.5, 3.5) cm的幼苗的发生频率高于[9.5, 10.5) cm,即埋深[3.56, 4.38) cm时,幼苗发生频率高于埋深[14.31, 15.13) cm的(p < 0.05),见图3(c)。
在沉积物容重为1.7 g·cm−3的微生境中,轴状胚轴长度(0, 1.5)、[0.5, 1.5)、[1.5, 2.5)、[2.5, 3.5)、[3.5, 4.5)、[4.5, 5.5)、[5.5, 6.5)、[6.5, 7.5)、[7.5, 8.5)、[8.5, 9.5)、[9.5, 10.5) cm的出土幼苗的发生频率分别为12.84 ± 5.21、12.76 ± 4.01、28.80 ± 8.52、12.07 ± 2.64、11.99 ± 4.02、9.53 ± 4.20、7.73 ± 2.44、1.86 ± 1.34、1.01 ± 0.68、0.16 ± 0.16和1.25 ± 1.25%,具有不同轴状胚轴长度的鳗草幼苗的发生频率间并无差异,即在埋深 < 15.13 cm的范围内幼苗的发生频率非常离散,见图3(d)。
在沉积物容重为1.8 g·cm−3的微生境中,轴状胚轴长度(0, 1.5)、[0.5, 1.5)、[1.5, 2.5)、[2.5, 3.5)、[3.5, 4.5)、[4.5, 5.5)、[5.5, 6.5)、[6.5, 7.5)、[7.5, 8.5)、[8.5, 9.5)、[9.5, 10.5) cm的出土幼苗的发生频率分别为8.66 ± 2.22、23.64 ± 4.08、19.41 ± 5.16、18.43 ± 2.94、11.16 ± 1.72、12.35 ± 5.12、2.81 ± 1.59、1.95 ± 1.50、1.14 ± 1.14、0.45 ± 0.45和0.00 ± 0.00%。轴状胚轴轴长[0.5, 1.5)和[2.5, 3.5) cm的幼苗的发生频率均高于[5.5, 6.5)、[6.5, 7.5)、[7.5, 8.5)、[8.5, 9.5)、[9.5, 10.5) cm的(p < 0.05),轴状胚轴长度[3.5, 4.5) cm的幼苗的发生频率高于[7.5, 8.5)、[8.5, 9.5)、[9.5, 10.5) cm的(p < 0.05),见图3(e)。
在沉积物容重为1.9 g·cm−3的微生境中,轴状胚轴长度(0, 1.5)、[0.5, 1.5)、[1.5, 2.5)、[2.5, 3.5)、[3.5, 4.5)、[4.5, 5.5)、[5.5, 6.5)、[6.5, 7.5)、[7.5, 8.5)、[8.5, 9.5)、[9.5, 10.5) cm的出土幼苗的发生频率分别为0.00、16.67、22.22、11.11、33.33、11.11、5.56、0.00、0.00、0.00和0.00%。由于该类生境仅有1处样点,因此,不讨论该微生境下的幼苗其它分布特征。
此外,同一埋深条件下,不同容重微生境中出土幼苗的发生频率无显著差异(p > 0.05)。
4. 讨论
杨家湾5类微生境(仅有1个样方的微生境除外)中,80%的样方中幼苗呈集群分布,其余20%中幼苗呈均匀分布,与在潮间带鳗草草床中观测到的现象相吻合,即幼苗成簇生长。集群分布对于幼苗而言,最大的弊端在于可能因密度效应而自疏 [20]。此外,动物摄食是鳗草幼苗死亡的一个原因 [21],而集群分布会增加这种摄食死亡风险。
鳗草种子进入沉积物后,存在两类萌发类型:1) 在形成种子的当年秋季即萌发;2) 经过春化后萌发 [22]。尽管有研究显示鳗草种子的存活期可达15个月 [14],但学者们普遍认为鳗草种子库为暂时种子库 [23],因此,幼苗的出土对于鳗草种群的维系、扩张尤为重要。鳗草的幼苗库是其有性生殖种子库和生境相互作用的最终体现,如果有性生殖种子库不能转化为幼苗库,进入沉积物的种子就丧失了对鳗草种群维系、扩张的意义。本研究中各类以沉积物容重为指征的微生境中的幼苗库密度、出土幼苗的发生频率间并无差异,说明沉积物容重微生境可以提供无差别的幼苗库,但这些幼苗能否存活,还需要进一步探究这些幼苗的存活率及其死亡原因。
式(4)显示鳗草幼苗的轴状胚轴长度与种子埋深线性正相关,即轴状胚轴长度长时其种子埋深则深。在杨家湾潮间带鳗草海草场的5类微生境中(仅有1个样方的微生境除外),容重为1.4、1.6和1.8 g·cm−3的3类微生境中种子埋深较浅的出土幼苗发生频率显著大于埋深较深者,其它2类微生境(1.5和1.7 g·cm−3)中种子埋深对幼苗发生频率无影响。这种不同沉积物容重下的出土幼苗发生频率和埋深关系的复杂性这可能是多因素作用的结果:其一,容重可能会影响种子在不同沉积物深度的数量。因为沉积物的紧实度和垂向混合作用会影响鳗草种子在沉积物中的垂向运动。随容重的增加,沉积物在潮汐、风浪等作用下的垂向混合程度降低,其紧实度则呈上升趋势。因此,随沉积物容重的增加,种子进入沉积物深层的机会也会降低,即深层沉积物中的种子数量比浅层要少,潜在种子库数量的不同会影响幼苗发生频率;其二,容重会影响其不同沉积物深度中的溶解氧(DO)含量。随沉积物容重增加,沉积物中的DO含量因沉积物不易上下混合、孔隙度低等原因而降低,但研究却显示低DO含量有利于鳗草种子萌发 [24];其三,沉积物容重会决定种子萌发时所承受的机械压力。萌发的种子能否出土,还需要它能耐受沉积物的压力、机械损伤及种子是否储备了足够的能量支撑种子能够突破沉积物。随沉积物深度和容重增加,萌发种子所承受的沉积物带来的机械压力、损伤增加,突破沉积物的过程中耗能增加,因此,埋深增加时幼苗出土机率在减小;其四,沉积物容重还会影响其中大型底栖动物群落组成。在潮间带容重较低的沉积物中有机物含量较高,较高的有机物含量可诱导较多的大型底栖动物 [7],大型底栖动物摄食种子、出土幼苗也是造成海草种子、出土幼苗损失的重要因素 [25],故此类生境中底栖动物的干扰可能会导致幼苗发生率下降。以上因素存在于每类微生境中,这些作用对种子能否萌发并最终成功出土的作用有正向的,也有负面的抑制作用,由于本研究未对以上因素进行考察,所以不能确定在不同微生境下哪种作用占据优势。故,还需进一步的控制实验来详细探究沉积物容重和其相关因素对鳗草种子分布、种子萌发及幼苗出土的影响。
幼苗不能存活的原因主要是大型底栖动物的摄食 [26]、埋深过深 [27],光照强度低而导致出土幼苗不能有效光合作用,生境的硫化物含量过高而导致的生理胁迫 [28],以及由于自身密度过高而致的自疏效应等。本调查显示杨家湾潮间带鳗草海草床的幼苗库密度、出土幼苗在沉积物深度上的差异并不显著。因此,在杨家湾潮间带水动力、大型底栖生物群落及沉积环境类似的水域中进行鳗草种子的底播而实现其种群恢复具有一定的潜力。
5. 结论
不同沉积物容重微生境间的鳗草幼苗库密度无差异,这和以鳗草盖度为标准确定的微生境间的鳗草实生苗密度的分布相一致,但幼苗的发生频率、幼苗库的集群特性有自身的特点:在沉积物容重1.4 g·cm−3的微生境中,幼苗均匀分布,出土幼苗发生频率与埋深有关;在沉积物容重1.5、1.7 g·cm−3的微生境中,幼苗集群分布,出土幼苗发生频率和埋深无关;沉积物容重1.6、1.8 g·cm−3的微生境中,幼苗集群分布,出土幼苗发生频率和埋深有关;埋深一致时,出土幼苗发生频率不随沉积物容重变化。
基金项目
国家自然科学基金(31972796)。
NOTES
*通讯作者。