摘要:
目的:本文通过网络药理学和分子对接技术探索半夏厚朴汤、四逆散和越鞠丸“同病异治”抑郁症的作用机制。方法:通过TCMSP和BATMAN-TCM数据库整理半夏厚朴汤、四逆散和越鞠丸的活性成分和靶点信息,联合GSE87610生物芯片和PharmGKB、DrugBank、OMIM、TTD、GeneCards五个疾病数据收集抑郁症靶点。利用Cytoscape3.8.0构建“活性成分–药物靶点”互作网络,筛选重要成分和关键靶点;基于Venny2.1.0获取三种复方和抑郁症的共同靶点,使用String在线分析工具获取蛋白质互作网络图,采用DAVID在线数据库对核心靶点进行GO富集和KEGG信号通路分析。筛选“活性成分–药物靶点”互作网络中Degree排名前五的活性成分和三种中药复方和抑郁症共有靶点PPI排名前五的靶点分别作为配体和受体,用PyMol、Autodock和Vina软件对活性成分和蛋白质进行分子对接。结果:半夏厚朴汤中有效成分192个、潜在靶点1544个,四逆散中有效成分275个、潜在靶点1442个,越鞠丸中有效成分177个、潜在靶点1364个,抑郁症靶点1337个,得到三种中药复方和抑郁症共有靶点347个。KEGG信号通路分析共获得153条,涉及神经活性配体–受体相互作用、癌症的途径cAMP信号通路、钙信号通路、PI3K-Akt信号通路等。筛选得到的活性成分为黄连碱、槲皮素、壬酸、棕榈酸和缬氨酸;关键靶点为AKT1、INS、TP53、IL6和TNF;对接结果显示五种活性成分和五种蛋白均具有较好的结合能力。结论:半夏厚朴汤、四逆散和越鞠丸三种复方存在着相同和不同的抗郁成分和靶点,通过分析靶点和通路,加以分子对接技术辅助验证结合活性,初步阐明三者“同病异治”抑郁症的科学内涵。
Abstract:
Objective: Based on network pharmacology and molecular docking to explore the mechanisms of Banxiahoupo Decoction, Sini Powder and Yueju Pill treating depression with “Same Disease with Different Treatments”. Methods: The active ingredients and target information of Banxiahoupo Decoction, Sini Powder and Yueju Pill were sorted by TCMSP and BATMAN-TCM database, and depression targets were collected by combining GSE87610 chip and PharmGKB, DrugBank, OMIM, TTD and GeneCards. Use Cytoscape3.8.0 to draw the interaction network of “active ingredients-drug targets”, then screen important ingredients and key targets. Venny2.1.0 was used to get the common target of three kinds of compound prescription and depression, PPI was drawn by String online analysis tool, and GO enrichment and KEGG signal pathway analysis were carried out on the key targets by DAVID online database. Screening the top five active ingredients in the “active ingredient-drug target” interaction network and the top five targets in PPI, which are common targets of three traditional Chinese medicine compounds and depression, as ligands and receptors respectively. Use PyMol, Autodock and Vina software for molecular docking of active ingredients and protein. Results: There were 192 active ingredients and 1544 potential targets in Banxiahoupo Decoction, 275 active ingredients and 1442 potential targets in Sini Powder, 177 active ingredients and 1364 potential targets in Yueju Pill, and 1337 targets in depression. There were 347 targets shared by three traditional Chinese medicine compounds and depression. A total of 153 KEGG signal paths were obtained, which involved neuroactive ligand-receptor interaction, cAMP signaling pathway, calcium signaling pathway, PI3K-Akt signaling pathway and so on. The screened active ingredients are coptisine, quercetin, nonanoic acid, palmitic acid and valine. The key targets are AKT1, INS, TP53, IL6 and TNF. The docking results showed that the five active ingredients and five proteins had good binding ability. Conclusion: Banxiahoupo Decoction, Sini Powder and Yueju Pill have the same and different anti-depression components and targets. By analyzing the targets and pathways and verifying the binding activity with the aid of molecular docking technology, the scientific connotation of treating depression with “Same Disease with Different Treatments” among the three compounds is preliminarily clarified.
1. 引言
随着生活节奏的加快与社会压力的增加,抑郁症已成为世界上最令人担忧的疾病之一,预计到2030年将成为全球最严重的疾病负担 [1]。抑郁症以心境低落为主要特征 [2],包括显著而持久的思维迟钝、认知功能损害、意志活动减退以及不同程度的失眠或嗜睡、食欲减退、乏力等躯体症状,轻者闷闷不乐、兴趣减退,重者可出现自杀现象,对人们的生活和工作影响极大。它的高发病率、高复发和高死亡率的特点已造成数百万人死亡,并对世界各地的社会产生影响 [3]。尽管研究人员几十年来一直在试图解决这个问题,但仍然没有合适的解决方案。抑郁症在现代中医的研究中归属于“郁证”范畴 [4],中医学具有独特的理论体系和源远流长的实践经验,可以通过单味中药或者中药复方的组合 [5] 来发挥其多层次,多靶点的功能优势,在抑郁症治疗上的作用机制亟待发掘。
“同病异治”是指相同的疾病因为人、时间、地点的不同,或是疾病的发展状况、疾病的类型差异、疾病机理的变化和治疗时因情况不同而采用不同的治疗手段 [6],其起效原因可能是基于相似的物质基础和靶点 [7]。目前“同病异治”的相关文献较少,同时缺乏分子对接技术验证活性成分和蛋白质的结合性能,数据准确度还不够。本次研究借助网络药理学和分子对接技术,构建“活性成分–药物靶点”网络和蛋白质互作网络,筛选活性成分和关键靶点,进行分子对接,阐明三种中药复方和抑郁症的相关性,揭示“同病异治”的科学内涵。
2. 材料与方法
2.1. 获取半夏厚朴汤、四逆散和越鞠丸的活性成分和靶点
半夏厚朴汤中包括半夏、厚朴、茯苓、生姜和苏叶五种药材;四逆散中包括甘草、枳实、柴胡和白芍四种药材;越鞠丸包括苍术、香附、川芎、神曲和栀子五种药材,其中六神曲为多味药材组成,且含有多种真菌,故本次研究不考虑 [8]。通过中药系统药理学数据库与分析平台TCMSP (https://tcmsp-e.com/)和BATMAN-TCM (http://bionet.ncpsb.org.cn/batman-tcm/)分别检索三种复方中各中药的有效活性成分和相关作用靶点,前者设置筛选条件为口服利用度(OB) ≥ 30%、化合物类药性(DL) ≥ 0.18;后者为评分(Score Cutoff) ≥ 20、矫正P值(Adjusted P-Value) ≤ 0.05,将所得的蛋白质靶点信息通过Uniprot数据库(https://www.uniprot.org/)转化为基因靶点。
2.2. 获取抑郁症的靶点
进入美国国立生物中心基因表达综合数据库GEO-NCBI (https://www.ncbi.nlm.nih.gov/),下载芯片GSE87610相关数据。该数据集包含31个样本,有15个对照样本和16个疾病样本,分组进行GEO2R分析后下载全部基因资料,除去没有匹配到基因的探针,筛选条件设置为P.Value < 0.05,log2FC > 1或log2FC < −1,得到抑郁症组与正常组的差异基因,并使用R Studio对数据集基因绘制火山图,对差异基因绘制热图,进行可视化分析。
利用PharmGKB (https://www.pharmgkb.org/)、DrugBank (https://go.drugbank.com/)、OMIM (http://omim.org/)、TTD (http://db.idrblab.net/ttd/)和GeneCards (https://www.genecards.org/)五个数据库收集抑郁症的靶点。合并5个数据库靶点,删去重复靶点并在Uniprot蛋白数据库进行蛋白名称标准化,得到抑郁症靶点。
2.3. 构建“活性成分–药物靶点”互作网络
利用Venny2.1.0 (https://bioinfogp.cnb.csic.es/tools/venny/index.html)对三种复方的活性成分取交集,得到共有活性成分和三种中药复方的特有活性成分。分类处理活性成分和靶点的对应关系,导入Cytoscape3.8.0构建“活性成分–药物靶点”互作网络,进行可视化分析。
2.4. 构建蛋白质互作网络
利用Venny2.1.0对三种复方和抑郁症的靶点取交集,得到三种复方和抑郁症的共有靶点和每种复方和抑郁症的特有靶点。分别将靶点导入String数据库(https://www.string-db.org/),下载数据,利用Cytoscape3.8.0绘制蛋白质互作网络图(PPI),同时用插件MCODE对4个PPI进行模块分析,并筛选出模块一的靶点,导入DAVID在线数据库(https://david.ncifcrf.gov/),进行信号通路分析。
2.5. 分析GO富集和KEGG通路
将共同靶点导入DAVID在线数据库,选择物种为“Homo sapiens”,下载生物过程(BP: Biological Process)、细胞组成(CC: Cellular Component)、分子功能(MF: Molecular Function)和KEGG数据,GO富集分析的数据绘制为簇状柱形图,KEGG数据用R语言的ggplot2包绘制气泡图,同时用Cytoscape3.8.0表达出重要信号通路和其涉及基因的关系。
2.6. 分子对接
选取“活性成分–药物靶点”互作网络中度值(Degree)排名前五的活性成分作为配体,在PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)中检索成分并下载3D格式,利用OpenBabel2.4.1转换为mol2格式;筛选三种中药复方和抑郁症共同靶点的PPI中degree排名前五的靶点作为受体,并在PDB数据库(http://www.rcsb.org/)中选择合适的受体下载PDB文件。使用AutoDock4.2进行结合,分析活性成分和关键靶点的结合性能,选取结合能 < −5 (kcal/mol)的对接模型,用PyMol软件可视化对接结果。
3. 结果
3.1. 半夏厚朴汤、四逆散和越鞠丸活性成分及作用靶点筛选结果
TCMSP和BATMAN-TCM数据库得到半夏厚朴汤中活性成分192个,作用靶点1544个;四逆散中活性成分275个,作用靶点1442个;越鞠丸中活性成分177个,作用靶点1364个。利用Venny2.1.0作图后得到三者共有活性成分6个,半夏厚朴汤、四逆散和越鞠丸各有的特有活性成分分别为146个、241个和131个(见图1)。
3.2. 抑郁症靶点筛选结果
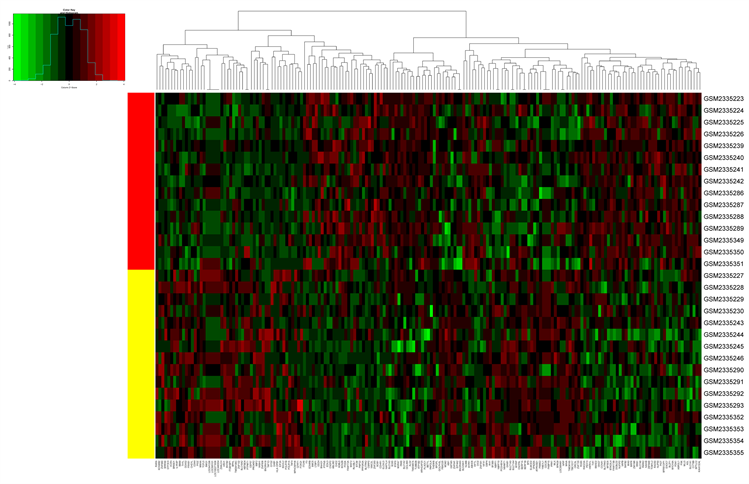
GSE87610生物芯片筛选差异基因185个,联合五个疾病数据库,共获取抑郁症靶点1337个。对GSE87610中185个差异基因绘制热图(见图2(a))和火山图(见图2(b)),红色代表该基因在表达中上调,绿色代表该基因在表达中下调,黑色代表该基因没有明显差异,不具有统计学意义,结果统计,该芯片中上调基因有90个,包括下调基因95个。
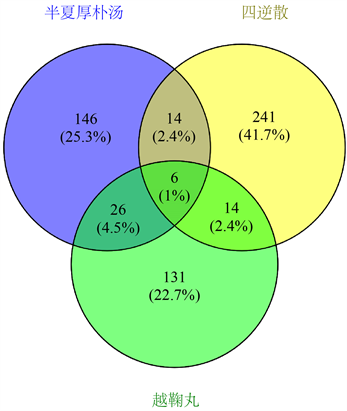
Figure 1. Venn diagram of active components of Banxiahopu Decoction, Sini Powder and Yueju Pill
图1. 半夏厚朴汤、四逆散和越鞠丸活性成分韦恩图
 (a)
(a)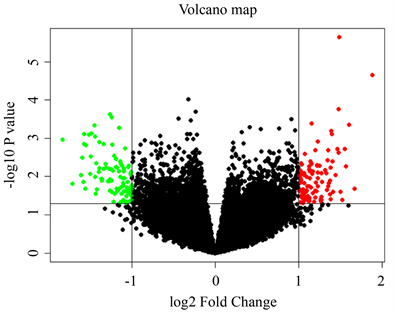 (b)
(b)
Figure 2. Heat and volcano maps of GSE87610 differential genes
图2. GSE87610差异基因的热图和火山图
3.3. 分析“活性成分–药物靶点”互作网络
利用Cytoscape3.8.0绘制“活性成分–药物靶点”互作网络(见图3),共有2570个节点,28639条边,进行Degree分析,筛选出互作网络中排名前十的活性成分(见表1):黄连碱(Coprine)、槲皮素(quercetin)、壬酸(Nonanoic Acid)、棕榈酸(Hexadecanoic Acid)、缬氨酸(Valine)、β-蒎烯(Beta-Pinene)、d-柠檬烯(D-Limonene)、月桂烯(Myrcene)、β-石竹烯(Beta-Humulen)和壬醇(N-Nonanol);排名前五的关键靶点(见表2):ESR1、AR、SCN5A、PTGS2和PGR。其中黄连碱和缬氨酸是半夏厚朴汤特有的活性成分,月桂烯和β-石竹烯是三种中药复方共有的活性成分,其他则是两种中药复方两两共有的活性成分,同时度值排名前五的靶点均存在于前期整理的抑郁症靶点中,说明三种中药复方可能通过该网路中的关键靶点发挥治疗抑郁症的作用,并且三种中药复方中存在的相同的活性成分可能是其“同病异治”抑郁症的物质基础。

Table 1. Top 10 in degree values of active ingredients
表1. 活性成分度值Top 10
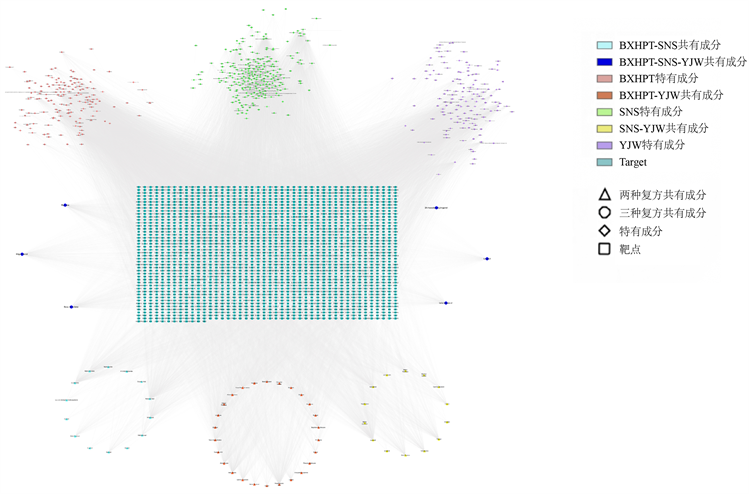
Figure 3. Active components-drug targets interaction network
图3. “活性成分–药物靶点”互作网络

Table 2. Top 5 in degree values of targets
表2. 靶点度值Top 5
3.4. 分析蛋白质互作网络
利用Venny2.1.0对三种中药复方的药物靶点和抑郁症靶点取交集,得到三种中药复方和抑郁症的共同靶点以及各自和抑郁症的特有靶点(见图4),将靶点信息分别导入String数据库,下载TSV格式数据,用Cytoscape3.8.0软件进行可视化修饰,获得三种中药复方和抑郁症共同靶点PPI (见图5(a))、半夏厚朴汤和抑郁症特有靶点PPI (见图5(b))、四逆散和抑郁症特有靶点PPI (见图5(c))、越鞠丸和抑郁症特有靶点PPI (见图5(d))。对三种中药复方和抑郁症共同靶点PPI进行Degree分析,其排名前五分别是AKT1、INS、TP53、IL6、TNF,推测该五个潜在蛋白可能是三种中药复方“同病异治”抑郁症的关键靶点。
用插件MCODE对四个蛋白质互作网络进行模块分析,其中红色的靶点代表模块一,绿色的靶点代表模块二,紫色的靶点代表模块三,蓝色的靶点代表模块四,黄色的靶点代表模块五。同时选取每个PPI
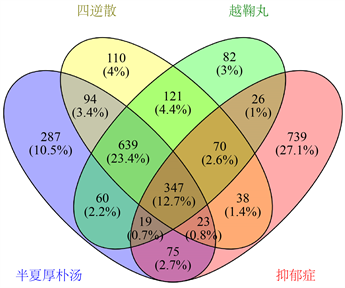
Figure 4. Common targets of Banxiahopu Decoction, Sini Powder, Yueju Pill, depression and their specific targets with depression
图4. 半夏厚朴汤、四逆散、越鞠丸和抑郁症的共同靶点以及各自和抑郁症的特有靶点
 (a) (b)
(a) (b) 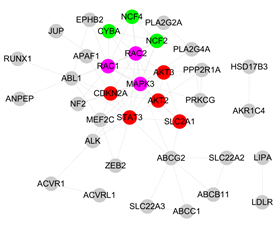 (c)
(c)  (d)
(d)
Figure 5. Protein interaction network (PPI) of Chinese medicine compound—disease targets protein. (a) Common targets PPI of three Chinese herbal formulations and depression; (b) Specific targets PPI of Banxiahopu Decoction and depression; (c) Specific targets PPI of Sini Powder and depression; (d) Specific targets PPI of Yueju Pill and depression
图5. 中药复方–疾病靶点PPI。(a) 三种中药复方和抑郁症共同靶点PPI;(b) 半夏厚朴汤和抑郁症特有靶点PPI;(c) 四逆散和抑郁症特有靶点PPI;(d) 越鞠丸和抑郁症特有靶点PPI
中模块一的靶点进行KEGG信号通路分析,发现三种中药复方和越鞠丸之间存在着相同的信号通路:PI3K-Akt信号通路(PI3K-Akt Signaling Pathway),但半夏厚朴汤和四逆散却没有这一信号通路,通过在GenomeNet在线平台(https://www.genome.jp/)搜索PI3K-Akt信号通路的路径图(见图6),发现与PI3K-Akt信号通路相关联的信号通路有ErbB信号通路(ErbB Signaling Pathway)、趋化因子信号通路(Chemokine Signaling Pathway)、核因子-κB信号通路(NF-kappa B Signaling Pathway)、FoxO信号通路(FoxO Signaling Pathway)、mTOR信号通路(mTOR Signaling Pathway)、细胞凋亡(Apoptosis)、血管内皮生长因子信号通路(VEGF Signaling Pathway)、Toll样受体信号通路(Toll-like Receptor Signaling Pathway)、JAK-STAT信号通路(JAK-STAT Signaling Pathway)、B细胞受体信号通路(B Cell Receptor Signaling Pathway)、胰岛素信号通路(Insulin Signaling Pathway)等,推测四逆散和半夏厚朴汤与抑郁症各自的特有靶点通过参与其相关通路,间接调控PI3K-Akt信号通路,从而治疗抑郁症。图中的红色基因表示为三种中药复方和越鞠丸的PPI中模块一的靶点,黄色基因代表四逆散的PPI中模块一的靶点,半夏厚朴汤主要通过CD40、MYD88、STAT5B和CXCR4参与核因子-κB信号通路、Toll样受体信号通路和趋化因子信号通路间接影响PI3K-Akt信号通路,此次在图中没有具体标注。
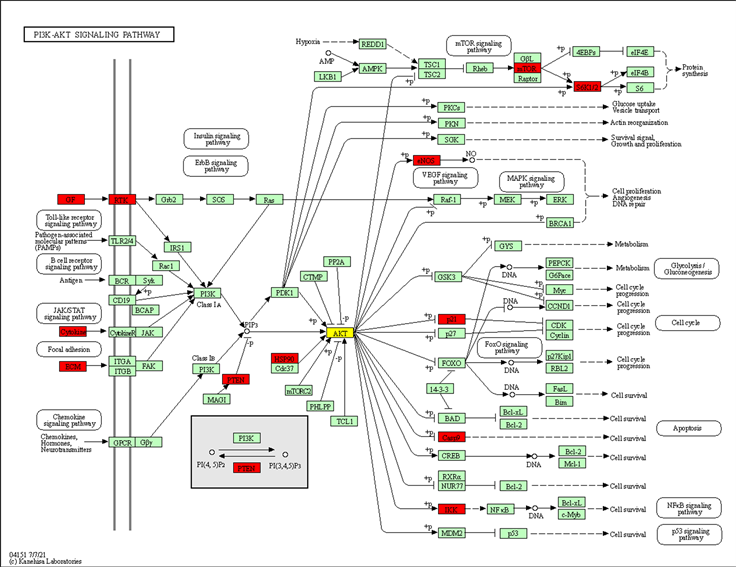
Figure 6. PI3K-Akt signaling pathway
图6. PI3K-Akt信号通路路径图
3.5. GO分析富集和KEGG信号通路
将半夏厚朴汤、四逆散、越鞠丸和抑郁症的共同靶点347个,导入DAVID在线分析平台,得到生物过程、细胞组成、分子功能和KEGG的数据。条件设置为P.value < 0.05进行筛选,按照Count值的大小排序,选取TOP5的数据。GO富集分析的结果用簇状柱形图(见图7(a))表示,KEGG分析的结果用气泡图(见图7(b))表示,同时对排名前五的信号通路进行基因分析(见图7(c))。生物过程中主要和信号转导、细胞增殖、凋亡等有关;细胞组成主要是细胞膜、细胞质等成分;分子功能主要涉及蛋白质的结合、ATP的结合以及某些金属离子的结合。选取排名前五的信号通路对其相关的基因进行分析时,发现信号通路两两之间存在着大面积的交集,如PI3K-Akt信号通路和癌症的通路的基因几乎完全重叠的,而在上述的PPI分析中,我们同样发现了三种中药复方共有和特有的靶点都可以影响PI3K-Akt信号通路的表达。所以基因的相交也说明中药复方可以不仅可以通过相同的靶点影响同一信号通路,也可以通过不同的靶点间接影响某一信号通路,从而达到治疗疾病的目的。
 (a)
(a)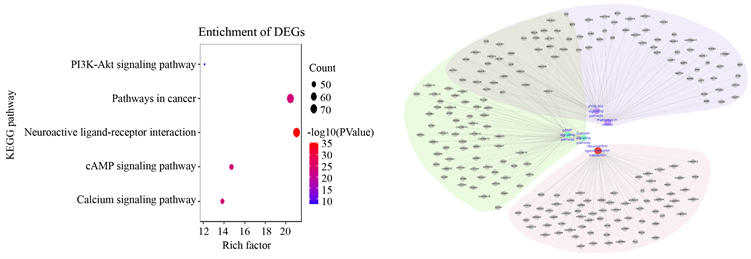 (b) (c)
(b) (c)
Figure 7. GO enrichment and KEGG pathway analysis. (a) Bar chart of GO enrichment analysis; (b) Bubble chart of KEGG analysis; (c) Gene analysis of the top five signaling pathways
图7. GO富集和KEGG通路分析。(a) GO富集分析柱形图;(b) KEGG分析气泡图;(c) 排名前五信号通路的基因分析
3.6. 活性成分和关键靶点对接结果
选取“活性成分–药物靶点”互作网络中Degree排名前五的活性成分包括黄连碱、槲皮素、壬酸、棕榈酸和缬氨酸,作为分子对接的配体,同时选取PPI网络中Degree排名前五的靶点包括AKT1、INS、TP53、IL6、TNF,作为分子对接的受体,用AutoDock4.2进行分子对接,其结合性能如下(见表3),结合能越小,表明成分和蛋白结合越稳定,最后选取结合能 < −5 (kcal/mol)的对接模型,用PyMol软件进行绘图。其中AKT1和槲皮素(见图8(a))的结合能为−9.1 kcal/mol,在本次对接结果中最小,结合最为稳定;TP53和槲皮素(见图8(b))的结合能为−7.9 kcal/mol,氢键有4种连接方式;IL6和槲皮素(见图8(c))的结合能为−5.8 kcal/mol,氢键有2种连接方式;INS和槲皮素(见图8(d))的结合能为−5.4 kcal/mol氢键有5种连接方式;AKT1和黄连碱(见图8(e))的结合能为−5.4 kcal/mol,氢键有4种连接方式;TP53和黄连碱(见图8(f))的结合能为−5.2 kcal/mol,氢键有6种连接方式。
4. 讨论
我国中药资源丰富,历史悠久,亟待传承与创新发展。中药复方治疗疾病的优势主要体现在其疗效确切、不良反应少和“治未病”上 [9]。然而,中药治疗疾病的理论研究却相较于西药作用疾病原理研究少很多。近年来随着新冠疫情的爆发,中药凭借着良好的疗效崭露头角。中药治疗疾病已经掀起了当代的研究热潮,研究中药治疗疾病的作用机制意义重大,是夯实临床疾病研究的基础,也是新药设计开发的理论铺垫。
抑郁症发病率越来越高,探索和设计理想的抗抑郁药迫在眉睫。半夏厚朴汤作为理气剂,有行气散结解郁之功效 [10],Jia Keke等人发现半夏厚朴汤可抑制慢性温和不可预知应激(CUMS)大鼠肝脏、下丘脑、海马和前额叶皮层NLRP3炎性小体的激活并减少促炎细胞因子IL-1β的生成 [11]。四逆散舒畅气机,调和肝脾 [12],WEI Shanshan等人发现四逆散提取物可能通过在HPA轴上的抗应激作用来达到抗抑郁的效果 [13];越鞠丸行气活血、祛湿健脾 [14],N-甲基-D-天冬氨酸(NMDA)受体和左旋精氨酸/一氧化氮/cAMP途径均参与了越鞠丸的抗抑郁作用机制 [15]。三者皆可治疗郁症,舒肝解郁,行气健脾,调理情志。这三种中药方剂虽药方组分不同,但都可治疗抑郁症,且其“同病异治”的科学内涵尚未有人研究。
通过网络药理学构建出“活性成分–药物靶点”互作网络,得到Degree排名前五的活性成分,分别为黄连碱、槲皮素、壬酸、棕榈酸和缬氨酸,推测可能是治疗抑郁症的关键成分。同时将靶点信息取交集,得到三种中药复方和抑郁症共有靶点347个,绘制PPI,筛选Degree排名前五的靶点为AKT1、INS、TP53、IL6和TNF。将共同靶点进行GO富集分析和KEGG信号通路分析,涉及的通路主要是神经活性配体–受体相互作用、癌症的途径、cAMP信号通路、钙信号通路和PI3K-Akt信号通路。为验证网络药理学结果的准确性,将关键成分和关键靶点进行分子对接,所有的结合结果均小于0,并选取结合能小于−5 kcal/mol进行可视化,发现成分和蛋白主要通过氢键紧密结合。
上述信号通路目前已有研究。Gao Yao等人通过对抑郁症大鼠海马模型的代谢产物分析证实抑郁症的作用机制和神经活性配体–受体相互作用相关 [16]。cAMP是细胞内重要的第二信使,通过调控细胞内激素和神经递质,参与人体神经干细胞的发生、学习和记忆的生理过程 [17] [18]。PI3K/Akt信号通路作为BDNF/TrkB下游的信号通路之一,是目前研究较为成熟的中枢神经保护的主要信号通路 [19]。大量研究表明PI3K/Akt与抑郁症有关,激活脑区该通路可以通过提高多种神经保护因子的表达,减少海马神经元凋亡 [20],改善突触可塑性,从而发挥抗抑郁作用 [21],因此被认为是治疗抑郁症的重要级联信号通路。有研究发现,CUMS模型组中,PI3K/Akt/蛋白表达水平显著增加,促进了下游的凋亡信号通路活化,神经元过度凋亡致使神经损伤 [22]。
本次研究的分子对接结果显示,黄连碱和槲皮素两种活性成分与抑郁症靶点具有较好的结合性能,这提示我们两者都有治疗抑郁症的潜力。《本草纲目》有言:黄连性寒味苦,气味俱浓,乃阴中阳也。黄连具有清热泻火的功效 [23]。已有很多研究表明,黄连的主要成分小檗碱具有抗抑郁作用,可能与大脑中枢单胺类神经递质及其代谢产物、5-羟色胺(5-HT)受体有关 [24] [25]。但目前关于黄连碱治疗抑郁症的研究甚少,其作用机制尚不清楚。
此次分子对接结果中,槲皮素和抑郁症靶点AKT1的结合性能最稳定。它是一种富含多种天然植物的黄酮类化合物,具有广泛的药理作用和营养价值,有抗炎、保护心血管、治疗退化性疾病等作用 [26] [27] [28] [29]。已有研究证实,槲皮素能够有效治疗神经系统疾病、癌症、骨科疾病以及心、肝、肾等脏器疾病。先前的研究报道槲皮素通过保护神经元免于氧化和炎症而减轻慢性应激大鼠的焦虑和抑郁 [30]。有很多研究已经表明槲皮素在一些模型中具有抗抑郁作用,其机制包括海马Nrf2上调和iNOS抑制,从而纠正中枢炎症反应,氧化与抗氧化失衡 [31]。另有研究提示槲皮素可以抑制神经元凋亡,从而防止类似焦虑的行为,可能是通过在活生物体内调节Akt1和ASK1/JNK3/caspase-3的表达 [32]。
我们创新性地探索了三种中药复方“同病异治”抑郁症的作用机制:中药复方中含有的特有或共有活性成分参与调控神经活性配体–受体相互作用、癌症的途径、cAMP信号通路、钙信号通路、PI3K-Akt信号通路等信号通路,作用于AKT1、INS、TP53、IL6、TNF等关键疾病靶点,初步阐明了其“同病异治”的科学内涵,以期推动抑郁症理论研究的进展。
基金项目
成都中医药大学杏林学者学科人才科研提升计划(ZRQN2020001);四川省中医药管理局2021年度中医药科研专项课题(2021MS108)。
NOTES
*共同第一作者。
#通讯作者。