1. 引言
紫苏(Perilla frutescens L. Britt.)又称香苏、白苏、苏叶等,是一年生草本唇形科植物 [1] [2] [3]。紫苏叶在日常鲜食、饮料、面制品、肉类制品中都有所使用 [4] [5] [6];其汁液为深紫色,是天然的染色剂 [7] [8]。近年来,人们从紫苏叶中提取出了具有抗氧化性、抗衰老性、抗菌性性等多种生物活性的物质 [9] [10] [11] [12],其中紫苏叶挥发油含量为0.3%~0.6%,其组成成分丰富,主要为萜类化合物、芳香族化合物、醇类化合物和含氮硫化合物等多种物质 [13]。紫苏叶挥发油具有特别的香气,是一种淡黄色的油状液体。其特别气味会影响人的大脑边缘系统,达到除烦安神的效果,稳定情绪,助于睡眠,从而可以静心养性;还具有抗炎的作用,少量稀释的紫苏挥发油涂抹于身体肿胀部位,可以消炎、活血;又是天然的抗氧化剂、抗过敏剂、抑菌剂,能显著的抑制蛋白质的氧化变性,对大肠杆菌、葡萄球菌、假结核棒状杆菌、化脓链球菌有明显的抗菌作用 [14] [15] [16]。
近年来,对紫苏的研究主要集中在紫苏叶中分离出来的多种生物活性物质。紫苏叶中芳香挥发油含量最多,紫苏挥发油的提取方法有水蒸气蒸馏法 [17] [18] [19] [20]、超临界CO2提取法 [21] [22]、固相萃取法 [23] [24]、酶辅助蒸馏法 [25] 等。紫苏挥发油主要存在于叶的腺毛中,纤维素酶可以分解纤维组织有利于挥发油的溶出。本实验对纤维素酶辅助水蒸气蒸馏提取紫苏挥发油的工艺进行研究与优化,分别从加酶量、酶解时间及温度、料液比、蒸馏时间等五个因素考察其对紫苏挥发油提取率的影响,以期优化出紫苏挥发油的最佳提取工艺。
2. 材料与方法
2.1. 材料与试剂
单面红紫苏叶:广西南宁鲜蔬有限公司(四月份采摘);石油醚(30℃~60℃)和无水硫酸镁:上海国药集团;纤维素酶:上海麦克林生化科技有限公司。
2.2. 仪器与设备
FA114电子分析天平:上海海康电子仪器厂;DF-101S集热式恒温加热磁力搅拌器:上海科学仪器有限公司;RE-52AA旋转蒸发仪:上海亚荣生化仪器厂。
2.3. 实验方法
2.3.1. 原材料预处理
将新鲜紫苏叶清洗干净,至于阴凉处避光阴干;干燥的紫苏叶用粉碎机粉碎,过60目筛,装入保鲜袋,备用。
2.3.2. 紫苏叶挥发油的提取
称量5.0 g (精确到0.0001 g)紫苏叶粉末样品于具塞锥形瓶中,按照一定的料液比(14:1、16:1、18:1、20:1、22:1mL/g)和加酶量(0%、0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%)加入超纯水和纤维素酶。安装好仪器后,在一定温度(25℃、30℃、35℃、40℃、45℃)下酶解一段时间(2 h、2.5 h、3 h、3.5 h、4 h)。随后转移到蒸馏提取器中进行水蒸气蒸馏,待蒸馏一定时间1.5 h、2 h、2.5 h、3 h、3.5 h)后停止加热,并冷却至室温。用石油醚(30℃~60℃)萃取馏出液(15 mL × 3),萃取所得石油醚相用无水硫酸镁充分干燥,过滤除去硫酸镁,滤液浓缩(水浴温度30℃,旋转蒸发仪)至瓶内液体不再变化,称量并计算提取率。
提取率的计算公式:
(式1)
3. 结果与分析
3.1. 加酶量对紫苏挥发油提取率的影响
当料液比为18:1 mL/g,分别按照加酶量为0%、0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%加入纤维素酶,在30℃下酶解3 h,水蒸气蒸馏2.5 h。考察加酶量对紫苏挥发油提取率的影响。
从图1可知,在上述固定条件下,当加酶量在0%~0.5%时,紫苏挥发油提取率随着加酶量的增大逐渐升高;当加酶量超过0.5%时,紫苏挥发油提取率随着加酶量的增加逐渐下降。可能是酶浓度过高,使纤维素酶活性降低,挥发油的溶出降低。因此,纤维素酶辅助水蒸气蒸馏法提取紫苏挥发油的最佳加酶量为0.5%。
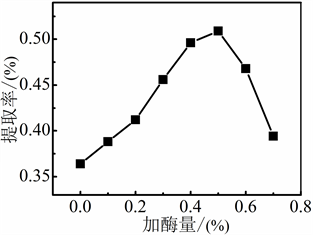
Figure 1. Effect of cellulase dosage on the extraction rate of Perilla volatile oil
图1. 加酶量对紫苏挥发油提取率的影响
3.2. 酶解时间对紫苏挥发油提取率的影响
当料液比为18:1 mL/g,加酶量为0.5%,在30℃下分别酶解1h、2 h、2.5 h、3 h、3.5 h、4 h,水蒸气蒸馏2.5 h时,考察纤维素酶酶解时间对紫苏挥发油提取率的影响。
从图2可知,在上述固定条件下,纤维素酶酶解3 h时,紫苏叶挥发油的提取率最高,此时挥发油达到最大程度的溶出。酶解时间过短,纤维素酶还没来的及破坏紫苏叶的细胞壁促进挥发油溶出。当酶解的时间过长时,可能的原因是溶出的杂质过多,致使紫苏挥发油的提取率逐渐下降。因此,纤维素酶辅助水蒸气蒸馏法提取紫苏挥发油的最佳酶解时间为3 h。
3.3. 酶解温度对紫苏挥发油提取率的影响
当料液比18:1 mL/g,加酶量0.5%,分别在25℃、30℃、35℃、40℃、45℃下分别酶解3 h,水蒸气蒸馏2.5 h时,考察酶解温度对紫苏挥发油提取率的影响。
从图3中可知,在上述固定条件下,酶解温度为20℃~45℃时,紫苏挥发油的提取率的变化呈抛物线趋势;在纤维素酶酶解温度为30℃时,紫苏挥发油的提取率最高。因为纤维素酶的生物活性受温度影响较大,酶解温度升高增强纤维素酶的生物活性,促进紫苏挥发油的溶出。因此,在酶解温度小于30℃,紫苏挥发油提取率随温度升高而增大。当酶解温度过高时,纤维素酶的活性会降低,甚至失活,导致纤维素酶的分解细胞壁的能力下降,不利于挥发油的溶出,致使紫苏挥发油提取率降低。因此,酶辅助水蒸气蒸馏法最佳的酶解温度为30℃。
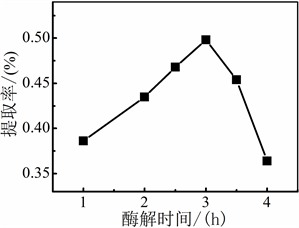
Figure 2. Effect of enzyme hydrolysis time on extraction rate of Perilla volatile oil
图2. 酶解时间对紫苏挥发油提取率的影响
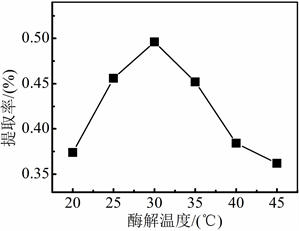
Figure 3. Effect of enzymatic temperature on extraction rate of Perilla volatile oil
图3. 酶解温度对紫苏挥发油提取率的影响
3.4. 料液比对紫苏挥发油提取率的影响
当加酶量0.5%,酶解温度30℃,酶解时间3 h,料液比分别为14:1、16:1、18:1、20:1、22:1 mL/g,水蒸气蒸馏2.5 h时,考察料液比对紫苏叶中挥发油提取率的影响。
从图4可知,在上述固定条件下,料液比为20:1 mL/g时紫苏挥发油的提取率最高。在料液比为14:1~20:1 mL/g时,紫苏叶粉末与水接触的越来越充分,紫苏挥发油的提取率逐渐升高;在22:1和24:1 mL/g时,紫苏挥发油提取率逐渐降低。随着料液比增大,紫苏叶粉末在水中浓度变低,溶出的紫苏挥发油在超纯水中分散,在相同的蒸馏时间,蒸馏出的馏分量是相同的,从而提取率就会快速下降。因此,纤维素酶辅助水蒸气蒸馏法提取紫苏挥发油的最佳料液比为20:1 mL/g。
3.5. 蒸馏时间对紫苏挥发油提取率的影响
当加酶量为0.5%,料液比为20:1 mL/g,酶解温度为30℃,酶解3 h,分别蒸馏1.5 h、2 h、2.5 h、3 h、3.5 h时,考察蒸馏时间对紫苏挥发油提取率的影响。
由图5可知,在上述固定条件下,蒸馏时间为2.5 h时,紫苏挥发油的提取率最高。蒸馏时间在1.5~2.5 h时,刚开始因蒸馏的时间不足,还有部分分散在超纯水中的挥发油未随着水蒸气一起蒸出,当蒸馏时间增加后,分散在水中的挥发油充分蒸出。当蒸馏时间超过2.5 h提取率又呈现下降的趋势,蒸馏时间过长会有低沸点的挥发油挥发,同时挥发油中热敏性的有效成分的会进行大量的分解。因此,选择最佳水蒸气蒸馏时间为2.5 h。
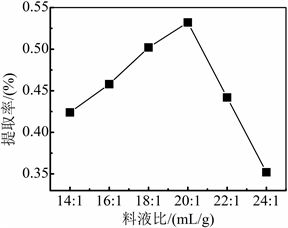
Figure 4. Effect of material and liquid ratio on extraction rate of Perilla volatile oil
图4. 料液比对紫苏挥发油提取率的影响
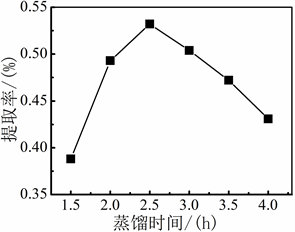
Figure 5. Effect of distillation time on the extraction rate of Perilla volatile oil
图5. 蒸馏时间对紫苏挥发油提取率的影响
4. 结论
本文对纤维素酶辅助水蒸气蒸馏法提取紫苏挥发油的提取工艺进行研究。通过单因素实验,分别考察了加酶量、酶解时间、酶解温度、料液比、蒸馏时间等五个因素对紫苏挥发油提取的影响。通过实验探究得出最佳提取工艺:加酶量0.5%、酶解时间3 h、酶解温度30℃、出料液比20:1 mL/g、蒸馏时间2.5 h,此时紫苏挥发油的提取率最高为0.53%。
基金项目
河南省高等学校重点科研项目(22B150024)、郑州师范学院大学生创新创业训练计划项目(DCY2020022)、河南省大学生创新创业训练计划项目(S202112949012)资助。
NOTES
*通讯作者。