摘要:
为研究黄花菜多酚的提取特性及最佳条件,实验通过单因素和响应面试验设计,以多酚得率为试验指标,探讨了超声时间(10 min、20 min、30 min)、乙醇浓度(40%、60%、80%、100%)、料液比(1:5、1:10、1:15)及超声温度(30℃、40℃、50℃)等因素对黄花菜多酚得率的影响。结果表明,料液比、超声温度、乙醇浓度对多酚得率的影响达显著水平,影响顺序为料液比 > 超声温度 > 乙醇浓度 > 超声时间;料液比与温度、时间和乙醇浓度之间的交互作用对多酚得率均有影响;黄花菜多酚的最佳提取条件为乙醇浓度66%,超声时间22 min,超声温度43℃,料液比1:12,多酚得率为2.318%。上述研究结果可为黄花菜多酚提取工艺的研究及实践提供有益的参考。
Abstract:
In order to study the extraction
characteristics and optimal conditions of polyphenols from daylily, the single factor
and response surface test design were carried out and the yield of polyphenols
was taken as the test index to discuss the effects of ultrasonic time (10 min, 20
min, 30 min), ethanol concentration (40%, 60%, 80%, 100%), material-to-liquid
ratio (1:5, 1:10, 1:15) and ultrasonic temperature (30˚C, 40˚C, 50˚C) on the yield of polyphenols from daylily. The
results showed that the material-to-liquid ratio, ultrasonic temperature, and
ethanol concentration had significant effects on the yield of polyphenols. The
order of influence was: material-to-liquid ratio > ultrasound temperature >
ethanol concentration > ultrasound time; the interactions between
material-to-liquid ratio and temperature, time, ethanol concentration had an
impact on the yield of polyphenols; the optimal extraction conditions for
polyphenols from daylily were 66% ethanol, 22 min of ultrasound, 43˚C of ultrasound temperature, and the ratio of
material to liquid was 1:12, and the yield of polyphenols was 2.318%. The above
research results can provide a useful reference for the research and practice
of the extraction technology of daylily polyphenols.
1. 引言
黄花菜(Hemerocallis Fulvs)又名金针菜、金针花,为百合科萱草属多年生草本植物,其食用部分为花蕾,是中国的特色蔬菜 [1]。黄花菜产业已成为湖南祁东、山西大同、宁夏盐池、陕西大荔、甘肃庆阳等地的农业支柱产业。多酚是植物生长过程中普遍存在的一种重要的次生代谢产物,具有抗氧化活性、清除体内多余自由基、保护人体健康的作用 [2]。近年来,植物多酚已成为食品产业的研究热点之一。多酚的提取是多酚纯化、结构鉴定、功能及加工特性等方面研究的基础,有关黄花菜多酚提取的研究报道较少,而关于纯化、结构鉴定、功能及加工特性等方面研究报道更少,不利于黄花菜基础理论研究和产业的进一步发展。
多酚等天然植物功能成分大多存在于细胞质中,而细胞壁是植物细胞中多酚提取的主要障碍;同时,多酚化合物在植物体内通常与蛋白质、多糖等以氢键和疏水键形成稳定的复合物 [3] [4],导致多酚的提取率低。超声波提取技术是利用超声波具有的机械效应、空化效应及热效应,加强了胞内物质的释放、扩散和溶解,从而加速了有效成分的浸出。超声波提取以其操作简便快捷、提取温度低、提取率高、提取物的结构不易被破坏等特点,被广泛用于天然植物功能成分提取 [5]。
本文以乙醇为提取剂,采用超声波辅助提取新鲜黄花菜多酚,在单因素试验的基础上进行响应面多因素试验,研究黄花菜多酚的提取特性及最佳提取条件,为黄花菜多酚的纯化、结构鉴定、功能及加工特性等方面的深入研究提供基础。
2. 材料与方法
2.1. 材料
1) 试验样品
鲜黄花菜,品种:猛子花(湖南祁东金萱生物科技有限公司提供)。
2) 试剂与药品
甲醇,乙醇,无水碳酸钠,盐酸,氢氧化钠(国药集团化学试剂有限公司)没食子酸标准品(德斯特生物科技有限公司),福林酚试剂(合肥博美生物科技有限公司),上述试剂与药品均为国产分析纯。
3) 仪器与设备
超声清洗机(KS-5200DE,昆山洁力美超声仪器有限公司),恒温水浴锅(DK-98,天津市泰斯特仪器有限公司),可见分光光度计(V-5000,上海元析仪器有限公司),离心机(800D,江苏金怡仪器科技有限公司),电子天平(WT-K,常州万泰天平仪器有限公司),低温冰箱(MDF-40V,安徽中科都菱有限公司)。
2.2. 方法
2.2.1. 试验设计
1) 单因素对黄花菜多酚提取效果的影响
取新鲜黄花菜10.0 g,用粉碎机制成匀浆,加入提取溶剂,于固定功率100 W的超声清洗机中进行超声波辅助提取,以转速4000 r/min对提取液进行离心,离心时间15 min,取上清液待测。
提取溶剂的选择:分别以100%甲醇,100%乙醇,纯水为提取溶剂对黄花菜多酚进行提取,黄花菜与提取剂的比例均为1:10,提取温度40℃,提取时间20 min,以多酚得率为指标筛选最佳的提取溶剂。
以乙醇为提取剂,多酚得率为试验指标,考察提取时间(10 min、20 min、30 min)、料液比(1:5、1:10、1:15)、提取温度(30℃、40℃、50℃)、提取剂浓度(40%、60%、80%、100%)等单因素,研究上述因素对黄花菜多酚提取效果的影响。每个处理重复2次。
2) 黄花菜多酚提取的响应面试验设计
以提取时间、料液比、提取温度、乙醇浓度为试验因素,以黄花菜多酚得率为试验指标,采用4因素3水平进行响应面试验,研究黄花菜多酚的提取特性及最佳工艺条件,因素及水平见表1。

Table 1. Factors and levels of response surface test for polyphenol extraction
表1. 多酚提取的响应面试验因素及水平
2.2.2. 黄花菜多酚含量测定
根据参考文献采用福林酚分光光度法测定黄花菜提取物的多酚含量 [6]。
,其中c为多酚浓度,v为待测液体积,m为样品总质量。
2.2.3. 数据统计
采用方差分析和多重比较法(LSD)分析试验结果的显著性。
3. 结果与分析
3.1. 黄花菜多酚含量测定的标准曲线
根据浓度为0 mg/L、4 mg/L、8 mg/L、12 mg/L、20 mg/L、30 mg/L的标准系列测定多酚含量绘制标准曲线,没食子酸标准曲线见图1,得到回归方程
,
,在浓度0~35 mg/L范围内线性关系良好,可用来测定黄花菜多酚含量。

Figure 1. Standard curve of gallic acid
图1. 没食子酸标准曲线
3.2. 黄花菜多酚提取的单因素试验结果
3.2.1. 提取溶剂对多酚提取效果的影响
甲醇、乙醇、纯水等3种提取剂分别对黄花菜多酚进行提取,多酚得率如表2所示。

Table 2. The influence of different solvents on the yield of polyphenols
表2. 不同溶剂对多酚得率的影响
表2显示,3种提取剂对多酚的提取效果有显著影响(p < 0.05)。3种提取剂的极性最强的是水,其次是乙醇,甲醇的极性最弱,根据相似相溶原理,乙醇的提取效果最好,说明黄花菜多酚的极性强度与乙醇最为接近,因此乙醇的得率最大,随后的单因素和响应面试验均以乙醇作为提取剂。
3.2.2. 乙醇浓度对多酚提取效果的影响
在料液比1:10,超声温度40℃,超声时间20 min条件下,40%、60%、80%和100%等浓度的乙醇提取黄花菜多酚得率见表3所示。

Table 3. The influence of ethanol concentration on the yield of polyphenols
表3. 乙醇浓度对多酚得率的影响
表3显示,乙醇浓度对多酚的提取效果有显著影响(p < 0.05)。不同浓度的乙醇随浓度的增大其极性降低,进一步说明了多酚提取效果与提取剂极性的相关性,极性越强,多酚的溶解度越低 [7],虽然80%乙醇的多酚得率高于无水乙醇,但两者没有显著差异,因此,综合考虑提取成本和溶剂回收成本,选择80%乙醇作为提取剂是合适的。
3.2.3. 超声时间对多酚提取效果的影响
在料液比1:10,超声温度40℃,乙醇浓度80%的条件下,超声时间10 min,20 min,30 min时,多酚得率见表4。

Table 4. The effect of ultrasound time on the yield of polyphenols
表4. 超声时间对多酚得率的影响
表4显示,超声时间对多酚的提取效果有显著影响(p < 0.05)。多酚得率随提取时间的增加逐渐升高,时间稍长后多酚得率开始下降,原因可能是提取时间过长,多酚发生降解、氧化等化学反应致使多酚分子结构发生一定的破坏 [8]。
3.2.4. 料液比对多酚得率的影响
在超声温度40℃,超声时间20 min,乙醇浓度80%的条件下,料液比为1:5,1:10,1:15时,多酚得率见表5。

Table 5. The effect of the ratio of material to liquid on the yield of polyphenols
表5. 料液比对多酚得率的影响
表5显示,料液比对多酚的提取效果有显著影响(p < 0.05)。料液比1:10和1:15之间的多酚得率没有显著差异,但与1:5均有显著差异,原因是:黄花菜多酚提取过程是一个固–液提取过程,平衡态的时候,料液比越小,提取体系的浓度越大,固液分离(离心)后,残留在固相中的多酚量越大,导致得率越低,因此应选择大料液比进行提取,由于1:10和1:15之间的多酚得率没有显著差异,料液比越大,后续浓缩成本越高。
3.2.5. 超声温度对多酚得率的影响
在超声时间20 min,乙醇浓度80%,料液比1:10的条件下,分别在30℃,40℃和50℃条件下进行多酚提取,多酚得率见表6。

Table 6. The effect of ultrasonic temperature on the yield of polyphenols
表6. 超声温度对多酚得率的影响
表6显示,超声温度对多酚的提取效果有显著影响(p < 0.05)。多酚得率随提取温度的增加逐渐升高,温度过高后多酚得率开始下降,原因可能是提取温度过高,多酚发生降解、氧化等化学反应致使多酚分子结构发生变化 [9]。
3.3. 提取条件响应面结果分析
在单因素基础上,根据Box-Benhnken中心组合实验设计原理,按表3的因素水平进行响应面试验,响应面试验结果见表7。

Table 7. Response surface results of extraction conditions
表7. 提取条件响应面结果
采用Design-Expert 11对试验结果进行回归分析,多酚得率与因素之间的回归方程为
试验结果经过方差分析,结果见表8,表8显示,该回归模型P < 0.0001,说明模型极显著,其中乙醇浓度、超声温度和料液比的p < 0.0001,对多酚提取效果的影响为极显著;通过F值的比较可知各因素对指标影响的大小顺序为料液比 > 超声温度 > 乙醇浓度 > 超声时间。交互项AB,AC,AD,BC,BD,CD的P值均大于0.05,说明各交互项对多酚得率的影响不显著,因素之间的交互作用不强;二次型A2,B2,C2的P值均小于0.0001,对多酚得率影响极显著,模型相关系数R2 = 0.9795,说明模型拟合度高,很好反映了各因素与多酚得率之间的关系,用于模型试验结果可靠。

Table 8. Variance analysis of the results of the extracted conditional response surface
表8. 提取条件响应面结果方差分析
为了更直观的反映出两两因素交互作用对多酚得率的影响,根据回归方程绘制出其响应面图和等高线图,结果如图2~7所示。

Figure 2. Contour plot and response surface plot of material-to-liquid ratio and ethanol concentration
图2. 料液比与乙醇浓度等高线及响应面

Figure 3. Contour plot and response surface plot of ultrasound time and ethanol concentration
图3. 超声时间与乙醇浓度等高线及响应面

Figure 4. Contour plot and response surface plot of ultrasonic temperature and ethanol concentration
图4. 超声温度与乙醇浓度等高线及响应面

Figure 5. Contour plot and response surface plot of ultrasound time and ultrasound temperature
图5. 超声时间与超声温度等高线及响应面
各因素交互作用对响应值影响程度的强弱与响应面坡度和等高线密集度有关。响应面坡度越陡峭,则多酚得率受两因素交互作用影响就越大,反之,影响就越小;等高线密集呈椭圆形,说明其交互作应对响应值的影响显著,等高线稀疏呈圆形,则表示其交互效应不显著 [10]。图6料液比与超声时间的交互作用的响应曲面坡度最陡峭,且其等高线图椭圆率高,表明其交互作用对多酚得率影响最大;其次是料液比与乙醇浓度之间,料液比与温度之间,都有一定的;其余因素之间的交互作用很小。因素之间的交互作用表明,料液比与其它3个因素之间均发生交互作用,说明料液比是一个很重要的因素,对多酚得率的影响很大。
对回归方程计算最大值,得到多酚的最佳提取条件为:乙醇浓度65.286%,超声时间21.279 min,超声温度43.877℃,料液比1:12.537,在此条件下,多酚得率的最大理论值为2.343%。考虑到试验的实际可操作性,将多酚的提取条件调整为:乙醇浓度66%,超声时间22 min,超声温度43℃,料液比1:12,经过3组重复试验,得到实际多酚得率为2.318%,试验结果与理论预测值基本相符。
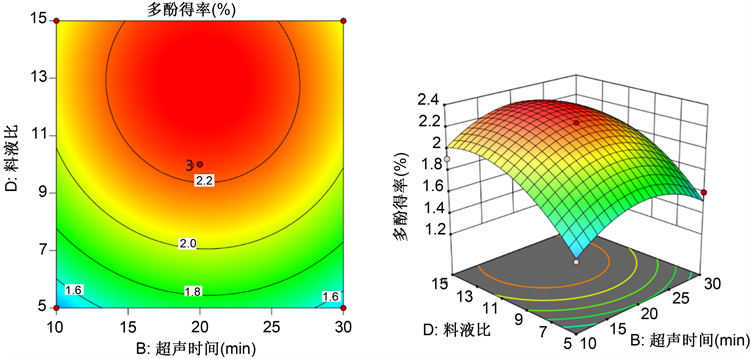
Figure 6. Contour plot and response surface plot of ultrasonic time and material-to-liquid ratio
图6. 超声时间与料液比等高线及响应面

Figure 7. Contour plot and response surface plot of material-to-liquid ratio and ultrasonic temperature
图7. 料液比与超声温度等高线及响应面
4. 结论
本文通过单因素试验探讨了超声时间、乙醇浓度、料液比及超声温度对黄花菜多酚得率的影响,设计响应面试验对单因素试验进行了优化,结果表明,料液比,超声温度,乙醇浓度对多酚得率的影响达显著水平,各因素对黄花菜多酚得率影响大小顺序为料液比 > 超声温度 > 乙醇浓度 > 超声时间;料液比与温度、时间和乙醇浓度之间的交互作用对多酚得率均有影响;黄花菜多酚的最佳提取条件为乙醇浓度66%,超声时间22 min,超声温度43℃,料液比1:12,多酚得率为2.318%。为黄花菜基础理论研究和产业的进一步发展提供理论依据。
基金项目
湖南省自然科学基金(2020JJ4367)。
NOTES
*第一作者。
#通讯作者。