1. 引言
脓毒症(Sepsis)急性肾损伤(Acute Kidney Injury, AKI)是重症监护室(Intensive Care Unit, ICU)最常见的AKI综合征,与较高的死亡率相关。目前的困难在于预防脓毒症患者发生AKI,因为当患者就医时,大多数已经发展成AKI [1] [2]。因此,早期识别脓毒症AKI,有助于提供支持性治疗和避免肾功能进一步的损伤。目前临床上仍以血清肌酐和尿量作为诊断AKI的指标,由于血清肌酐出现在肾损伤的中晚期,且受肌肉含量、饮食结构等因素的影响。尿量受利尿剂、血管活性药物、液体复苏、血液净化等临床治疗措施的影响,并不能真实地反映出肾脏是否早期受损 [3] [4] [5] [6]。因此临床需要能够早期、及时、快捷评估脓毒症发生AKI的指标。
炎症反应是AKI病理生理的重要机制之一 [7] [8]。从各级医院中最普及的血常规中可以非常容易计算出PLR和MLR,因为血小板、单核细胞、淋巴细胞易受生理、病理和物理因素的影响,所以PLR、MLR是更实用的指标 [9]。本研究探讨了PLR和MLR对脓毒症患者发生AKI的预测价值。
2. 资料与方法
2.1. 研究对象
收集2018年6月~2020年5月期间入住青岛大学附属医院ICU的221例脓毒症患者作为研究对象。
纳入标准:1) 脓毒症诊断符合《第3次脓毒症和脓毒性休克定义国际共识(Sepsis-3.0)》的标准 [10],即感染或疑似感染患者,且序贯器官衰竭(SOFA)评分 ≥ 2分。脓毒性休克:指脓毒症患者在充分液体复苏后仍存在持续性低血压,需要使用血管活性药物维持平均动脉压 ≥ 65 mmHg (1 mmHg = 0.133 kPa)以及血乳酸 > 2 mmol/L。2) 急性肾损伤诊断标准:根据改善全球肾脏病预后组织(KDIGO)指南标准 [11],符合以下任意一条即可诊断为AKI:① 在48小时内血肌酐上升 ≥ 26.5 μmoL/L;② 已知或推测肾功能损害发生在7天之内,血肌酐上升至 ≥ 基线值的1.5倍;③ 尿量 < 0.5 ml/(kg·h),持续6小时。
排除标准:1) 入院48小时内死亡或自动出院的患者;2) 患者有慢性肾病病史或肾移植病史;3) 入院时使用血液净化疗法;4) 患者存在影响NLR和PLR的疾病,如恶性肿瘤、艾滋病毒感染、自身免疫疾病、血液系统疾病等;5) 合并急性冠脉综合征的患者;6) 孕产妇和临床资料不全的患者。
2.2. 资料收集
通过青岛大学附属医院的医院信息系统,收集患者的一般临床资料如性别、年龄、是否脓毒性休克、是否机械通气、是否血液净化、是否应用血管活性药物等。收集患者入住ICU24小时内首次测得的平均动脉压(mean arterial pressure, MAP)、血尿素氮(blood urea nitrogen, BUN)、血肌酐(serum creatinine, Cr)、白细胞计数(white blood cell, WBC)、单核细胞计数(monocyte, MON)、淋巴细胞计数(lymphocyte LYM)、血小板计数(platelet, PLT)、降钙素原(procalcitonin, PCT)、动脉血pH值(arterial blood pH, pH)、动脉血乳酸(lactate, Lac)、氧合指数(oxygenation index, OI)、急性生理学与慢性健康状况评分系统II (acute physiology and chronic health scoring system II, APACHE II)、序贯器官功能衰竭(sequential organ failure assessment, SOFA)评分。并计算入住ICU时的血小板与淋巴细胞比值(platelet-to-lymphocyte ratio, PLR)、单核细胞与淋巴细胞比值(monocyte-to-lymphocyte ratio, MLR),中性粒细与淋巴细胞比值(neutrophil-to-lymphocyte ratio, NLR)。
2.3. 统计学方法
采用SPSS26.0进行统计学分析。数据均进行正态性检验及方差齐性检验,正态分布的计量资料统计描述采用均数±标准差(
)表示,组间比较采用独立样本t检验;非正态分布的计量资料统计描述采用中位数(四分位数) [M(P25, P75)]表示,组间比较采用独立样本秩和检验(Mann-Whitney U);计数资料统计描述采用百分率表示,组间比较采用c2检验;采用Spearman相关性分析探索PLR、MLR与其他临床指标的相关性;采用二元Logistic回归模型,探究PLR、MLR对脓毒症患者AKI发生的预测作用,P < 0.05时差异有统计学意义;绘制受试者工作特征(receiver operator characteristic, ROC)曲线,计算PLR、MLR对预测脓毒症患者发生AKI的敏感性和特异性,约登指数(敏感度 + 特异度 − 1)最大时对应的值为最佳截断值,P < 0.05时差异有统计学意义。
3. 结果
3.1. 一般临床资料比较
221例脓毒症患者中,95例(43%)合并AKI,126例(57%)不合并AKI,脓毒性休克患者62例,比例为28.1%。
AKI组与N-AKI组患者在性别、年龄、平均动脉压的比较上,差异均无统计学意义(P > 0.05)。但脓毒性休克患者在两组中所占比例,AKI组[35例(36.8%)]明显高于N-AKI组[27例(21.4%)],差异有统计学意义(P < 0.05),见表1。
3.2. 实验室化验指标比较
在肾功能相关指标的比较上,AKI组血尿素氮高于N-AKI组,差异有统计学意义(P < 0.01),AKI组血肌酐高于N-AKI组,差异有统计学意义(P < 0.001)。在感染相关指标的比较上,两组间白细胞计数、中性粒细胞计数、单核细胞计数、淋巴细胞计数差异无统计学意义(P > 0.05),但AKI组血小板计数小于N-AKI组,差异有统计学意义(P < 0.01),AKI组降钙素原高于N-AKI组,差异有统计学意义(P < 0.01)。在血气相关指标的比较上,两组间氧合指数差异无统计学意义(P > 0.05),但AKI组动脉血pH值低于N-AKI组,差异有统计学意义(P < 0.001),AKI组动脉血乳酸高于N-AKI组,差异有统计学意义(P < 0.001)。在评分系统的比较上,AKI组APACHE II评分和SOFA评分均高于N-AKI组,差异有统计学意义(P < 0.001)。AKI组患者入院时PLR、入院时MLR均小于N-AKI组,差异有统计学意义(P < 0.001),入院时NLR小于N-AKI组差异有统计学意义(P < 0.01),见表1。

Table 1. Comparison of baseline data between AKI group and N-AKI group
表1. AKI组与N-AKI组基线资料比较
3.3. 临床特征比较
AKI组中的机械通气、血液净化、血管活性药物的使用率均高于N-AKI组,并且血液净化和应用血管活性药物的使用率差异有统计学意义(P < 0.001),而机械通气的使用率差异无统计学意义(P > 0.05),见表2。

Table 2. Comparison of clinical features between AKI group and N-AKI group
表2. AKI组与N-AKI组临床特征比较
3.4. 脓毒症AKI患者PLR、MLR与其他临床指标的相关性分析
脓毒症AKI患者PLR与性别、白细胞计数、降钙素原、血肌酐、白蛋白、APACHE II评分无相关性(P > 0.05),与年龄、血尿素氮呈轻度正相关(P < 0.05),与单核细胞计数、SOFA评分呈轻度负相关(P < 0.05),与动脉血乳酸呈轻度负相关(P < 0.01);MLR与性别、年龄、单核细胞计数、降钙素原、血尿素氮、血肌酐、动脉血乳酸、APACHE II评分无相关性(P > 0.05),与白细胞计数呈轻度正相关(P < 0.05),与SOFA评分呈中度负相关(P < 0.05),见表3。

Table 3. Correlation analysis of PLR, MLR and other clinical indicators in patients with sepsis AKI
表3. 脓毒症AKI患者PLR、MLR与其他临床指标的相关性分析
3.5. 脓毒症AKI患者独立预测因素的Logistic回归模型结果
单因素Logistic回归分析显示,入院24小时内首次测得的血小板计数(P < 0.05)、动脉血乳酸(P < 0.001)、APACHE II评分(P < 0.001)、SOFA评分(P < 0.001)、PLR (P < 0.001)、MLR (P < 0.01)与脓毒症AKI的发生相关。多因素Logistic回归分析显示,动脉血乳酸(P < 0.01)、APACHEII评分(P < 0.01)、SOFA评分(P < 0.05)、PLR (P < 0.05)、MLR (P < 0.05)均为脓毒症患者发生AKI的独立预测因素,见表4。
3.6. PLR、MLR对脓毒症AKI预测性能的ROC曲线分析
ROC曲线如图1所示。表5显示,PLR预测脓毒症患者发生AKI的AUC为0.646,95%CI (0.573~0.720),P < 0.001,最佳截断值为127.875,敏感度48.4%,特异性77%。MLR预测脓毒症患者发生AKI的AUC为0.638,95%CI (0.564~0.713),P < 0.001,最佳截断值为0.455,敏感度53.7%,特异性69.8%。

Table 4. Results of logistic regression model for independent predictors of AKI in patients with sepsis
表4. 脓毒症AKI患者独立预测因素的Logistic回归模型结果
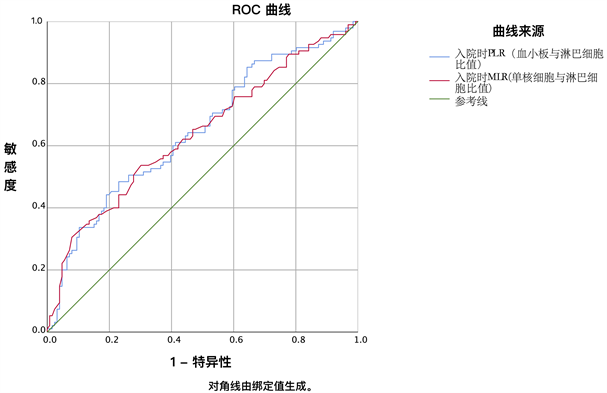
Figure 1. ROC curve of PLR and MLR in predicting AKI in sepsis
图1. PLR、MLR对脓毒症AKI预测性能的ROC曲线

Table 5. Area comparison of AKI prediction index curve of sepsis
表5. 脓毒症AKI各预测指标曲线下面积比较
4. 讨论
AKI是危重患者常见的异质性综合征,目前我们对AKI相关的病理生理机制知之甚浅,对其预防和治疗的措施有限,导致其短期和长期预后均较差。2012年KDIGO发布的AKI定义是不充分的,因为它们没有解决潜在的异质性病理生理机制 [12],这些机制一旦得到更好地理解,即可允许个体化、精准化治疗。脓毒症AKI是AKI患者中最常见的一种类型,它的生理机制更是难以捉摸 [13],因为它是根据一系列症状和临床指标进行临床诊断的。炎症机制是脓毒症AKI重要的发病机制之一,血小板在免疫调节和炎症过程中都起着重要作用,它通过诱导炎症细胞因子的释放,与不同种类的细菌和免疫细胞相互作用,包括中性粒细胞、T淋巴细胞、自然杀伤细胞和巨噬细胞,有助于炎症过程的开始或恶化 [14] [15] [16]。淋巴细胞是具有不同功能和表型特征的异质性细胞群体,参与适应性免疫。淋巴细胞减少被认为是严重脓毒症死亡率的一个指标,主要是因为它激活了凋亡过程 [17] [18],低淋巴细胞计数在一定程度上代表了免疫和炎症反应的抑制,也被报道与炎症性疾病有关 [19]。单核细胞是先天性免疫反应的重要组成部分,通过向淋巴细胞递呈抗原的方式与适应性免疫系统相连,单核细胞对各种细菌化合物的反应导致其释放促炎性细胞因子的能力降低,这可能是脓毒症诱导免疫抑制的最显著特征 [20]。因此我们推断PLR、MLR是风险指标。
本次研究显示,脓毒症AKI患者的入院时的PLR、MLR均小于N-AKI组,AKI组的APACHEⅡ评分和SOFA评分均高于N-AKI组;多因素Logistic回归模型也提示PLR、MLR、APACHEII评分、SOFA评分均为脓毒症患者发生AKI的独立预测因素。ROC曲线分析提示PLR预测脓毒症患者发生AKI的最佳截断值为127.875,MLR预测脓毒症患者发生AKI的最佳截断值为0.455,均有不错的敏感度和特异性。
5. 结论
综上所述,PLR、MLR是脓毒症AKI独立预测因子,均有较好的敏感度和特异性,为早期检测脓毒症患者发生AKI提供了有效的信息。本研究新颖之处是可以在任何一家一级医院、二级医院、三级医院随时、简便、快捷、廉价地获取PLR和MLR,因而具有广阔的应用空间。但本研究也有局限之处:1) 本研究为单中心、回顾性研究,且样本量相对较少。2) 只记录了入院时的PLR、MLR,未动态监测PLR、MLR,故仍需要多中心、大样本的前瞻性研究进一步验证。
参考文献
NOTES
*通讯作者。