摘要:
目的:探讨真实世界背景下甲状腺乳头状癌(papillary thyroid carcinoma, PTC)术后复发的相关危险因素。方法:回顾性分析2014年1月~2019年1月于青岛大学附属医院行首次手术治疗的460例PTC患者的临床资料,根据术后是否出现复发将上述460例PTC患者分为两组,对相关因素进行单因素及COX回归分析,绘制Kaplan-Meier无复发生存曲线。结果:460例患者中45例(9.8%)出现术后肿瘤复发,平均复发时间15.9 ± 14.4个月。单因素分析结果显示两组患者在性别、是否合并桥本氏病方面无明显差异(P > 0.05),而在年龄、合并BRAFV600E基因突变、肿瘤多发病灶、肿瘤最大直径、有淋巴结转移、被膜外侵犯、有远处转移方面存在差异(P > 0.05)。本研究对BRAFV600E进一步分层,对BRAFV600E (+)组及BRAFV600E (−)组行COX回归分析,探究影响PTC术后复发的危险因素。COX回归结果显示合并BRAFV600E (+)、存在淋巴结转移、被膜侵犯、远处转移均是导致PTC术后复发的独立危险因素。结论:PTC总体预后较好,但复发风险较高,临床上应对合并上述危险因素的患者加强警惕,密切随访,以期降低术后复发率。
Abstract:
Objective: To investigate the related risk factors for postoperative recurrence of papillary thyroid carcinoma (PTC) in a real world research. Methods: Retrospective analysis was performed on the clinical data of 460 PTC patients who received first surgical treatment in the Affiliated Hospital of Qingdao University from January 2014 to January 2019. The patients were divided into two groups according to whether there was postoperative recurrence. Single factor and COX regression analysis was performed on the related factors and the Kaplan-Meier survival curve was drawn. Results: Among 460 patients, 45 (9.8%) had tumor recurrence after surgery, with an average recurrence time of 15.9 ± 14.4 months. The results of univariate analysis showed that there was no significant difference between the two groups of patients in terms of gender and whether they have Hashimoto’s disease (P > 0.05); however, there are differences in age, combined BRAFV600E gene mutation, multiple tumor foci, maximum tumor diameter, lymph node metastasis, extracapsular invasion, and distant metastasis (P > 0.05). In this study, the BRAFV600E group was further stratified, and COX regression analysis was conducted for the BRAFV600E (+) group and the BRAFV600E (−) group, respectively, to explore the risk factors affecting the recurrence after PTC. COX regression results showed that combined BRAFV600E (+), the presence of lymph node metastasis, extracapsular invasion, and distant metastasis were independent risk factors for recurrence after PTC. Conclusion: The overall prognosis of PTC is good, but the risk of recurrence is higher. Clinically, patients with the above risk factors should be vigilant and closely followed up to reduce the recurrence rate after surgery.
1. 引言
PTC是甲状腺癌中最常见的病理类型,约占甲状腺癌的85%左右 [1],其恶性程度较低,预后较好,然而其主要问题是局部复发及远处转移。据临床调查显示:12%~19%的分化型甲状腺癌会发生远处转移,6%~21%出现局部复发 [2]。尽管大多数PTC可以通过手术、放射碘治疗和甲状腺抑制疗法成功治疗,但5%至20%的患者仍会发生肿瘤复发 [3]。目前,PTC最主要的治疗方法仍为手术切除,但甲状腺解剖结构复杂、血流丰富,手术切除不彻底仍是复发的主要原因。因此,本研究将探讨甲状腺乳头状癌术后复发的危险因素,降低术后复发率,改善患者预后状态。
2. 资料与方法
2.1. 临床资料
收集2014年1月~2019年1月于青岛大学附属医院行首次手术治疗的460例PTC患者的临床资料,所有患者均符合PTC诊断标准 [4],并均经术后病理结果证实。PTC的复发,包括局部,区域和远处复发,是指根据标准组织学,细胞学,放射学或生化标准诊断的复发性或持续性PTC,具体指残余腺体内肿瘤复发,区域淋巴结转移,气管、周围颈部肌肉、周围软组织和神经受累以及远处转移 [5]。根据是否发生术后复发分为两组,将复发患者(45例)纳入复发组,未复发患者(415例)纳入对照组。所有患者临床资料均经患者同意,签署知情同意书。
2.2. 纳入及排除标准
纳入标准:① 临床资料完整;② 经术后病理证实为PTC;③ 均为初发患者;④ 术前未接受甲状腺放疗、化疗及131I治疗。排除标准:① 合并其他恶性肿瘤、重大脏器疾病或免疫系统疾病;② 临床资料不完整者;③ 术前患甲状腺疾病及相关治疗史。
2.3. 统计学方法
将复发组及对照组两组患者的临床资料进行比较,使用SPSS 26.0软件进行统计分析,计数资料用率表示,组间比较采用卡方检验,P < 0.05具有统计学意义。计量资料用均数±标准差表示,组间比较采用t检验,P < 0.05具有统计学意义;对相关因素应用Kaplan-Meier法进行无复发生存分析;最后用COX风险回归研究多种因素对PTC复发的影响,最终确定PTC复发的独立危险因素。
3. 结果
3.1. 一般情况
本研究中460例患者获得随访,其中45例(9.8%)患者出现术后PTC复发,其中6例为残余腺体复发,37例为颈部淋巴结复发,2例远处转移为肿瘤持续状态,复发时间1~71个月,中位复发时间12个月,其余415例患者未出现术后复发。根据PTC是否出现术后复发分为对照组和复发组,对照组中男性96例,女性319例,男女比例1:3.3,平均年龄为48.0岁,复发组中男性14例,女性31例,男女比例1:2.2,平均年龄为44.1岁。
3.2. 单因素分析
单因素分析结果显示PTC术后复发与性别、是否合并桥本氏病无关(P > 0.05),而与年龄、BRAFV600E基因突变、病灶数、肿瘤最大直径、淋巴结转移、被膜侵犯、远处转移相关(P < 0.05) (见表1)。


Table 1. Comparative analysis of clinical data between the relapse group and the control group
表1. PTC复发组与对照组临床资料比较分析
标注:PTC,甲状腺乳头状癌。“*”表示有显著统计学意义。
3.3. 生存分析
对BRAFV600E基因突变、淋巴结转移、被膜侵犯、癌灶分别进行生存分析(结果见图1~4)。图1结果示BRAFV600E (+)基因突变者无复发生存率较BRAFV600E (−)基因突变者降低。图2结果示存在淋巴结转移者无复发生存率明显降低。图3结果示合并被膜侵犯者无复发生存率明显降低。图4表示多癌灶者无复发生存率明显降低。
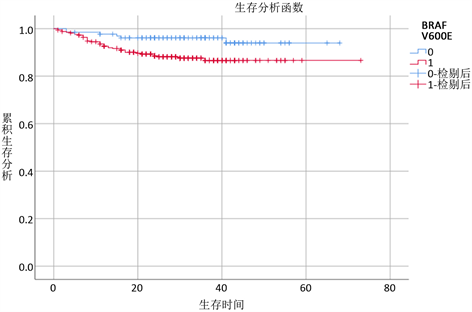
Figure 1. BRAFV600E Kaplan-Meier survival curve
图1. BRAFV600E Kaplan-Meier生存曲线

Figure 2. Lymph node metastasis Kaplan-Meier survival curve
图2. 淋巴结转移Kaplan-Meier生存曲线

Figure 3. Envelope invasion Kaplan-Meier survival curve
图3. 被膜侵犯Kaplan-Meier生存曲线

Figure 4. Cancer foci Kaplan-Meier survival curve
图4. 癌灶Kaplan-Meier生存曲线
3.4. 多因素分析
多因素COX回归分析结果显示BRAFV600E (+)、存在淋巴结转移、被膜侵犯、远处转移均是甲状腺乳头状癌术后复发的独立危险因素(OR > 1, P < 0.05) (见表2)。
BRAFV600E (+)者共331例,行COX回归分析,结果见表3。BRAFV600E (−)者共129例,行COX回归分析,结果见表4。
注释:B,回归系数;S.E.,标准误;Wald,卡方值;OR,比值比;95% CI,95%置信区间。“*”表示有显著统计学意义。

Table 3. BRAFV600E (+) COX regression analysis
表3. BRAFV600E (+) COX回归分析
注释:B,回归系数;S.E.,标准误;Wald,卡方值;OR,比值比;95% CI,95%置信区间。“*”表示有显著统计学意义。


Table 4. BRAFV600E (−) COX regression analysis
表4. BRAFV600E (−)COX回归分析
注释:B,回归系数;S.E.,标准误;Wald,卡方值;OR,比值比;95% CI,95%置信区间。“*”表示有显著统计学意义。
4. 讨论
甲状腺癌是最常见的内分泌肿瘤,近年来,其发病率不断升高,特别是PTC [6]。PTC的复发可能是多因素的,包括相关危险因素及疾病本身所致。随着超声等影像学检查的普及和居民健康意识的提高,PTC的检出率较前明显增高,绝大部分患者在早中期即可明确诊断。PTC虽恶性程度较低,预后较好,但仍有一定的复发率,据文献报道,部分侵袭性强的PTC术后复发率可高达30% [7]。目前,手术治疗是首选治疗方式,但由于甲状腺组织解剖结构复杂、血管神经丰富,容易造成手术切除不彻底,这是导致PTC术后复发的主要原因。术后复发不仅严重影响患者的生存质量和心理状态,亦给家庭带来沉重的经济负担。因此,本研究将探讨PTC术后复发的危险因素,以期指导临床诊疗,降低PTC患者术后复发率。
关于性别及年龄是否影响PTC复发,不同学者持有不同的观点。Zhang等人认为男性、年龄 > 50岁增加了PTC患者术后复发的风险 [8]。范自平等人研究发现 ≤ 45岁PTC患者复发率明显高于 > 45岁PTC患者,年龄是PTC复发的危险因素 [9]。国外GUO.K等人认为在西方国家,患者年龄与术后复发相关,而在亚洲人群中,年龄与术后复发无显著相关性 [10]。当然,国内张锡贵等人研究发现甲状腺癌复发与年龄无关 [11]。因此,年龄与性别对PTC复发的影响暂无统一定论。在第八版AJCC分期标准中,将年龄55岁作为预后切入年龄,但也有学者指出无论取哪个年龄作为分组的切入点,都提示年龄是影响PTC预后的重要因素,很难确定一个最具有指导意义的分期年龄 [12]。而且,在AJCC分期标准中,年龄是重要的分期条件,但PTC的临床分期只能预测死亡率,不能预测复发率。因此,本研究中将年龄作为连续变量进行分析,结果发现年龄是PTC复发的危险因素,但不是独立危险因素。本研究中性别与年龄均不是PTC复发的独立影响因素。因此年龄及性别是否影响PTC复发仍存在争议,仍需进一步扩大样本量进行进一步分析。
近年来,BRAFV600E基因突变已成为PTC发病机制研究中的热点。BRAFV600E基因突变是一种原癌基因突变,编码B-Raf蛋白,激活MAP激酶信号传导途径从而促进肿瘤发生。国外相关研究证实合并BRAFV600E基因突变的PTC患者更易发生淋巴结转移,从而造成PTC复发风险升高 [13]。据文献报道,BRAFV600E突变会导致PTC病程进展,并与侵袭性临床病理特征和肿瘤复发相关 [14]。在过去的十年中,BRAFV600E基因突变已成为影响PTC复发的独立危险因素 [15]。同样,Wang等人研究发现BRAFV600E基因突变的男性患者与PTC复发及特异性死亡率密切相关,尤其是后者 [16]。本研究将BRAFV600E基因分层进行进一步COX回归分析,结果显示BRAFV600E (+)基因突变组PTC患者术后复发危险因素与全部患者复发危险因素相一致,BRAFV600E (−)基因突变组中相关因素均不是导致PTC术后复发的危险因素,更加证实了BRAFV600E (+)基因突变是PTC复发的独立危险因素,与上述国内外研究结果相一致。我们认为BRAFV600E基因突变在鉴别甲状腺肿瘤良恶性方面特异性较高,且合并BRAFV600E (+)基因突变的PTC患者更易出现术后复发。因此,临床上对合并BRAFV600E基因突变的PTC的患者应格外重视,加强其术后随访管理,警惕复发。
本研究发现肿瘤最大直径是术后复发的危险因素之一,但不是术后复发的独立危险因素。据国外文献报道,PTMC和肿瘤直径 > 1 cm的患者复发率没有显著差异 [17],而Su等人研究发现肿瘤直径 ≥ 1 cm与术后复发增加显著相关 [18]。因此,关于肿瘤最大直径对于PTC复发的影响尚无统一定论。随着肿瘤直径不断增大,更容易侵犯甲状腺周围组织,发生被膜侵犯及远处转移,导致手术彻底切除难度大,增加复发几率。本研究中多因素回归结果显示被膜侵犯及远处转移均是PTC术后复发的独立危险因素,由此可见,被膜侵犯及远处转移更具侵袭性,而肿瘤最大直径与PTC复发之间的关系并不十分显著。可见,肿瘤大小并不显著影响PTC的复发,即使肿瘤很小,一旦出现被膜侵犯及远处转移,都容易出现PTC复发,因此,肿瘤最大直径本身并不是PTC复发的独立危险因素。
被膜侵犯与肿瘤大小密切相关,存在被膜侵犯往往预测着肿瘤具有更强的侵袭性,同时,被膜侵犯也是ATA指南中复发危险度分层的重要条件,是PTC复发的重要影响因素。关于被膜侵犯对PTC复发的影响,国内外学者持有不同的观点。Ge等人的研究发现存在包膜浸润的PTC患者发生区域复发的风险更高,包膜浸润是PTC术后复发的独立危险因素 [19]。而Amit对2084例患者的回顾性研究发现甲状腺外侵犯在预测PTC局部复发上有重要意义,但不是甲状腺癌复发的独立危险因素。国内相关研究发现原发灶包膜外侵犯的青少年PTC患者预后较差,包膜外浸润是影响青少年PTC复发的独立危险因素 [20]。本研究中证实被膜侵犯是PTC术后复发的独立危险因素。随着肿瘤直径的增大,更易侵犯甲状腺周围组织及被膜,增加了多中心癌灶、被膜侵犯及淋巴结转移的风险,造成手术难度增大,术后复发风险增高。因此,合并被膜侵犯的PTC患者更易出现术后复发。
术前超声检查在诊断PTC颈部淋巴结转移方面具有高度敏感性和特异性,可提供可靠的信息来辅助外科手术治疗,因此,术前颈部超声检查已成为评估PTC是否出现颈部淋巴结转移的首选诊断方法。国外有研究发现淋巴结转移可能导致PTC复发风险增加4倍 [21]。因此,淋巴结转移是影响PTC复发的重要危险因素。相关研究显示颈部淋巴结转移是PTC复发的独立危险因素,如果术前即存在淋巴结转移,则应行淋巴结清扫术,降低肿瘤术后复发风险 [22]。Watkinson等人研究发现60%~75% PTMC患者的复发首先出现在颈部淋巴结 [23]。本研究复发组(45例)中颈部淋巴结复发者37例,也说明颈部淋巴结是最常见的复发部位,与国外研究结果相一致。本研究结果显示淋巴结转移是PTC复发的独立危险因素。可能由于术前即存在淋巴结转移的PTC患者隐匿性病灶较多,增加了手术切除的难度,导致部分隐匿性病灶难以彻底切除从而更造成术后复发率升高。因此,术前淋巴结转移的患者,手术时应注意加强淋巴结清扫的范围,从而降低术后复发率。日本一项相关研究发现远处转移是PTC的重要预后因素,伴远处转移的PTC患者更易出现不良预后结局 [24],且远处转移患者易合并淋巴结转移,导致术后复发风险升高。本研究结果显示远处转移是PTC术后复发的独立危险因素,与上述研究结果相一致。本研究中远处转移的例数较少,仍待临床大样本数据的进一步研究。
本研究发现存在BRAFV600E (+)基因突变、存在淋巴结转移、被膜外侵犯、远处转移均是导致PTC术后复发的独立危险因素。虽然目前仍没有大量临床前瞻性研究证据表明肿瘤复发会影响患者生存率,但肿瘤复发也会对患者及其家庭带来巨大的身心创伤和经济负担。因此,临床诊疗过程中,应规范术前评估,合理选择手术方案,术后加强对高危患者的预后管理,以期降低术后复发率,改善PTC患者的生活质量。