1. 引言
化石燃料的大量使用,导致传统化石燃料的枯竭和环境污染问题的加剧,使得寻找包括生物质能源在内的各种可持续发展能源显得尤为重要。藻类生物质具有生长速度快,对生长环境要求低,可降低温室效应等优点,是一种可再生、环境友好的生物质能源材料 [1] [2] 。藻类生物质的主要成分为多糖、蛋白质和脂类,其在水热液化条件下可分别水解生成具有不同组成成分的生物原油。为了研究藻类的主成分间是否会发生相互作用,Biller和Ross [3] 利用一系列多糖、蛋白质和脂类模型物进行水热液化实验,根据公式计算了生物油产率,所得结果与实际液化结果不同,由此可知,藻类主成分模型物的水热液化降解路径与藻体实际水热液化的降解机制存在一定的差异 [4] 。模型混合物的生物油产率超过了由各个单一模型物水热液化生成的生物油产率的加和,从而认为藻类单一主成分之间在混合水热液化中发生了相互作用。
还原糖可以与氨基酸反应生成吡咯和吡啶等含氮杂环化合物,被称为美拉德反应 [5] ,由于其会产生类黑精等物质而降低生物油产率。蛋白质和多糖在混合水热液化中发生的反应比较复杂,Yang等 [6] 依据公式计算蛋白质和多糖二元混合物水热液化制得的生物油的理论产率,结果与两者水热液化的实际产率有所不同,表明多糖–蛋白二元模型混合物的实际液化行为与理论行为存在差异。生物油产率与多糖和蛋白质的含量没有线性关系,意味着多糖和蛋白质间发生了相互作用并且对水热液化的生物油产率有显著影响。Torri等 [7] 在350℃的液化温度下研究了多糖和蛋白质间的反应对生物油形成的影响,发现随着反应的进行,多糖和蛋白间的热分裂产物增多并进入到油相中,从而增加了生物油产率。
除了多糖和蛋白质会发生相互作用外,多糖和脂类、蛋白质和脂类之间的反应对藻类水热液化过程的影响也不容忽视。赵永年 [8] 曾考察了温度和SO42−/ZrO2催化剂用量对多糖–脂类二元模型混合物水热液化过程的影响,认为在温度为220℃时,SO42−/ZrO2催化剂的加入提高了水热液化的生物油产率,改变了生物油组成。Changi等 [9] 采用苯丙氨酸和油酸乙酯两种模型物进行水热液化实验,通过GC-MS分析可知生物油中含有脂肪酸酰胺类物质,进一步说明氨基酸的水解产物胺类和脂类的水解产物脂肪酸在亚临界水环境中会发生反应生成脂肪酸酰胺类物质。
引入催化剂是生物油制备过程提高产量、改善质量的一种有效方法 [10] 。与均相催化剂相比,非均相催化剂具有易分离、环境友好、可循环利用的优点 [11] [12] 。非均相催化剂如分子筛,稀有金属和过渡金属氧化物以及负载型金属催化剂已被广泛应用于藻类的催化液化中 [13] 。其中,HZSM-5是一种重要的固体酸催化剂,由于其独特的酸性质和孔道结构、制备简单、水热稳定性和催化性能好等优点而在生物质的水热液化中获得了较广泛的应用。
藻类的生物化学组成也是影响生物油产量和质量的重要因素。大部分研究停留在藻类单一主成分(多糖、蛋白质、脂类化合物)单独水热液化上 [8] ,很少有研究能够深入了解,在催化剂的存在下,藻类主成分间的相互作用对水热液化过程中的产物分布和生物油组成以及生物油形成路径的影响。因此,笔者构建藻类二元混合物模型,包括多糖–蛋白、多糖–脂类、蛋白–脂类三种模型混合物,在其水热液化反应中引入HZSM-5催化剂,考察HZSM-5用量对二元模型混合物水热液化的各产物产率、生物油的组成及其热值(HHV)的影响,并进一步探究HZSM-5催化剂对藻类二元模型混合物水热液化过程中生物油形成路径的影响。
2. 实验部分
2.1. 试剂与原料
ZSM-5 (n(Si/Al) = 38和n(Si/Al) = 50),工业级,天津市元立化工有限公司;硝酸铵,分析纯,天津市巴斯夫化工有限公司;二氯甲烷、甘油、油酸,分析纯,国药集团化学试剂有限公司产品;氮气(体积分数99.5%),青岛瑞丰气体有限公司提供。多糖、蛋白质干粉购买于陕西帕尼尔生物科技有限公司;脂类化合物模型物由甘油和油酸混合物替代。
2.2. HZSM-5的制备
采用离子交换法制备HZSM-5催化剂。称取质量为5.0 g的ZSM-5 (Si/Al = 38或Si/Al = 50),与1 mol/L的NH4NO3溶液按料液比1:20混匀,在80℃下,搅拌交换2 h,抽滤,用蒸馏水洗涤固体产物至中性。重复以上步骤2次,将所得样品在100℃烘箱中干燥24 h,于550℃马弗炉中焙烧6 h,取出干燥保存待用。
2.3. HZSM-5的表征
采用反滴定法测定催化剂的总酸量,根据式(1)进行计算。测定方法为:取0.1 g焙烧之后的催化剂,与20 mL用邻苯二甲酸氢钾准确标定浓度的氢氧化钠溶液反应1 h。将固液混合物经多次离心分离后取上层清液,再用准确标定浓度的盐酸滴定剩余氢氧化钠溶液 [14] 。
(1)
2.4. 水热液化过程
藻类及其主成分模型物的水热液化过程在高压反应釜中进行,以8℃/min的加热速率升温至各原料的最佳反应温度,固定液化时间为15 min。反应结束后冷却至室温,取出产物、抽滤、静置分层、分离油相和水相。油相在35℃下减压蒸馏除去溶剂得到生物油(Bio-oil);水相在60℃下蒸发除去水分得到水溶性产物(WSOs)。将滤渣于110℃下烘干至恒重 [8] 。根据式(2)、(3)、(4)和(5)分别计算各产物的产率。
(2)
(3)
(4)
(5)
其中,式(2)~(5)中,YBio-oil、YResidue、YWSOs和YGas分别表示生物油、残渣、水溶性物质和气体的产率,%;MBio-oil、MResidue、MWSOs和MFeedstock分别表示生物油、残渣、水溶性产物和原料的质量,g。
3. 结果与讨论
3.1. HZSM-5催化剂的表征分析
3.1.1. HZSM-5催化剂的总酸量分析
ZSM-5沸石含有十元环,基本结构单元是由八个五元环组成的。ZSM-5 (Si/Al = 38)为规则的长方形,而ZSM-5 (Si/Al=50)为规则的六边形体。HZSM-5是ZSM-5经过多次铵离子交换后,经烘干、焙烧得到的H型分子筛。酸强度、酸量和酸类型是固体酸的基本性质。催化剂的总酸量采用反滴定法测定,测定的两种HZSM-5的总酸量(包括强酸、中强酸、弱酸)如表1所示,可以发现,HZSM-5 (Si/Al = 38)催化剂的总酸量要高于HZSM-5 (Si/Al = 50)催化剂的总酸量。催化剂的表面酸量受表面羟基密度和比表面积等多种因素影响 [15] 。随着焙烧温度的升高,固体酸表面酸量逐渐下降的原因可能是表面羟基密度和比表面积越来越小。结果导致表面总羟基含量减少,催化剂表面的总酸量减少。

Table 1. Total acidity of HZSM-5 catalyst
表1. HZSM-5催化剂的总酸量
3.1.2. HZSM-5催化剂重复利用的分析
陈晓威 [16] 曾进行了HZSM-5催化剂重复利用的研究,将催化剂加入到小球藻的水热液化实验中,结果表明,重复利用三次的HZSM-5仍然具有一定的催化活性,且经XRD表征认为,HZSM-5晶体结构几乎没有被破坏,间接证明HZSM-5催化剂具有较好的水热稳定性。
3.2. 二元模型混合物的水热液化过程
3.2.1. HZSM-5对多糖-蛋白二元模型混合物水热液化的影响
以300℃作为反应温度,选取多糖含量分别为20%、40%和80%的多糖–蛋白二元模型混合物为研究对象,加入不同量的催化剂HZSM-5 (Si/Al = 38)进行水热液化实验,产物产率和生物油热值变化如图1所示。多糖含量为20%的多糖–蛋白二元模型混合物水热液化的生物油产率在HZSM-5的用量为5%时达到最大,为29.12%,而在整个过程中几乎没有残渣生成。这表明HZSM-5的加入量为5%时催化效果最好,当催化剂加入过多时会促进水相和气相产物的生成从而不利于生物油的产生。生物油热值在催化剂用量为7%时达到最大,为31.2 MJ/kg。对于多糖含量为40%的多糖–蛋白二元模型混合物,HZSM-5的加入使生物油产率得到了提高,在催化剂用量为7%时生物油产率高达19.94%。对于生物油热值,加入催化剂以后基本都比无催化剂时有所提高,最高可达29.54 MJ/kg。对于多糖含量为80%的多糖–蛋白二元模型混合物,HZSM-5的加入只提高了残渣的收率,生物油的产率反而略有下降,可能原因是HZSM-5的添加促使生物油中的小分子物质聚合形成了残渣。生物油热值大致呈先减少后增加的趋势,最高达到了30.95 MJ/kg。对于多糖–蛋白二元模型混合物,多糖和蛋白的比例对其水热液化产物的分布和生物油热值有着重要的影响。蛋白含量越高,生物油产率就越高,受HZSM-5催化剂的影响也更明显。
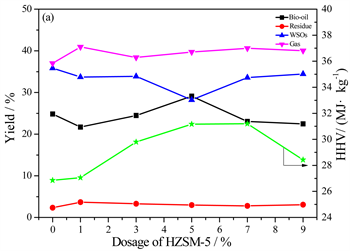
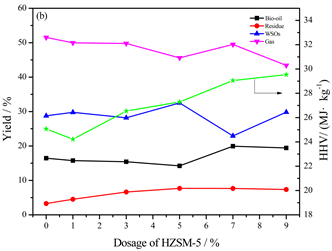
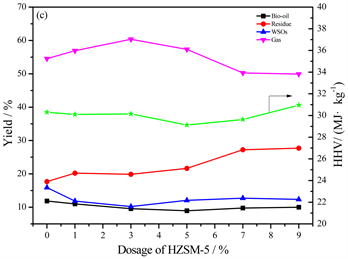
Figure 1. Product yields and HHVs of bio-oil from HTL of polysaccharides-proteins versus the dosage of HZSM-5. Polysaccharides content: (a) 20%;(b) 40%;(c) 80%
图1. 多糖–蛋白二元混合物水热液化所得产物产率和生物油热值随HZSM-5用量的变化。多糖含量:(a) 20%;(b) 40%;(c) 80%
3.2.2. HZSM-5对多糖-脂类二元模型混合物水热液化的影响
在最佳温度220℃下,不同量的HZSM-5 (Si/Al=38)被添加到多糖-脂类二元模型混合物的水热液化实验中,产物产率和生物油热值随HZSM-5用量的变化如图2所示。生物油产率在HZSM-5用量为7%时达到最高,为45.30%,但当催化剂的用量过多时生物油产率反而下降。推测可能是因为添加过多的催化剂反而促进了多糖和脂类间副反应的发生,导致生成的小分子物质聚合形成残渣从而使生物油的产率降低。生物油热值在HZSM-5用量为7%时达到最高为40.69 MJ/kg,过量的HZSM-5使生物油热值下降,由此可认为多糖–脂类二元模型混合物水热液化生成的生物油产率和热值的变化趋势具有一致性。

Figure 2. Product yields and HHVs of bio-oil from HTL of polysaccharides-lipids versus the dosage of HZSM-5
图2. 多糖–脂类二元混合物水热液化所得产物产率和生物油热值随HZSM-5用量的变化
3.2.3. HZSM-5对蛋白-脂类二元模型混合物水热液化的影响
在最佳温度300℃下,将不同量的催化剂HZSM-5 (Si/Al = 38)添加到蛋白-脂类二元模型混合物的水热液化中,产物产率和生物油热值随HZSM-5用量的变化如图3所示。加入催化剂以后,生物油产率在催化剂用量为5%时提高效果最明显,比不加HZSM-5时增加了10.90%,而生物油热值在催化剂用量为3%时最高达到了41.34 MJ/kg。

Figure 3. Product yields and HHVs of bio-oil from HTL of proteins-lipids versus the dosage of HZSM-5
图3. 蛋白–脂类二元混合物水热液化所得产物产率和生物油热值随HZSM-5用量的变化
3.3. 二元模型混合物水热液化路径
为进一步理解催化剂对藻类主成分之间相互作用的影响,在多糖–蛋白、多糖–脂类、蛋白–脂类三种二元模型混合物的水热液化中,对HZSM-5催化制得的生物油进行了GC-MS表征,探讨了HZSM-5对生物油组成以及形成路径的影响。
3.3.1. 多糖-蛋白二元模型混合物水热液化路径分析
加入HZSM-5前后多糖–蛋白水热液化制得的生物油的GC-MS结果列于表2中。多糖–蛋白二元模型混合物水热液化制得的生物油主要含有含氮杂环化合物、环酮类、酚类、醇类以及酰胺类等物质。生物油中的含氮杂环化合物占据了较大的比重,被认为是多糖水解生成的还原糖和蛋白水解生成的氨基酸之间发生美拉德反应的产物。当加入HZSM-5催化剂后,生物油中的含氮化合物如吡嗪、吡咯以及吲哚等的含量出现了下降,这说明两种硅铝比不同的HZSM-5在不同程度上都抑制了美拉德反应从而提高了生物油的产率,且美拉德反应的抑制是使残渣产率有所提高的原因之一 [6] 。此外,生物油中的环酮类物质可被认为是多糖和蛋白质水热液化的共同产物,加入不同硅铝比的HZSM-5催化剂后,环酮类物质的含量出现了不同程度的下降 [17] 。由于加入酸催化剂以后会抑制多糖的水解产物糠醛或呋喃类物质水解生成酚类 [18] ,从而认为醇类和酚类物质是氨基酸脱氨基后生成的有机酸发生还原和环化反应形成的,加入HZSM-5 (Si/Al = 38)后比HZSM-5 (Si/Al = 50)更明显地促进了有机酸的还原反应从而促进了醇类和酚类物质的生成。

Table 2. Major compositions of bio-oils from HTL of polysaccharides-proteins before and after adding HZSM-5
表2. 加入HZSM-5前后多糖–蛋白二元模型混合物水热液化所得生物油的主要组成
“—”Not detected; w(HZSM-5) = 5%; Liquefaction temperature of 300˚C; Liquefaction time of 15 min.
3.3.2. 多糖-脂类二元模型混合物水热液化路径分析
对多糖–脂类二元模型混合物水热液化生成的生物油进行GC-MS分析,结果如表3所示。多糖–脂类水热液化生成的生物油只被检测到6-十八烯酸,亚油酸,软脂酸,亚油酸乙酯和软脂酸乙酯等脂肪酸和酯类物质,这些物质可初步被认为主要是脂类水热液化的产物。多糖水热液化的产物环酮类以及呋喃类,糠醛等物质没有被检测到。可能的原因是多糖和脂类按照1:1的质量比进行水热液化,而多糖水热液化所得的生物油产率较低,和脂类对生物油的贡献相比几乎可以忽略 [19] 。这也可以推测,在多糖含量少的藻类的水热液化过程中多糖对生物油的贡献可以忽略,主要考虑脂类对生物油的贡献。此外,多糖–脂类二元模型混合物水热液化的生物油中酯类物质含量比脂类单独水热液化生物油中的酯类物质含量明显增多,可认为是除了脂类水解生成酯类物质外,多糖经多步水解生成了醇类和酚类物质,醇类物质作为中间产物和脂肪酸发生酯化反应生成酯类物质。当加入HZSM-5催化剂后,不仅改变了生物油中各种脂肪酸的比例,而且促进了醇类和脂肪酸类物质间的酯化反应。

Table 3. Major compositions of bio-oils from HTL of polysaccharides-lipids before and after adding HZSM-5
表3. 加入HZSM-5前后多糖–脂类二元模型混合物水热液化所得生物油的主要组成
“—”Not detected; w(HZSM-5) = 5%; Liquefaction temperature of 220˚C; Liquefaction time of 15 min.
3.3.3. 蛋白-脂类二元模型混合物水热液化路径分析
蛋白–脂类在有无HZSM-5存在下水热液化所得生物油的GC-MS结果如表4所示。生物油中主要含有6-十八烯酸,亚油酸,软脂酸等脂肪酸类物质以及酯类物质,可初步被认为主要是脂类的水热液化产物。HZSM-5催化剂的加入改变了生物油中各种脂肪酸的比例,并且使脂肪酸的总含量下降。除此之外,还有少量的含氮物质被检测到,可认为是蛋白质水热液化的产物,添加HZSM-5催化剂后抑制了含氮化合物的生成,有利于脱氮反应。蛋白质和脂类按照1:1的质量比进行水热液化,所得产物依然主要是脂类水热液化的产物,这与蛋白和脂类单独水热液化的生物油产率结果一致 [17] 。生物油中含有的少量酰胺类物质应该是氨基酸的脱氨反应产物氨气和脂类水解产物脂肪酸发生酰胺化反应生成的,HZSM-5的加入促进了酰胺化反应的发生。

Table 4. Major compositions of bio-oils from HTL of proteins-lipids before and after adding HZSM-5
表4. 加入HZSM-5前后蛋白–脂类二元模型混合物水热液化所得生物油的主要组成
3.3.4. 二元模型混合物液化生物油的路径分析
HZSM-5存在下多糖–蛋白、多糖–脂类、蛋白–脂类的水热液化反应路径如图4所示。多糖–蛋白二元模型混合物在水热液化条件下发生的反应为多糖的水解产物还原糖和蛋白的水解产物氨基酸发生的美拉德反应,产物为多种含氮化合物。HZSM-5的加入抑制了美拉德反应,HZSM-5 (Si/Al = 50)的抑制作用比HZSM-5 (Si/Al = 38)更明显。多糖–脂类二元模型混合物在水热液化条件下以脂类的水解为主,也会发生物质间的相互反应,如酯化反应,HZSM-5的加入促进了多糖和脂类间的酯化反应。蛋白–脂类二元模型混合物在水热液化条件下以脂类的水解为主,也会发生物质间的相互反应,如酯化反应和酰胺化反应,HZSM-5的加入促进了这两类反应的发生。
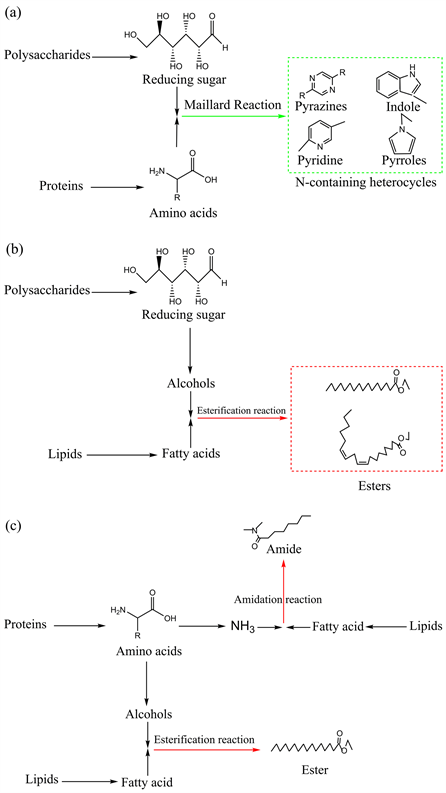
Figure 4. Pathways of polysaccharides-proteins (a), polysaccharides-lipids (b) and proteins-lipids (c) HTL in the presence of HZSM-5 (Red: the products promoted by HZSM-5; green: the products inhibited by HZSM-5)
图4. HZSM-5存在下多糖–蛋白(a)、多糖–脂类(b)、蛋白–脂类(c)的水热液化反应路径(红色:HZSM-5促进的产物;绿色:HZSM-5抑制的产物)
4. 结论
1) 对于多糖–蛋白二元模型混合物,多糖和蛋白的比例对其水热液化产物的分布和生物油热值有着重要的影响。蛋白含量越高,生物油产率就越高,受HZSM-5催化剂的影响也更明显。当液化温度为300℃,多糖含量为20%,HZSM-5用量为5%时生物油产率最高,为29.12%,而生物油热值在HZSM-5用量为7%时达到最高为31.2 MJ/kg。多糖–蛋白二元模型混合物水热液化所得生物油中的含氮化合物减少,证明HZSM-5催化剂在一定程度上抑制了美拉德反应。
2) 对于多糖–脂类二元模型混合物的水热液化,生物油的产率和热值在HZSM-5用量为7%时达到最高,分别为45.30%和40.69 MJ/kg。HZSM-5的加入促进了多糖和脂类间的酯化反应。
3) 对于蛋白–脂类二元模型混合物的水热液化,催化剂用量为5%时生物油产率的提高效果最明显,比不加催化剂时提高了10.90%,生物油热值最高达到了41.34 MJ/kg。HZSM-5的加入促进了蛋白和脂类间的酯化反应以及酰胺化反应。