1. 引言
具有血液相容性和内皮细胞相容性是心血管材料的两大功能需求,也是目前该领域的研究热点。释放一氧化氮的心血管材料能够抑制血小板的聚集和粘附 [1] ,研究表明NO能够通过cGMP途径抑制血小板活化 [2] ,提高材料的血液相容性。而对于释放NO材料的内皮细胞相容性,文献中出现了不同的研究结果 [3] [4] [5] 。Meenakshi Kushwaha等 [4] 制备了可释放NO的类细胞外基质涂层,发现具有涂层能够抑制血小板的粘附及平滑肌的增殖,并且能够促进内皮细胞的粘附与增殖。Bonnie L等 [5] 发现加入NO供体能够抑制由于精氨基琥珀酸合酶表达减少导致的内皮细胞凋亡。Katarzyna [6] 等发现低浓度的NO供体存在条件下,内皮细胞的粘附量明显增加。Shunichi Shimizu [7] 等人发现NO供体的加入显著降低了内皮细胞数量和生长速率。由于上述研究并未给出具体的NO释放速率且NO供体的类型和浓度各不相同,因此NO释放对内皮细胞的作用结果完全不同并且难以解释。由于上述研究中采用的是NO供体或供体型NO释放材料,这类材料带来往往伴随着NO突释,不具有持续稳定的NO释放速率,难以获得规律性的认识。本实验拟通过在氧化钛薄膜上沉积多巴胺并固定硒代胱氨酸,构建可持续性催化内源性供体释放NO的表面,研究一氧化氮释放对于内皮细胞行为的影响。
2. 实验部分
2.1. 材料和仪器
材料:硅片;人脐静脉内皮细胞株;蒸馏水、丙酮试剂为分析纯;多巴胺、硒代胱氨酸、NaOH;F12培养基、胎牛血清。
仪器:UBMS450 型高真空非平衡磁控溅射设备;ESCALB MK-IIX射线光电子能谱分析;DSA100 接触角测量仪;美国Sievers 280i型化学发光检测仪;Olympus荧光显微镜。
2.2. 材料表面沉积不同层数多巴胺薄膜固定硒代胱氨酸及其表征
利用 UBMS450 型高真空非平衡磁控溅射设备在硅片上溅射沉积TiO膜,将沉积TiO薄膜的硅片切为8 mm × 8 mm尺寸,样品标记为TiO。称取一定量多巴胺溶于浓度为1.2 mg/ml Tris溶液中,得到终浓度为2 mg/ml多巴胺溶液。将已清洗的TiO薄膜样品放入培养皿,多巴胺溶液倒入其中,室温下静置反应12 h。通过上述步骤沉积一次多巴胺记为一层多巴胺。分别重复3、5、8次,得3、5、8层多巴胺样品,将5层多巴胺样品标记为Dopa。将一定量硒代胱氨酸溶于6 mM的NaOH,得到终浓度为3 mM硒代胱氨酸溶液。将硒代胱氨酸溶液倒入已放入3、5、8层多巴胺样品的24孔板,室温下静置24 h,样品分别标记为3-Se、5-Se、8-Se。
通过XPS分析样品表面化学元素。通过躺滴法表征样品表面亲疏水性。通过NO释放分析材料催化释放NO能力。
2.3. 内皮细胞静态培养
将内皮细胞接种于细胞培养瓶中,在条件为37℃,5% CO2细胞孵箱中培养,当细胞的融合度为60%~80%左右可进行实验。将密度为2 × 104个/ml的细胞均匀种植于样品表面,NO释放实验组中另加入GSH及GSNO至其终浓度分别为130 uM及60 uM,在1 d时间点取出,用NaCl清洗样品表面,用2.5%戊二醛固定细胞24小时,清洗样品后在样品表面滴加罗丹明染色15分钟。
2.4. 内皮细胞迁移实验
将钛箔剪成1 × 3 cm大小,将其折叠成L型,将“L”的短臂置于24孔板底部,沉积多巴胺薄膜并固定硒代胱氨酸后,再由明显的多巴胺边缘折叠。实验时,首先将未改性的一臂置于24孔板底部并种植密度为2 × 104个/ml的内皮细胞,培养1天;然后移除培养基并将钛箔翻转,使其改性表面置于孔板底部,加入新鲜培养基,NO释放实验组另加入GSH及GSNO至其终浓度分别为130 uM及60 uM,继续培养1天后取出样品,NaCl清洗样品表面 ,并用2.5%戊二醛固定细胞过夜,清洗后滴加罗丹明染色15分钟。
3. 结果与讨论
3.1. 材料学表征
图1为各样品的XPS全谱图,从图中可以看出,固定硒代胱氨酸后,各样品均出现了Se3d峰,说明硒代胱氨酸固定成功。而通过计算,从表1可以看出硒的相对百分含量差距并不明显,5层多巴胺表面固定的硒代胱氨酸略多于3层与8层样品。
图2为各样品水接触角测量结果,TiO薄膜的水接触角大约为30˚左右,固定多巴胺后水接触角升高,这可能是由于沉积的多巴胺中含有疏水基团,如苯环等,暴露在TiO薄膜的表面,导致水接触角变大。固定硒代胱氨酸后,材料的亲疏水性并没有明显变化。
健康内皮细胞能够持续释放一氧化氮,其释放NO的速率为0.5 − 4 × 10−10 mol∙cm−2∙min−1 [8] 。硒代胱氨酸中的双硒键能催化NO从内源性NO供体中稳定释放 [9] 。图3为各样品催化释放NO速率,结果显示,三组样品NO释放速率均在健康内皮细胞释放速率范围内,5-Se样品催化释放NO速率(1.1 ± 0.1 × 10−10 mol∙cm−2∙min−1)明显高于3-Se样品(0.5 ± 0.1 × 10−10 mol∙cm−2∙min−1)以及8-se样品(0.5 ± 0.1 × 10−10 mol∙cm−2∙min−1),3-Se样品与8-Se样品基本相同,此结果与XPS得到的表面硒含量结果趋势一致,即5层聚多巴胺表面固定了较多的硒代胱氨酸而具有较大的催化释放NO的能力。
3.2. 内皮细胞静态培养结果
如图4所示为内皮细胞静态培养1 d结果图,从图4(a)可以看出,每组样品表面内皮细胞均能呈现了

Table 1. Content of Se Obtained via XPS of sample 3-Se, 5-Se and 8-Se Surfaces
表1. 各样品表面硒元素的相对含量

Figure 1. Wide-scan spectra XPS of samples
图1. 各样品的XPS全谱图

Figure 2. Water contact angle of samples (n ≥ 6, ***p < 0.001)
图2. 各样品的水接触角(n ≥ 6, ***p < 0.001)
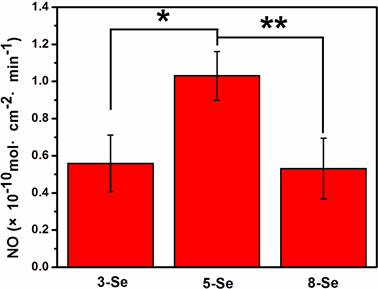
Figure 3. NO release catalyzed by samples from GSNO
图3. 样品催化GSNO释放NO速率
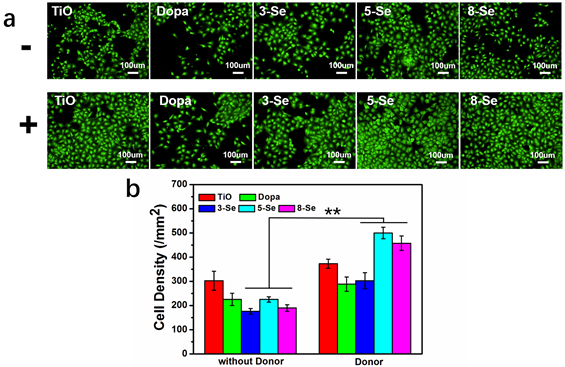
Figure 4. Evaluation of ECs’ adhesion and cell density on samples. (a) Fluorescent images of ECs adhesion on samples for 1 day without and with NO donor. The “−” represented without donor and the “+” represented with donor. (b) ECs’ density on samples for 1 day. (n = 4, **p < 0.05)
图4. 内皮细胞粘附及细胞密度评价。(a) 不同样品表面ECs在无供体和有供体条件下培养1d的荧光染色结果;“−”表示未添加NO供体,“+”表示添加NO供体;(b) 不同样品表面ECs培养1d的细胞密度统计(n = 4, **p < 0.05)
一种比较良好的铺展形态,而无论是否具有NO释放,Dopa样品表面的内皮细胞数量均少于其他样品表面,这可能是由于Dopa样品表面具有高反应性,能够与大多数蛋白质氨基酸残基中的氨基或巯基反应,并没有选择性的原因。在没有NO释放条件下,各组样品内皮细胞的粘附生长情况并无太大差异,但在TiO薄膜样品表面内皮细胞粘附的数量多于其他样品,说明TiO薄膜是一种生物相容性较为良好的材料。而在有内源性NO供体存在条件下,固定硒代胱氨酸样品表面的内皮细胞数量均大于TiO样品,呈现出铺路石状细胞形态,生长状况良好,这可能是因为样品催化释放NO,提高了内皮细胞的活性,使内皮细胞具有较强的粘附、生长能力。图4(b)内皮细胞1天的细胞密度统计结果进一步证实,NO的持续稳定释
放能够明显增加细胞粘附数量,并且趋势与NO释放速率一致。5-Se样品表面内皮细胞数量更多,这可能是因为5-Se样品表面催化释放NO的能力更强,说明在适宜的NO释放范围内,较大的NO释放速率有利于内皮细胞的粘附。
3.3. 内皮细胞迁移结果
图5为内皮细胞在各组样品上的迁移情况,细胞迁移是评价材料是否具有良好的细胞相容性和是否具有快速内皮化能力的重要指标。根据图5(a)内皮细胞迁移的荧光结果图来看,无NO供体组样品表面内皮细胞的迁移距离均低于有NO供体组样品。由于NO供体存在微弱的自分解能力,在无催化活性的TiO和Dopa样品表面也会有非常弱的NO释放(由于太弱,NO化学发光检测仪不能检测到),所以内皮细胞的迁移距离均大于未添加供体组。对于固定硒代胱氨酸样品,内皮细胞在表面迁移距离相比于未添加供体组增加更为显著,5-Se样品表面内皮细胞迁移距离最大。从图5(c)内皮细胞迁移范围内的细胞密度统计可以看出,未添加NO供体组,其表面内皮细胞密度均低于添加NO供体组样品表面细胞密度,同时,未添加供体组中,TiO薄膜样品表面的细胞密度大于固定硒代胱氨酸样品,但加入NO供体后,固定硒代胱氨酸样品表面内皮细胞数量大于TiO样品,这与内皮细胞静态培养的实验结果一致。本实验结果显示,适宜的NO释放速率能够促进内皮细胞的增殖和迁移,但是对NO促进内皮细胞迁移的机制尚不明确,需要进一步的实验和探索。
4. 结论
通过在TiO薄膜表面沉积聚多巴胺并固定硒代胱氨酸分子,制备了具有催化活性的新型心血管材料,其催化释放NO的速率与健康内皮细胞释放NO速率相当。在此范围内,较大的NO释放速率有利于内
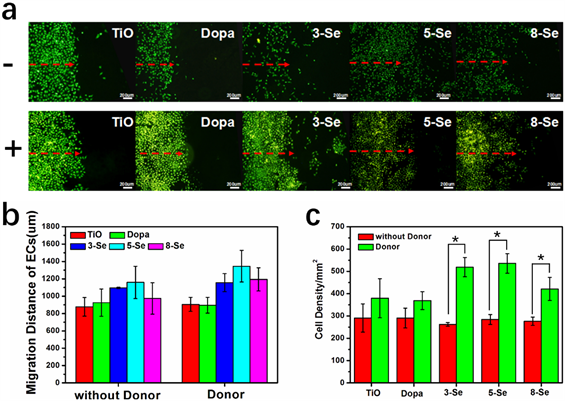
Figure 5. Evaluation of ECs migration on samples without and with NO donor. (a) Fluorescent images of ECs migration. The “−” represented without donor and the “+” represented with donor. (b) ECs migration distance measured. (c) ECs density measured. (n = 4, *p < 0.05)
图5. 在无供体和有供体条件下内皮细胞迁移的评价。(a) 不同样品表面ECs迁移的荧光图像。“−”表示未添加NO供体,“+”表示添加NO供体。(b) 内皮细胞迁移距离的结果统计图。(c) 内皮细胞迁移部分细胞密度的结果统计图(n = 4, *p < 0.05)
皮细胞的粘附生长及增殖,增强了内皮细胞的活性,有利于内皮细胞在材料表面的迁移。