1. 引言
Hg2+污染已经严重威胁了人类健康,中国是汞污染较严重的国家之一 [1] [2] 。汞具有很高的生物毒性,会破坏中枢神经系统,对口、粘膜和牙齿产生不良影响 [3] 。儿童长期暴露在汞环境下,会导致肾脏、肺毒性,皮疹和高血压。因此,建立安全、准确、高效的Hg2+检测机制,是当今社会面临的重大挑战。
Hg2+的传统检验方法主要为CV-AFS,CV-AAS,ICP-MS等,尽管这些方法具有较高的灵敏度,稳定性和选择性,但它们的实验设备复杂,样品预处理麻烦且消耗人力。DNA生物传感器的飞速发展,为Hg2+检测提供了新手段。Hg2+生物传感器主要是基于DNA序列中的T碱基与Hg2+形成特殊的T-Hg-T结构,这种结构很稳定,且对Hg2+有特异性。Bai等人 [4] 报道了一种基于G-四联体构型改变的无标记的信号降低型的荧光探针检测Hg2+。该方法的检出限达到了25 nM。Zhang课题组 [5] 提出了一种多功能的比色传感器检测金属离子(Pb2+,Cu2+和Hg2+),可同时检测三种金属离子。纳米材料具有特殊的光、电、磁、热、力学、机械等性能,已经在生物传感器中得到了有效地应用。Sener等人 [6] 设计了一种基于金胶的赖氨酸诱导的比色传感器检测Hg2+。利用赖氨酸与Hg2+的作用诱导金胶聚合,产生颜色变化,此方法可同时检测Hg2+和赖氨酸,对Hg2+的检出限可达2.9 nM。
基于当前Hg2+生物传感器存在的操作复杂,灵敏度较低等问题,我们将磁纳米颗粒引入到Hg2+生物传感器中,设计了一种分子内分裂式DNA酶传感器检测Hg2+ [7] ,但由于DNA酶的G四联体结构由同一寡聚核苷酸链的二端构成,无目标存在时也可能与捕获链非特异性结合产生信号造成误差,所以本文在上述基础上提出采用分子间分列式DNA酶为信号发生元件,以避免由此产生的假阳性,原理如图1所示。将富含T碱基的SA链通过生物素-亲和素的特异性结合连接到磁珠上(MNPs/SA)。SB和SC均为一端富含G碱基,而另一端富含T碱基的序列;富含T碱基部分用于与Hg2+特异性结合成T-Hg-T双链结构,富含G碱基部分用于组装成对称分裂式G-四联体。当有Hg2+存在时,SA和SB与SC上的T碱基与Hg2+结合形成T-Hg-T结构,SB和SC就组装到了磁纳米颗粒上(MNPs/SA/SB/SC),此时SB和SC上两段富含G碱基的片段相互靠近,培育后即形成G-四联体构型。Hemin是一种具有催化性能的卟啉化合物,当其与G-四联体共同培育后,就会形成类似辣根过氧化酶的特殊的DNA酶,即组装成G-四联体DNA酶。这种酶可以催化H2O2氧化ABTS的反应,生成浅绿色的ABTS+,利用紫外–可见分光光度计进行紫外吸收表征。由于我们的体系引入了磁纳米颗粒,使实验体系的背景信号大大降低;与不分裂式G-四联体体系相比,这种使用分裂式G-四联体的体系具有更低的背景和更好的检测灵活性。
2. 实验
2.1. 试剂和仪器
实验使用的核苷酸均从上海生工生物工程技术服务有限公司购得,其序列如(表1)所示。包裹链霉亲和素的磁珠(MNPs,直径为100 nm,德国Chemicell公司)。二甲亚砜(DMSO),30% H2O2,曲拉通X-100和卟啉铁(hemin)均从国药集团化学试剂有限公司购得(中国,上海)。三(羟甲基)氨基甲烷(Tris-HCl)和2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS),均从上海生工生物工程有限公司购得。4-羟乙基哌嗪乙磺酸(HEPES,加拿大Bio Basic公司)。牛血清蛋白(BSA,北京鼎国生物技术有限责任公司)。
Cary 50紫外–可见分光光度计(美国瓦里安公司),SHZ-C水浴恒温振荡器(上海博讯实业有限公司),
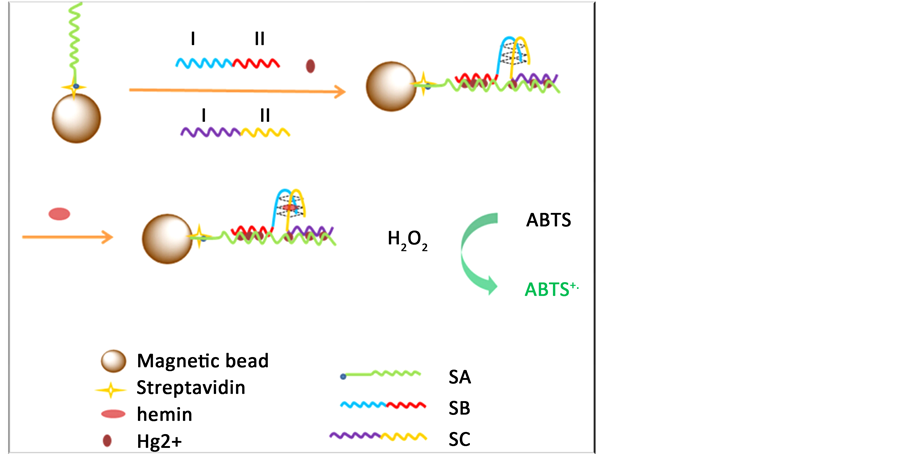
Figure 1. The schematic of the Hg2+-sensing assay.
图1. Hg2+传感器的设计原理图
JASCO J-815圆二色光谱仪(日本JASCO公司),漩涡混合仪,磁铁。
2.2. 磁纳米颗粒(MNPs)的修饰
取100 μLMNPs (10 mg/ml)放入离心管,向MNPs中加入100 μL (5 uM/L) biotin-SA4溶液,再加入100 μLSSC (柠檬酸钠)缓冲液,37℃水浴振荡条件下培育2 h,以使DNA短链组装到磁颗粒上。将反应后的溶液磁分离,使用清洗缓冲液(10 mMTris-Hac, 100 mMNaNO3, pH = 7.4)清洗三次除掉未连接的biotin-SA4后,4℃环境下用2%BSA溶液封闭1 h,以减少非特异性吸附,命名为MNPs/SA4待用。
2.3. Hg2+传感器对Hg2+的检测
取15 μL (5 umol/L)的SB4,15 μL (5 umol/L)的SC4,30 μL (5 mg/ml) MNPs-SA4,100 uL的Hg2+捕获缓冲液(20 mM Tris-Hac, 10 mM HEPES, 20 mM KAc, 10 mM Mg (NO3)2, pH = 8.0),125 μL (200 mmol/L) KAc和不同浓度的Hg2+混合,再加入2 × HEPES缓冲液使总的体积为500 uL。在37℃水浴环境振荡反应4 h,反应时使磁珠始终保持悬浮状态,反应后将组装后的磁颗粒复合物命名为MNPs/SA4/SB4/SC4。向上述制备好的复合物MNPs/SA4/SB4/SC4体系中加入5 μL (5 umol/L)hemin溶液,37℃水浴反应40分钟,以形成hemin嵌入式G-四联体DNA酶。磁分离上述混合液,用2 × HEPES缓冲液清洗3次,最后用2×HEPES缓冲液定容至440 μL待用。
2.4. Hg2+传感器的紫外–可见光谱和CD光谱检测
向制备好的DNA酶生物传感器所在溶液中加入50 μL (40 mmol/L) ABTS溶液和10 μL (59 umol/L) H2O2后催化反应迅速进行。我们选取波长为421 nm处的吸光度值作为测量值,且定义ΔA421nm = A421nm − A0,其中A421nm为421 nm处的实验测量值,A0为Hg2+浓度为0时的背景吸收值。
将10 μL (0.12 mmol/L) SA、10 μL (0.12 mmol/L) SB和10 μL (0.12 mmol/L) SC充分混匀,再加入80μLHg2+捕获缓冲液,然后置于90℃水浴中加热5 min以使序列自由展开,最后放在冰浴中慢慢冷却至室温。向该体系中加入8 nmol的Hg2+,25 uL (200 mmol/L) Kac,适量2 × HEPES缓冲液,37℃水浴条件下振荡反应4 h。最后加入hemin溶液,37℃水浴条件培育2 h以形成hemin嵌入式G-四联体DNA酶,培育后将该混合液定容至400 μL。CD光谱检测前先以缓冲液作基底溶液,光谱的波长范围是230 nm~320 nm,扫速为100 nm/min,频带宽度为2 nm,比色皿长度为1 mm,每个样品平行扫描3次求平均值。
3. 结果与讨论
3.1. Hg2+传感器组装情况的表征
我们设计的Hg2+生物传感器是基于该传感器能够形成G-四联体DNA酶,可以催化H2O2氧化ABTS的反应 [8] [9] 。为了验证该实验机理,我们使用紫外–可见分光光度计测试了hemin,MNPs-SA4和MNP-SA4/SB4/SC4/henin复合物存在和不存在Hg2+的情况下,ABTS-H2O2体系的紫外吸收光谱,结果如图2所示。曲线a为基底物质ABTS的吸收曲线。b为MNPs/SA4复合物催化ABTS后的吸收曲线,由图可知,MNPs/SA4复合物对ABTS具有很低的催化活性,几乎可以忽略。Hemin的催化曲线如图c所示,虽然hemin本身对H2O2氧化ABTS的反应具有一定的催化效应,但是游离的hemin在洗涤的过程中被除去,因此它的催化活性也非常的低。在MNP-SA4/SB4/SC4/henin复合物中,当没有Hg2+存在时,MNP-SA4不能利用Hg2+捕获SB4和SC4,它们以游离的形态存在溶液中,不能形成DNA酶,hemin会通过清洗过程被除去,所以催化效果并不理想,其催化曲线如图d所示。但当体系中存在Hg2+时,MNPs/SA4通过结合Hg2+形成T-Hg-T结构成功捕获SB4和SC4,经过培育后SB4和SC4中富含G碱基部分将形成G-四联体DNA酶,催化H2O2氧化ABTS反应的进行,催化结果如曲线e所示,在421nm处吸收峰急剧增大。依据我们的设计思想,只有当Hg2+存在时,MNPs/SA4才能成功捕获SB4和SC4,G-四联体DNA酶才能形成,随即发生ABTS的氧化反应,从曲线e中ΔA421nm值比较理想。可以推测,该体系形成了G-四联体DNA酶,表明我们成功组装了G-四联体DNA酶Hg2+生物传感器。
为了进一步验证只有在Hg2+存在时,体系才能形成G-四联体DNA酶,在没有Hg2+时,游离形态的
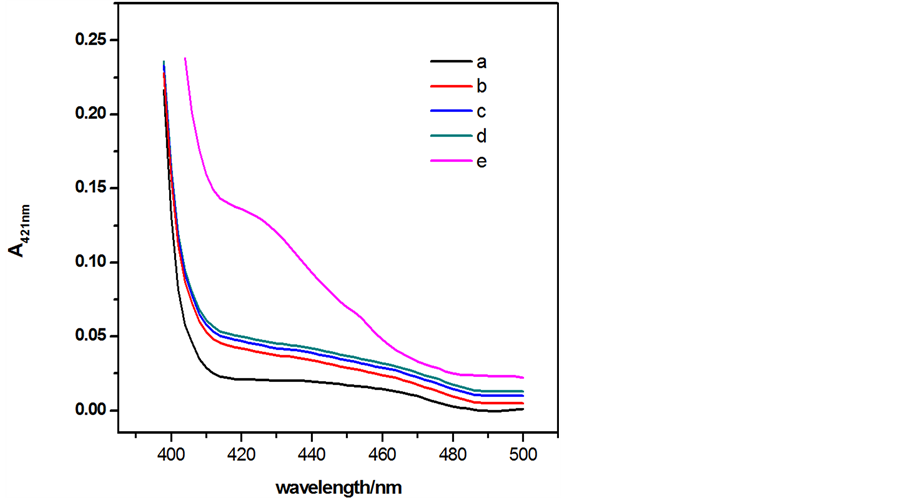 其中(a) ABTS,(b) MNPs-SA4,(c) hemin,(d) MNPs-SA4、SB4、SC4和hemin的混合物,(e) MNPs-SA4、SB4、SC4、hemin和Hg2+的混合物。实验条件:[ABTS] = 4 mM,[H2O2] = 1.2 μM,[Hg2+] = 100 nM,[hemin] = 50nM,[MNPs-SA4] = 150 μg,[SB4] = 150 nM,and [SC4] = 150 nM
其中(a) ABTS,(b) MNPs-SA4,(c) hemin,(d) MNPs-SA4、SB4、SC4和hemin的混合物,(e) MNPs-SA4、SB4、SC4、hemin和Hg2+的混合物。实验条件:[ABTS] = 4 mM,[H2O2] = 1.2 μM,[Hg2+] = 100 nM,[hemin] = 50nM,[MNPs-SA4] = 150 μg,[SB4] = 150 nM,and [SC4] = 150 nM
Figure 2. Ultraviolet absorption curve of different components
图2. 不同组分存在时Hg2+传感器的紫外吸收曲线
SB和SC不会形成G-四联体,否则这将导致高的背景和错误的响应。为此,我们设计了四组不同序列和长度的SA,SB,SC,以确保只有当Hg2+存在时,才能形成G-四联体DNA酶。设计的四组链中,同组SB和SC链长度相等。其中SA1和SA2为16个碱基,链最短,SA4其次,为20个碱基,SA3链最长,为24个碱基。而第2组和第4组中SA与SB和SC的G-C碱基互补率为50%,第1组和第3组分别为62.5%和66.7%,结果见图3。由图可知,1、2、3组中无目标时的吸光度均大于有目标存在时的吸光度,这是由于SA和SB及SC因互补的碱基数量较多(1、3组)和链较短(1、2组),在hemin的存在下部分形成具有催化活性的酶,使吸光度信号有所增加,当有Hg2+存在时,这不稳定的G-四联体结构发生改变,导致吸光度下降。第4组中由于所选用的链长与SA和SB及SC中的G-C碱基互补程度合适,获得了设计所需的结果。这说明所选的链长度与互补性在传感器的检测准确度与灵敏度方面均有重要的影响。因此,试验中选用第4组的序列作为传感器的目标捕获和信号发生的寡聚核苷酸链。
为了更好地说明要成功构建G-四联体DNA酶生物传感器取决于SA,SB,SC链的碱基序列和长度,我们利用CD光谱法对分裂式G-四联体的构型进行了表征(如图4所示)。如图4(C)可知,SA,SB,SC混合物在有无Hg2+存在时,在260 nm处出现正峰,240 nm处出现负峰,说明体系中出现了平行的G-四联体结构 [10] [11] 。第1、2和4组的CD光谱图与第3组完全不同,它们分别在260 nm和290 nm处出现了两个正峰,在240 nm出现负峰,属于平行和反平行结构混合物 [12] 。第1、2组中当有Hg2+存在时,峰强度反而弱一些,可能是因为Hg2+的存在使SA/SB/SC聚合物分解了,其催化活性更弱。仅第4组在有Hg2+时,CD光谱峰的强度明显增高,说明形成了稳定的具有催化活性的G-四联体DNA酶。CD实验结果与前面的光度实验结果相吻合。
3.2. 实验条件的优化
为了获得最好的实验结果,我们对实验的最佳条件进行了摸索。Hg2+捕获时间是影响Hg2+传感器性能
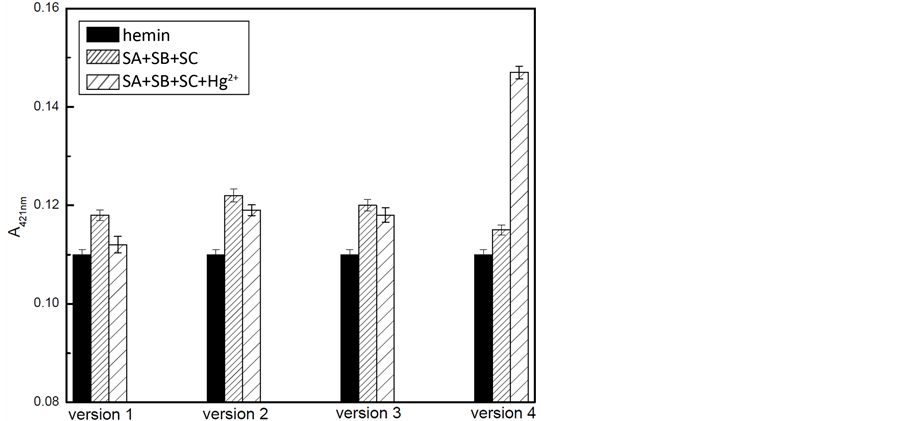
Figure 3. The ultraviolet absorption signals of hemin (black bars) and SA+SB+SC in the absence (dense bars) or presence (sparse bars) of Hg2+ with four groups of different sequences.
图3. 四组不同序列组成的SA、SB和SC对Hg2+检测的影响,其紫外吸光度对比图:hemin (黑色),SA+SB+SC (浓密), SA+SB+SC+Hg2+ (稀疏)。实验条件:[ABTS] = 4 mM, [H2O2] = 1.2 μM, [hemin] = 50 nM, [Hg2+] = 100 nM,[SA] = 150 nM,[SB] = 150 nM,and [SC] = 150 nM
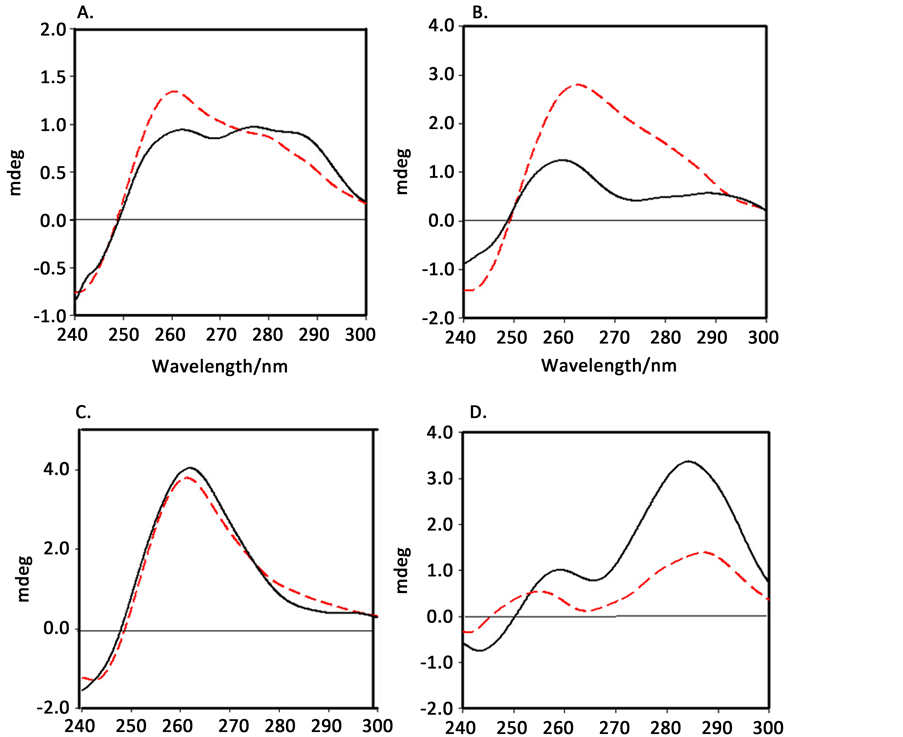
Figure 4. The CD spectra of system. SA1/SB1/SC1 (A), system SA2/SB2/SC2 (B), system SA3/SB3/SC3 (C) and system SA4/SB4/SC4 (D) in the absence (red dashed lines) and presence of Hg2+ ions (black solid curves)
图4. 不同体系下的CD光谱图。SA1/SB1/SC1 (A),SA2/SB2/SC2 (B),SA3/SB3/SC3 (C) and SA4/SB4/SC4(D)体系在有Hg2+(黑色实线)和没有Hg2+(红色虚线)条件下的CD图。实验条件:[SA] = 3 μM,[SB] = 3 μM,[SC] = 3 μM and [Hg2+] = 20 Μm
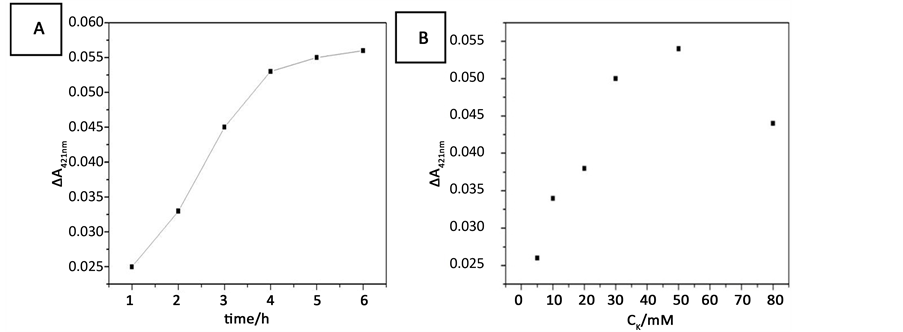
Figure 5. (A) Influence of the Hg2+ capture time on the ΔA421nm of the sensing system in the presence of Hg2+. (B) Influence of the concentration of K+ on the ΔA421nm of the sensing system
图5. (A) Hg2+捕获时间对ΔA421nm值的影响,(B) K+浓度对ΔA421nm值的影响。实验条件:[SB4] = 150 nM,[SC4] = 150 nM,[Hg2+] = 100 nM,[hemin] = 50 nM,[ABTS] = 4 mM;and [H2O2] = 1.2 μM
的重要因素之一,实验得到的Hg2+捕获时间结果如图5(A)所示。随着捕获时间的延长(从1 h至4 h),ΔA421nm值是逐渐增大的,4 h后反应时间再延长,ΔA421nm值的增大趋势极缓慢,故我们选择4 h作为该Hg2+传感器的捕获时间。本实验与其他检测Hg2+实验相比 [13] ,捕获时间较长,可能是因为用磁颗粒作载体时存在一定的空间位阻,导致反应时间的延长。
K+是构成稳定的G-四联体DNA酶的重要条件 [14] ,适当的K+浓度是Hg2+传感器构建的基础。我们依据构建的Hg2+传感器的催化性能对K+浓度进行了选择优化,结果如图5(B)所示。当体系中的K+浓度从5 mM增加到50 mM时,该体系的ΔA421nm值逐渐增大并达到最大值,随后再增加K+,其吸光度值反而急剧下降。说明K+浓度较低时,SB4和SC4形成的G-四联体结构不稳定,随着K+的不断加入,极大地提高了G-四联体的稳定性;当体系中的K+浓度过高时,溶液中较强的离子强度可能使DNA的活性受到了影响,导致DNA酶的活性有所降低。所以该传感器的最佳K+浓度为50 mM。
3.3. Hg2+选择性实验
Hg2+传感器对共存金属离子的抗干扰能力也是该体系研究的重要内容。由于实际水样的成分极其复杂,往往是多种金属离子同时存在,Hg2+的检测可能会受到如Ni2+,Co2+,Cd2+或Pb2+的干扰,但是我们的传感器是由分子间分裂式G-四联体DNA酶构成的 [15] ,只有当Hg2+存在时,才能形成T-Hg-T结构,使SB和SC中富含G碱基部分相互靠近形成DNA酶,从而减弱了Pb2+带来的干扰,提高了Hg2+的选择性。我们选择了12种共存离子进行研究,其紫外吸收强度如图6所示。向Hg2+ (25nM)所在体系加入2.5 μM共存离子后,测得的ΔA421nm值与Hg2+单独存在时相差不大。这说明即使共存离子浓度与Hg2+浓度的比值为100:1时,我们设计的传感器对Hg2+的检测仍旧灵敏,证明了该方案可以特异性的检测目标物Hg2+。
3.4. Hg2+的定量检测
我们还就传感器对不同浓度的Hg2+响应情况进行了研究,结果如图7所示。随着Hg2+浓度的增加,ΔA421nm值逐渐增大,在2 nM~50 nM之间呈现良好的线性,线性方程为ΔA421nm = 9.17 × 10−3 + 6.26 × 10−4cHg2+ (nM),相关系数R2为0.9890,检测限为0.8 nM,说明这种分裂式G-四联体DNA酶传感器能够
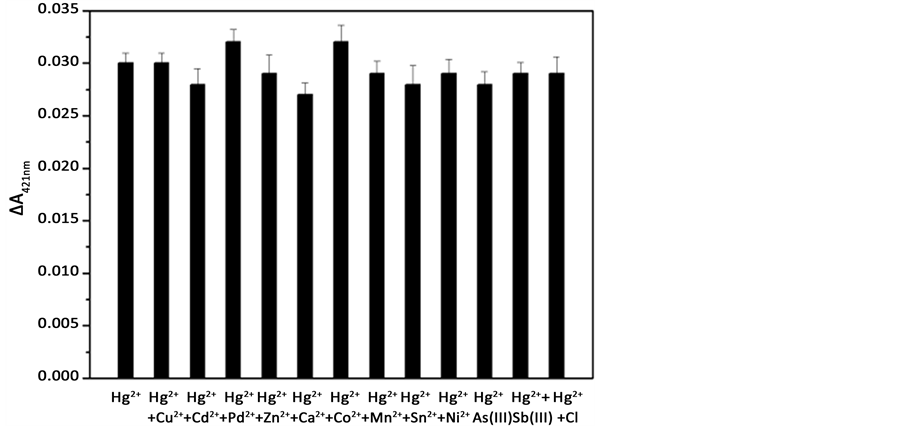
Figure 6. The selectivity of the Hg2+-sensing assay in the presence of 25 nM Hg2+ and 2.5 μM other ions, while the concentration of Cl− is 0.25 mM
图6. Hg2+传感器的选择性,柱状图表示25 nM Hg2+和2.5 uM其他共存离子(Cl−浓度为0.25 mM)同时存在的紫外吸光度值
定量检测Hg2+。该体系Hg2+的检出限为0.8 nM,说明我们设计的传感器能够识别低浓度的Hg2+,远远低于标准饮用水中对Hg2+含量的限制(10 nM)。
3.5. 传感器对实际样品的检测
为了证明该Hg2+传感器能够应用于实际样本的检测,我们选择了三种水样(自来水,河水和工业废水)进行了评价,结果如表2所示。经过实验分析,自来水和河水中没有发现Hg2+,说明可能Hg2+含量很低,而工业废水中约有4.6 nMHg2+。为了进一步证实该方法的可靠性,我们引入加标回收实验法 [16] 。通过加标回收得到的回收率范围为95.0%~106.0%,回收率在可靠范围内,说明我们设计的传感器可以检测实际水体样品中的Hg2+。
4. 结论
文章报道了一种分子间分裂式的G-四联体DNA酶生物传感器用于Hg2+的比色检测。该方法简便易行,合成周期短。磁纳米颗粒的使用,使得酶体系可以更好的分离,有利于降低背景信号,且磁分离后捕获的Hg2+可以收集处理,避免了二次污染。本文由两段分离的富含G碱基的序列组成分裂式G-四联体DNA酶,在文中,我们讨论了链的长度及碱基序列等影响DNA酶活性的关键因素,由此可知,分子间
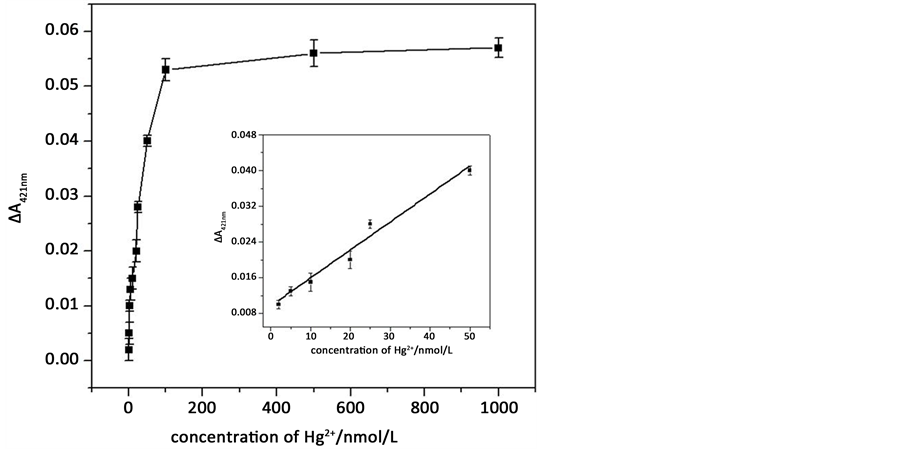
Figure 7. The calibration curve corresponding to the ΔA421nm of the Hg2+ sensing assay with different Hg2+ concentrations, inset shows the linear responses of Hg2+ concentration from 2 - 50 nM.
图7. Hg2+浓度在0.8 nmol/L~1 umol/L范围内的校准曲线,插图为汞离子浓度在2~50nM之间的线性图

Table 2. Results of the actual samples*
表2. 实际水样的检测结果*
*表中数据为3次平行测定结果的平均值。
G-四联体酶的活性受其DNA链序列的严重影响,若SA与SB和SC碱基互补过多,则不能形成生物传感器。此分子间的G-四联体DNA酶生物传感器其灵敏度更高,检出限达到了0.8 nM,而且即使其他金属共存离子浓度和氯离子浓度是Hg2+浓度的100倍或10,000倍,该传感器对Hg2+仍有很好的响应。基于此,我们的Hg2+检测传感器有望在今后的水环境监测体系中得到有效地应用。与我们实验室以前设计的Hg2+传感器相比较 [17] ,具有背景信号低、Hg2+易收集处理、特异性好、可再生等共同的优点以外,Hg2+检出限达到0.8 nM,灵敏度有明显提高。