摘要: 本研究采用升流式填充床厌氧反应器,考察温度变化对反应器处理高硫酸盐废水性能的影响。结果表明,在COD/SO
42-为1和HRT为16 h的实验条件下,当反应器温度为30℃时,硫酸盐和有机物均得到高效去除,分别达到98.60%和89.01%,当温度降低到10℃时,硫酸盐和有机物去除率大幅度下降,最低降至41.45%和39.93%。温度的降低导致胞外聚合物(EPS)中多糖(PS)和蛋白质(PN)含量同步增加,由于葡萄糖作为碳源能够促进微生物分泌更多的胞外酶,从而导致EPS中的PN含量大于PS含量。
Abstract:
The effect of temperature changes on the pollution removal performance was investigated with an upflow packed bed anaerobic reactor in treating high sulfate wastewater in this study. The results showed that under the experimental conditions: COD/SO42- ratio of 1, HRT of 16 hours and reactor temperature of 30˚C, both sulfate and organic matter were efficiently removed, reaching 98.60% and 89.01%, respectively. When the temperature drops to 10˚C, the removal rates of sulfate and organic matter significantly decrease, with the lowest dropping to 41.45% and 39.93%. The decrease in temperature could lead to a synchronous increase in the content of polysaccharides (PS) and proteins (PN) in extracellular polymers (EPS). Due to glucose serving as a carbon source, it could promote the secretion of more extracellular enzymes by microorganisms, resulting in a higher PN content than PS content in EPS.
1. 引言
硫酸盐是工业生产的一种重要原料,制药、造纸、铸造、食品、煤矿、化工等工业生产废水往往含较高浓度的硫酸盐 [1] [2] ,硫酸盐过高会引起水体盐度增加、管道腐蚀和恶臭气体(H2S)产生等一系列的环境问题 [3] [4] 。常用的硫酸盐的去除方法有钡盐沉淀,膜过滤和生物法。其中生物法脱除硫酸盐被认为是一种经济有效的方法,其主要是在厌氧条件下,通过硫酸盐还原菌(SRB)将硫酸盐还原成硫化物而去除。
通常采用的反应器有上流式厌氧污泥床反应器、膨胀颗粒污泥床膜反应器 、厌氧流化床反应器水平流动厌氧反应器以及填充床厌氧反应器等 [5] [6] 。与其它反应器相比,填充床反应器具有较高的容积负荷和较强的抵抗冲击能力 [7] 。
温度是微生物的代谢活性及其反应器去除性能的关键因素。根据SRB对生长温度的需求 [8] ,将SRB划分为嗜热菌、中温菌两种,嗜热SRB的最佳生长温度为54~70℃,最高可达56~85℃,SRB单纯培养的最适合的温度约为30℃。关于低温对SRB性能影响的研究鲜见报道。
本文采用升流式填充床厌氧反应器来探究温度变化对SRB硫酸盐废水的影响,同时对系统反应过程中EPS构成及变化特征进行分析和探讨。
2. 试验材料与方法
2.1. 试验装置
反应器采用有机玻璃制作,尺寸为Φ12 cm × 70 cm,有效容积4.0升。反应器内部填充生物填料(填充率80%)作为微生物的附着载体,反应器采取底部进水,顶部出水的方式,底部排气孔深入碱性溶液中,通过水浴锅和循环泵对反应器进行温度控制。实验装置如图1所示。
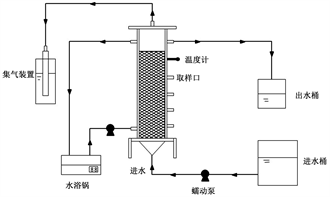
Figure 1. Schematic of the experimental device
图1. 试验装置示意图
2.2. 进水水质
实验用水为人工配置的模拟废水,微量元素液组成(mg/L):MgCl2∙6H2O 400 mg、CaCl2∙2H2O 15mg、KCL 300 mg、FeCl2∙4H2O 2 mg、CoCl2∙6H2O 0.17 mg、ZnCl2 0.07 mg、H2BO3 0.06 mg、MnCl2∙4H2O 0.5 mg、NiCl2∙6H2O 0.04 mg、CuCl2∙2H2O 0.027 mg。
以葡萄糖为碳源,控制COD/
比为1,HRT为16 h,通过水浴控制反应器的温度在10~30之间,考察厌氧反应器运行的效果,
2.3. 分析方法
(1) 常规指标测定方法:COD、
采用国家标准方法来测定,分析的方法分别是重铬酸钾法和硫酸钡沉淀法。
(2) EPS提取与测定方法:EPS提取的步骤如下:
① 从反应器中取出的生物填料通过加入适量的蒸馏水然后用玻璃棒搅拌使生物膜从填料上脱落;②将脱落的生物膜混合液稀释至30 ml,采用离心机以3000 g转速离心15 min,去除上清液;③ 将预热到70℃的蒸馏水添加至30 ml,漩涡使其均匀,并马上在6000 g转速下离心10 min;④ 使用0.45 μm滤膜进行过滤后,取过离心过的滤液,并测定疏松型胞外聚合物(LB-EPS);⑤ 将离心过滤后的残留物再倒入离心管中,并且稀释到30 ml且漩涡均匀,在80℃的恒温水浴锅中持续加热30 min,然后在6000 g下离心15 min;⑥ 再次通过0.45 μm滤膜进行过滤,滤液用来测定紧密型胞外聚合物(TB-EPS)。通过测试生物膜EPS中蛋白质和多糖的含量来反映生物膜EPS含量,多糖类物质的含量采用蒽酮比色法测定,而蛋白质含量使用Lowry法测定。
3. 实验结果与讨论
3.1. 硫酸盐去除
不同的温度梯度下硫酸盐去除由图2所示。可以看出,硫酸盐的去除率随温度的降低而降低,温度为30℃时(0~26 d)硫酸盐去除率保持在基本稳定在85%以上,硫酸盐的去除率达到最大值98.60%。说明温度为30℃时对系统效率有一定的促进作用,SRB菌体生长的越好。
随着温度降低,硫酸盐的去除率逐渐降低,温度变化到20℃和10℃时,硫酸盐的平均去除率分别为78.49%和61.57%,说明温度对SRB抑制作用较为明显。温度为10℃时,第52 d~68 d内硫酸盐的去除率依然较高,但是从第69~70 d开始,硫酸盐的去除率发生大幅度降低,到第78 d时,硫酸盐的去除率降到最低值41.45%。分析认为低温环境中硫酸盐的去除率降低的主要原因在于:(1) 低温环境容易使细胞质壁分离而解体,从而影响微生物的新陈代谢能力;(2) 在低温条件下生物还原作用减弱,微生物活性降低。戴宏义等 [9] 在研究温度对SRB处理煤矿酸性废水的影响,试验表明在10℃和30℃温度下SRB对硫酸盐的最大去除率分别为31.7%和91.7%,硫酸盐去除效果低于本实验结果,主要在于本反应器内填充生物填料,提高了生物附着能力和生物量,因此反应器具有更强的耐低温性能。
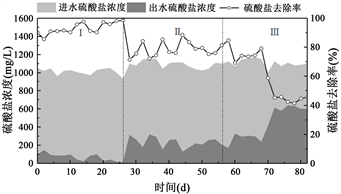
Figure 2. Sulfate removal at different temperature
图2. 不同温度条件下
去除特性
3.2. 有机物去除
图3显示在不同温度下有机物的去除特性,可以发现随着温度的不断降低有机物的去除率整体呈现持续下降的趋势。温度30℃时COD的去除率变化较为平缓,整体效果较高且稳定,在本阶段第16 d时,系统内COD的去除率达到最大值89.01%。而随着温度降低,COD的去除率逐步下降,当温度下降至20℃和10℃时,COD的平均去除率分别下降至67.88%和46.26%,COD的去除率在第64 d达到最低值39.93%。结果表明,低温对有机物的去除有较大的抑制作用,但由于填料床反应器中的生物量较大,系统对COD的去除仍然会有一定效果。同时Zhang J [10] 等人在利用微生物电化学系统处理偶氮染料的研究中表明温度为30℃时COD的去除效率也达到最大值。在填料床反应器内,SRB利用有机物作(COD)为电子供体把硫酸盐转化为硫化物,从而实现有机物和硫酸盐的同步去除。因此温度对COD去除和硫酸盐去除呈现相同的变化趋势。
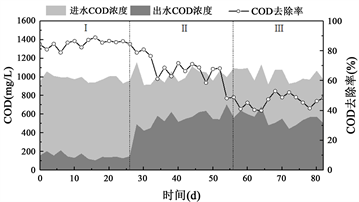
Figure 3. COD removal efficiency at different temperature
图3. 不同温度条件下系统COD去除效率
3.3. EPS变化特征
不同温度下的总EPS、蛋白质(PN)和多糖(PS)的变化情况如图4所示。EPS的来源主要有:微生物细胞新陈代谢过程中会产生大量的EPS,废水中也存有一些PS和PN,以及微生物细胞自溶作用。可以看出,EPS浓度(多糖 + 蛋白)随着温度的降低而升高,三个温度条件下对应的EPS浓度分别为117.07、213.71、308.35 mg/gVss。在温度从30℃降低到10℃过程中,EPS浓度增加十分明显,提升幅度在94.64~96.64 mg/gVss。进一步分析发现,在温度变化的各个阶段,TB-EPS的浓度总是大于LB-EPS的浓度,且在30℃、20℃和10℃温度下的总浓度分别为99.49、178.10和244.04 mg/gVss,可以判断TB-EPS是EPS的重要组成部分。分析认为温度下降引起EPS中PN和PS含量增加的原因在于 [11] :一方面可能是环境中温度的降低导致细胞的解体并释放出大分子物质(如胞内蛋白和多糖),最终可能导致细胞死亡并释放出胞内聚合物,一方面也可能是由于在低温环境中微生物的增殖速率会降低,当微生物细胞出现自溶现象时会释放出大量的胞内聚合物。
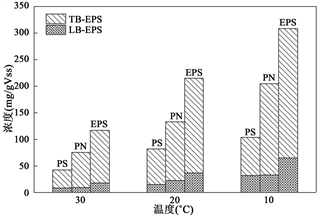
Figure 4. Changes in EPS、PS and PN concentrations under different temperature
图4. 不同温度下EPS、PS和PN浓度的变化
由图4发现,蛋白浓度(PN)随着温度的降低也有一定的增加,整体的增长幅度较明显。当温度为30℃时系统内的蛋白浓度为75.31 mg/gVSS,然而随着温度降低到10℃时,系统内的蛋白浓度增加到172.37 mg/gVSS。多糖浓度的变化趋势与蛋白相似,也随温度的降低呈增长的趋势,但是多糖的增长幅度低于蛋白质,当温度为30℃时系统内多糖的浓度为41.76 mg/gVSS,着温度降低到10℃时,系统内多糖的浓度增加到71.67 mg/gVSS。比较发现,在不同温度下,PN的浓度总是大于PS的浓度。研究也表明 [12] 污泥的来源对EPS的组分有重要影响,通常厌氧污泥的主要成分是蛋白质,而好氧污泥的主要成分是多糖。此外,由于一些有机物(如葡萄糖、乙酸钠等)具有易降解和易吸收的特性,因而在反应系统内能够促进微生物分泌更多的胞外酶 [13] ,而大量的胞外酶导致EPS中的PN含量大于PS含量 [14] 。
3.4. 结论
本文主要研究了进水温度对填料床生物反应器对硫酸盐、有机物去除性能及EPS产生及构成的影响,主要研究结论如下:
1) 温度对SRB活性影响较大,当温度从30℃下降至10℃时,系统对硫酸盐和有机物去除效率呈现相似的变化趋势,均出现较大幅度的下降,但填料床生物反应器具有一定的抗低温特性,最低硫酸盐和有机物去除率约为40%左右。
2) 温度也是影响反应器内EPS含量及其组成的一个重要因素,反应器内污泥中的EPS以及EPS的组成成分PN和PS的含量均随着温度的降低而增加,微生物在低温环境中的增殖速率会降低,微生物细胞出现自溶现象,从而释放出大量的胞外聚合物,这是引起EPS增加的主要原因。葡萄糖具有易降解和易吸收的特性,在反应系统内能够促进微生物分泌更多的胞外酶,从而导致EPS中的PN含量大于PS含量。
3) 填料床生物反应器具有一定的耐低温特性,为低温条件下生物法去除硫酸盐提供一种新思路。
基金项目
中央高校基本科研业务费专项资金(2019XKQYMS79)。
NOTES
*第一作者。