1. 前言
我国是胃癌高发国家,最新统计显示全球40%以上的胃癌新发病例和死亡病例均发生在我国 [1] ,卫生和经济负担较为沉重。胃癌的预后与诊断时的疾病分期高度相关,分期越早,5年的生存率就越高,而进展期胃癌的5年总生存率低于30% [2] [3] 。
多个指南及共识意见均指出慢性幽门螺杆菌(Hp)感染引起的胃粘膜萎缩和(或)肠化是发生肠型胃癌的高危背景黏膜 [2] [4] [5] 。最近一项研究 [6] 发现198例严重Hp感染患者平均随访时间为7.77 ± 2.78年,分别有16%和70.3%发展为广泛性萎缩和广泛性肠化,胃肿瘤病变的年发病率总计为0.46%,早期胃癌为0.08%,晚期胃癌为0.02%。因此早期识别及监测胃癌高危背景黏膜有助于发现早期胃癌及癌前病变,是降低胃癌死亡率、改善患者预后的关键。
基于白光内镜检查的木村–竹本分类 [7] 根据内镜下胃黏膜萎缩的范围和程度可以快速评估高危背景黏膜,进一步预测早期胃癌发生的风险,OLGA分期 [8] 和OLGIM分期 [9] 通过病理评估胃窦、胃角和胃体萎缩、肠化生的程度,进一步分为0~IV期,为早期胃癌风险的评估提供更为直观的信息。三种评估方式均能在不同角度通过对萎缩、肠化等高危背景黏膜进行识别,进而评估个体发生早期胃癌的风险。但三种评估方式目前缺乏对比与整合,本研究旨在分析比较三种评估方式对胃高危背景黏膜发生早期胃癌风险的诊断效能,以期为早期胃癌高危人群识别和分层管理提供参考。
2. 资料与方法
2.1. 研究对象
选取2022年8月至2023年8月在青岛大学附属医院内镜中心行胃镜检查并依据新悉尼分类规范化活检取材的患者为研究对象进行回顾性分析,采用病例对照研究设计,将胃镜活检病理或行内镜黏膜下剥离术(ESD)术后病理证实为早期胃癌的120例患者作为胃癌组,按性别与年龄1:2匹配240例非胃癌组患者作为对照组。排除标准:1、临床资料、内镜资料、病理资料不全者;2、既往因胃部肿瘤接受过胃部手术者。
本研究得到了青岛大学附属医院伦理委员会批准(伦理编号QYFY WZLL 28244)。
2.2. 检查及风险评估
2.2.1. 一般临床资料
收集患者有无一级亲属胃癌家族史、有无吸烟史、有无饮酒史和幽门螺旋杆菌感染状态(13C呼气试验或病理组织学证实Hp阳性的判定为Hp现症感染)等一般临床资料。
2.2.2. 内镜检查与评估方法
木村–竹本分类法 [7] 判定白光内镜下胃萎缩的范围和程度,分为闭合型(C型)和开放型(O型),C1:萎缩界限仅在胃窦部,C2:萎缩界限刚超过胃角,限于胃体小弯侧下部,C3:萎缩界限越过胃角且接近贲门,O1:萎缩界限刚至贲门,O2:萎缩界限遍及整个胃底,O3:萎缩界限延伸至胃体大弯侧乃至全胃,进一步分为无或轻度萎缩(C0, C1, C2)、中度萎缩(C3和O1)和重度萎缩(O2和O3)。
2.2.3. 组织学检查与评估方法
根据胃炎新悉尼系统标准 [10] ,分别从胃窦部(2块)、胃角(1块)、胃体部(2块)及对其他胃内可疑病变部位活检取材,由2名经验丰富的高年资病理医师进行HE染色切片判读Hp、萎缩、肠化的组织学变化,分成无、轻、中和重度4级,分别按OLGA分期与OLGIM分期进行0~IV期分期(表1、表2),并参考文献 [11] 进一步进行胃癌风险分层:低危组(0期、I期、II期)和高危组(III期、IV期)。
2.3. 统计学方法
应用SPSS 26.0软件进行数据分析。服从正态分布的连续变量以均数±标准差表示,采用t检验,分

Table 1. Operative link for gastritis assessment
表1. OLGA分期

Table 2. Operative link on gastric intestinal metaplasia assessment
表2. OLGIM分期
类变量以例(%)表示,使用χ2检验。绘制不同评估方式预测早期胃癌风险的ROC曲线,以ROC曲线下面积(AUC)评估不同方式的诊断效能,AUC大于0.75则认为诊断价值较高。使用Kappa一致性检验(Kappa < 0.4为一致性差;0.4~0.7为一致性中等,>0.7为一致性好)评估不同评估方式预测早期胃癌风险的一致性;多因素logistic回归分析与早期胃癌风险相关的独立危险因素,P < 0.05被认为具有统计学差异。
3. 结果
3.1. 两组患者一般临床资料分析
早期胃癌组患者病理组织学类型均是分化好的早期胃癌(包括高级别上皮内瘤变),平均年龄62.68 ± 7.54岁,其中男性80人,女性40人。对照组平均年龄62.13 ± 6.55岁,其中男性150人,女性90人,两组患者性别、年龄无统计学差异(P > 0.05),具有可比性。两组患者有吸烟史、有饮酒史、有胃癌家族史及幽门螺杆菌现症感染差异具有统计学意义(P < 0.05)。详情见表3。

Table 3. General clinical data analysis [(Mean ± SD), N(100%)]
表3. 两组患者一般临床资料分析[(Mean ± SD), N(100%)]
3.2. 不同评估方式的风险分层
对所有患者采用三种早期胃癌高危背景黏膜评估方式进行风险分层,单因素分析木村–竹本分类中的中、重度萎缩(C3-O3)、OLGA/OLGIM高危组(III~IV期)与高危背景黏膜发生早期胃癌的风险有关(P < 0.001),详见表4。

Table 4. Univariate analysis of different risk stratification
表4. 不同胃癌风险分层方法的单因素分析
3.3. 不同评估方式对早期胃癌的诊断价值
通过绘制ROC曲线计算AUC,OLGIM分期、木村–竹本分类预测早期胃癌风险的AUC分别为0.785 (95%CI: 0.738~0.831)、0.784 (95%CI: 0.737~0.831),AUC差异0.01,差异无统计学意义(Z = 0.070, P = 0.944),且预测价值均高于OLGA分期(AUC = 0.706, 95%CI: 0.650~0.761, P < 0.05),详见图1。
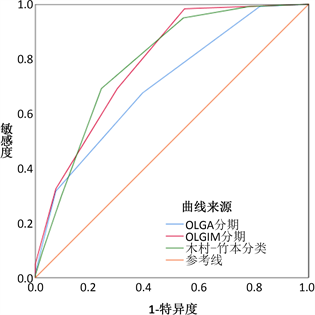
Figure 1. The performance of different assessment methods
图1. 不同评估方式的诊断效能
此外,OLGIM 0~I期、II期、III~IV期与木村–竹本分类的轻、中、重度萎缩相关(P < 0.05),一致性中等(Kappa = 0.698),见表5。
3.4. 多因素logistic回归分析确定早期胃癌的独立危险因素
将有吸烟史、有饮酒史、胃癌家族史、Hp现症感染、木村–竹本的中重度萎缩、OLGIM高危组(III~IV期)纳入多因素分析,结果显示有胃癌家族史、Hp现症感染、木村–竹本的中重度萎缩、OLGIM高危组(III~IV期)是早期胃癌的独立危险因素(P < 0.05),见表6。

Table 5. Consistency of Kimura-Takemoto classification and OLGIM staging
表5. 木村–竹本分类与OLGIM分期一致性比较

Table 6. Multivariate analysis
表6. 多因素logistic回归分析
3.5. 不同筛查方案联合诊断早期胃癌的效能
绘制有胃癌家族史、Hp现症感染、木村–竹本分类、OLGIM分期联合与有胃癌家族史、Hp现症感染、木村–竹本分类联合预测早期胃癌风险的受试者工作特征曲线(ROC),ROC曲线下面积(AUC)分别为0.815 (95%CI: 0.769~0.860)、0.806 (95%CI: 0.760~0.863),AUC差异无统计学意义(Z = 1.589, P = 0.112),预测效能高于单独使用木村–竹本分类(AUC = 0.784)、OLGIM分期(AUC = 0.783),P < 0.05。
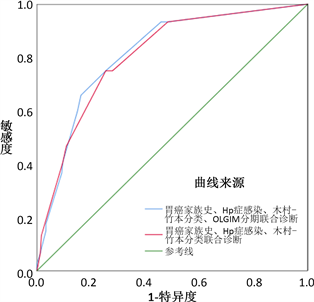
Figure 2. The performance of combined diagnostic
图2. 联合诊断效能
4. 讨论
早期胃癌可以通过内镜下微创治疗而得到治愈,5年的生存率较高,但由于早期胃癌缺乏明显的体征,就诊时大多处于中晚期 [2] [3] ,5年的生存率不足30%。通过流行病学调查初步筛选早期胃癌高危人群,进一步行内镜检查及组织学检查是目前国内常用的早期胃癌筛查方式。
流行病学调查检查容易获取,可用于识别胃癌高风险人群。本研究单因素及多因素分析结果显示Hp现症感染、有一级亲属胃癌家族史是胃癌发生的独立危险因素,而吸烟史、饮酒史不是早期胃癌风险的独立危险因素,这可能与纳入的样本量较少有关系。
萎缩和肠化作为肠型胃癌Correa级联反应 [4] [5] 的独立阶段,属于胃癌的高危背景黏膜。基于白光内镜检查的木村–竹本分类 [7] 以及基于病理组织学活检的OLGA分期 [8] 和OLGIM分期 [9] 均能对从不同的角度对萎缩、肠化进行识别,并进一步进行风险分层来评估早期胃癌发生的风险。本研究依次使用三种评估方式对研究对象进行胃癌风险分层,结果发现木村–竹本分类与OLGIM分期更有助于早期胃癌发生的高危背景黏膜评估,且二者间诊断效能相当。
OLGA分期和OLGIM分期是将胃黏膜组织学与胃癌风险联系的评价系统,一项荟萃分析 [11] 和国内外研究 [12] [13] [14] 均证实了OLGA/OLGIM III~IV期与胃癌的发生相关。本研究中胃癌组中OLGA/OLGIM III~IV期占比高于非胃癌组,OLGIM分期预测胃癌风险的诊断价值AUC为0.785 (95%CI: 0.738~0.831),诊断效能高于OLGA分期(AUC = 0.706, 95%CI: 0.650~0.761, Z = −0.7024, P < 0.001),与日本多中心的研究结果一致 [15] ,可能由于不同观察者间OLGIM分期判读结果一致性较高,而对于萎缩的病理诊断各观察者间一致性较低。OLGA/OLGIM分期侧重于多点活检取材获得的组织病理学表现,容易增加内镜下出血风险及增加医疗费用 [5] [11] 。
内镜检查被广泛应用于胃癌筛查,其中基于白光内镜检查的木村–竹本分类简单容易掌握,且不同医师间经过培训对萎缩的判断一致性较高。有研究发现木村–竹本分类中轻度萎缩(C0-C2)、中度萎缩(C3-O1)、重度萎缩(02-03)的胃癌五年累计发病率分别为0.7%、1.9%、10% [16] ,本研究单因素及多因素分析发现木村–竹本分类的中、重度萎缩与早期胃癌有较强的相关性,表明木村–竹本分类法有助于胃癌内镜筛查的风险分层。另有研究 [17] [18] 发现萎缩均伴有不同程度的肠上皮化生,在我们的研究中,木村–竹本分类的轻、中、重度萎缩与OLGIM的0~I期、II期、III期~IV期分期相关(P < 0.05),具有中等一致性(Kappa = 0.698),木村–竹本分类与OLGIM分期具有相似的诊断效能(AUC分别为0.784、0.785,Z = 0.070,P = 0.944),提示在临床实践中可采用木村–竹本分类法代替OLGIM分期用于早期胃癌风险的评估。
本研究多因素分析发现有一级亲属胃癌家族史、Hp现症感染、木村–竹本分类的中、重度萎缩与OLGIM分期的III~IV期与早期胃癌风险独立相关,胃癌家族史、Hp现症感染、木村–竹本分类、OLGIM分期联合与胃癌家族史、Hp现症感染、木村–竹本分类联合预测早期胃癌风险的受试者工作特征曲线(ROC)、曲线下面积(AUC)分别为0.815、0.806,差异无统计学意义(Z = 1.589, P = 0.112),预测效能高于单独使用木村–竹本分类(AUC = 0.784)、OLGIM分期(AUC = 0.783),表明胃癌家族史、Hp现症感染、木村–竹本分类的中、重度萎缩联合检测更有助于早期胃癌风险的评估。
本研究存在一定的局限性,纳入的早期胃癌均为肠型胃癌,可能不适合未分化癌及弥漫性胃癌,由于纳入的病例数较少,可能会限制最终的统计效果,仍需要多中心、大样本的研究比较不同评估方式对预测早期胃癌风险的诊断效能,以提高对早期胃癌及癌前病变的检出率。
基金项目
山东省中医药科技项目(医学类,编号2021M161)。