1. 前言
肺癌已成为全球最常见的恶性肿瘤,在中国,男女两性的肺癌死亡率位于各类恶性肿瘤之首 [1] ,肺腺癌发病率的上升趋势更明显 [2] 。据估计恶性肿瘤合并肺栓塞(Pulmonary embolism, PE)的患病率高达5%,在肺癌中这一数值更高。肺腺癌合并肺栓塞临床表现无明显特异性 [3] ,常见误诊或漏诊 [4] ,因此快速准确的早期诊断和治疗显得尤为重要。肿瘤患者本身的高凝状态 [5] ,需要经受反复放化疗、靶向治疗等多种治疗方案 [6] ,加肺癌终末期患者长期卧床,诸多因素导致PE发生率增加。而且,PE会加重病情,导致肺癌病情恶化,并干扰对原发性肿瘤的治疗方案,所有这些最终都会缩短生存时间。众所周知肺癌合并肺栓塞的危险因素很多,例如临床分期、病理类型,年龄、吸烟史,基因突变状态等,本研究获取59例晚期肺腺癌合并肺栓塞患者的临床资料,对照组选取59例晚期肺腺癌不合并肺栓塞的患者,旨在探讨晚期肺腺癌合并肺栓塞患者的临床特征及危险因素对其预测价值。
2. 资料与方法
2.1. 患者资料
研究对象选取2015.01~2020.1在青岛大学附属医院诊断为晚期肺腺癌合并肺栓塞的有基因检测结果的59例患者为研究对象,收集同期59例晚期肺腺癌不合并肺栓塞且有基因检测结果的患者作为对照组,对收集的临床资料进行详细记录。
2.2. 纳入标准及排除标准
1) 晚期肺腺癌合并PE组:① 2015年01月至2020年1月于我院呼吸与危重症医学科和肿瘤科住院的病例;② 经肺穿刺活检检查诊断为肺腺癌,临床分期为IV期,并且经CTPA、核素肺通气/灌注扫描(V/Q)其中之一确诊为肺栓塞的患者;③ 住院病历及辅助检查均完善的患者。每个患者均需满足上述3个条件方可入组。
2) 晚期肺腺癌不合并PE组:① 2015年01月至2020年1月于我院呼吸与危重症医学科和肿瘤科住院的患者;② 经肺穿刺活检病理学检查诊断肺腺癌,临床分期为IV期;③ 住院病历及辅助检查完善的患者;④ 除外合并其他静脉血栓栓塞的肺腺癌患者。每个患者均需满足上述4个条件方可入组。
3) 两组的排除标准:① 未经过病理学确诊的肺恶性肿瘤患者;② 可疑肺栓塞,却未发现支持肺栓塞临床诊断的依据;③ 住院病历及辅助检查欠完善的病例。满足上述任何一条即排除。
2.3. 诊断标准
1) 肺栓塞诊断标准:符合中华医学会《肺血栓栓塞症诊断与治疗指南草案》标准① 存在PTE的相关危险因素 [7] ;② CTPA、核素肺通气/灌注扫描(V/Q)等其中一项检查阳性即可诊断;③ 患者化验检查的实验室指标支持肺栓塞的诊断。
2) 肺腺癌的诊断标准:经病理学证实为肺腺癌。
3) 肺腺癌分期标准:肺癌分期均按照国际肺癌研究学会(IASLC)制定的国际肺癌TNM分期(第八版) [8] 。
2.4. 研究指标
性别、年龄、病理分化程度、初次治疗方案、WBC、Hb、PLT、D-二聚体、CEA、SCC、NSE pro-GRP及CYFRA211,收集上述资料,分析两组之间的差异,进而总结晚期肺腺癌合并肺栓塞的患者的临床特征及独立危险因素对其预测价值。
2.5. 统计学方法
使用SPSS25.0软件进行数据分析,首先对统计资料进行正态性检验,若总体分布符合正态分布,计量资料采用参数检验法,使用
± s进行描述,不服从正态分布的计量资料或者等级资料采用Wilcoxon符号秩和检验(X2检验或Fisher确切概率法)。对于两独立样本的计量资料,符合正态分布的进行方差齐性检验,若方差齐,采用两独立样本t检验,若方差不齐,采用Wilcoxon符号秩和检验。明确上述危险因素后,采用二元Logistic回归分析进行独立危险因素分析检验。采用Spearman检验进行相关性分析,相关系数以|r| ≤ 0.3为低度相关性,0.3 < |r| ≤ 0.5为中度相关性,|r| > 0.5为高度相关性。绘制ROC并计算出ROC曲线下面积、诊断最佳临界值、特异性及敏感性,ROC曲线下面积反映诊断试验的价值大小,(0.50, 0.70]表示诊断价值较低;(0.70, 0.90]表示诊断价值中等;(0.90, 1]表示诊断价值较高。上述统计结果均以P < 0.05为有统计学意义。
3. 结果
3.1. 病例资料的统计结果
晚期肺腺癌合并PE的研究组患者为59例,晚期肺腺癌不合并PE的对照组59例。晚期肺腺癌合并PE组女性患者27例(41.9%),男性患者28例(50.8%),对照组女性31例(49.2%),男性31例(49.2%)。晚期肺腺癌合并肺栓塞组与肺腺癌组患者的平均年龄65.29 ± 7.92岁和64.85 ± 10.22岁,观察组患者的平均年龄略高于对照组。吸烟史、高血压、糖尿病、冠心病、肺癌家族史、原发部位、病理类型的分化程度和确诊后的首次治疗方式进行统计学分析,分析结果提示两组之间吸烟史、原发部位、突变类型及治疗方式有统计学差异(P < 0.05,见表1)。

Table 1. Comparison of case data between the two groups
表1. 两组病例资料比较
*Study group: Advanced lung adenocarcinoma with PE; **Control group: Advanced lung adenocarcinoma without PE; HBP: high blood pressure; DM: diabetes mellitus; CAD: coronary heart disease; LUL: left upper lobe; LLL: Left lower lobe. RUL: Right upper lobe; RLL: Right lower lobe. a:方差齐性检验未通过,两独立样本的秩和检验。b:四格表中,其中一个格的频数T < 1,Fisher确切概率法。c:等级资料使用Wilcoxon秩和检验。
3.2. 两组患者实验室检查的统计结果
血常规中的WBC、Hb、PLT和血凝常规中的D-二聚体水平,肿瘤标志物中的CEA、SCC、NSE及pro-GRP及CYFRA211为计量资料,方差齐性检验后根据结果采用两独立样本的t检验或者Wilcoxon秩和检验进行统计学分析,统计结果如下(见表2)。晚期肺腺癌合并PE组的D-二聚体浓度为(5.142 ± 5.70) mg/L,明显高于对照组的(1.327 ± 2.54) mg/L,差异有统计学意义(P < 0.05),其他的观测指标未见明显统计学差异。

Table 2. Comparison of laboratory examination data between the two groups
表2. 两组实验室检查资料的比较
*Study group: Advanced lung adenocarcinoma with PE; **Control group: Advanced lung adenocarcinoma without PE; a,方差不齐,Wilcoxon秩和检验。
3.3. 晚期肺腺癌合并肺栓塞的独立危险因素分析
吸烟史,突变类型、肺癌的原发部位及D-二聚体水平的二元logistic回归分析结果(见表3),提示D-二聚体是影响晚期肺腺癌合并肺栓塞的独立危险因素(P < 0.001),其余危险因素均无显著统计学差异。

Table 3. Comparison of risk factors in patients between the two groups
表3. 两组病例患者的危险因素比较情况
Note: When logistic analysis defined regression variables, smoking history, primary site (lower right), no change, targeted therapy was the reference category.
3.3.1. D-二聚体与晚期肺腺癌合并肺栓塞相关性分析
采用Spearman 检验进行相关性分析,分析结果提示D-二聚体水平与晚期肺腺癌合并肺栓塞具有中度相关性(|r| = 0.602, P < 0.001) (见表4)。

Table 4. Correlation analysis between D-dimer and pulmonary embolism in advanced lung adenocarcinoma
表4. D-二聚体与晚期肺腺癌合并肺栓塞相关性分析
3.3.2. D-二聚体与晚期肺腺癌合并肺栓塞可能性的预测价值
运用ROC曲线进行D-二聚体与晚期肺腺癌合并肺栓塞相关性分析(见图1),ROC曲线分析结果提示D-二聚体预测晚期肺腺癌合并肺栓塞的AUC为0.848 (95% CI: 0.779~0.919),用约登指数求出D-二聚体的最佳临界值1365 ng/L,此时灵敏度为81.4%,特异度为79.7% (见表5)。

Table 5. The sensitivity and specificity results of D-dimer in predicting pulmonary embolism in advanced lung adenocarcinom
表5. D-二聚体预测晚期肺腺癌合并肺栓塞的敏感度及特异度结果
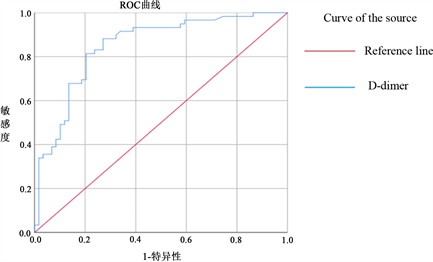
Figure 1. D-dimer predicted the ROC curve of pulmonary embolism in patients with lung adenocarcinoma
图1. D-二聚体预测肺腺癌患者合并肺栓塞的ROC曲线
4. 讨论
研究表明,高龄是PE发病的独立危险因素 [9] ,本次入组的均为IV期肺腺癌患者,平均年龄65.29 ± 7.92岁和64.85 ± 10.22岁,两组患者的平均年龄均较高,可能是本研究未表现显著统计学差异的重要原因。吸烟史作为公认的影响肺癌的重要的因素,研究表明吸烟者的基因表达水平发生改变,促进肺癌的发生,且不同国家的吸烟者的基因表达水平类似 [10] ,但本研究并未出现统计学差异,考虑与入组样本少有关。高龄患者易合并高血压、糖尿病、冠心病等基础疾病,血压、血糖控制不佳导致血管内皮损伤及血管活性物质代谢紊乱,造成血液的高凝状态,肺栓塞的患者多数合并下肢静脉血栓,进而促进肺栓塞的发生。综上所述,肺腺癌患者无论高龄、是否合并高血压、糖尿病和冠心病,均不能作为判断肺腺癌患者是否易合并肺栓塞的判断依据。肺癌家族史的统计结果中,晚期肺腺癌合并PE组有5人(50.5%)有家族史,对照组仅有4人(44.4%)有家族史,存在肺癌家族史的病人总数不多,同时,不是所有的患者都明确家族中是否有亲属因肺癌去世。这是临床工作中需要明确的一点,即使对没有家族史的肺癌患者,也不能低估患者合并肺栓塞的风险。研究表明肿瘤原发位置不能作为生存的独立预测因子 [11] ,本研究提示原发部位的差异对是否合并肺栓塞无统计学差异,考虑与此有关。肺腺癌的分化程度对合并肺栓塞并未呈现统计学的意义,研究认为低分化的恶性肿瘤更易早期出现转移,激活凝血系统更强烈,更容易出现高凝状态,促进肺栓塞的形成的发生 [12] ,本次研究入组的患者均为IV期肺腺癌,大部分出现了转移,导致两组患者的差异不明显。
基因突变类型对晚期肺腺癌合并肺栓塞的危险因素分析并无显著的统计学差异。本次入组患者的基因突变状态为表皮生长因子受体(Epidermal Growth Factor Receptor, EGFR)是否突变,大量研究表明EGFR的过表达在肺癌的发生发展及转移中发挥重要作用,与肿瘤预后和化疗药物的敏感性相关 [13] [14] ,由于晚期肺腺癌合并肺栓塞的总体存活率较低,以铂为基础的化疗似乎达到了平台期。诸多研究表明,相对于靶向治疗而言,化疗是PE的危险因素 [15] 。顺铂类化疗药物可能是通过蛋白二硫键异构酶依赖途径中的二硫键形成增加内皮细胞的促凝血活性,从而促进晚期肺腺癌合并肺栓塞的形成。本研究属于真实世界的研究,由于靶向药物的费用问题,使部分检测出基因突变的患者未使用靶向药物治疗,同时,基因检测阴性的患者因基础状况较差或无法耐受化疗产生的副作用,从而试用靶向药物治疗。两组患者的基因突变状态和初始治疗方案对晚期肺腺癌合并肺栓塞的影响无统计学差异,受到诸多主观因素的影响,需要前瞻性的随机对照实验进行研究。即使目前肺腺癌患者的治疗打破了传统单一的化疗方案,放化疗、靶向联合免疫治疗的时代,5年生存率仅15.5% [16] ,由于每种治疗方案无法长久有效,故患者需要经过多种治疗方案的同时或交替进行,故研究肺癌患者的治疗方案选择对晚期肺腺癌合并肺栓塞的影响是比较难的,统计学无显著性差异的原因是受到太多主观因素的干扰,为明确治疗方案对晚期肺腺癌合并肺栓塞的影响,需要前瞻性的随机对照实验进行验证。
本研究中,两组血常规中的WBC、Hb、PLT无统计学差异。关于WBC、Hb和PLT对晚期肺腺癌合并肺栓塞的危险因素的研究,目前尚无定论 [17] [18] [19] [20] ,导致这一结果的原因首先是肺癌是恶性肿瘤,消耗性的疾病会导致血红蛋白的降低,也会影响血小板的变化水平,肺癌患者在合并肺栓塞时,血流动力学会影响血液中各种血液组分的变化,故认为探究WBC、Hb、PLT在晚期肺腺癌合并肺栓塞中的变化水平需要纳入数量足够多的样本。既往研究认为肿瘤标志物(CEA、SCC、NSE、pro-GR和CYFRA211)作为肺癌的预测指标和疗效监测项目。本次研究提示晚期肺腺癌合并PE组与对照组的CEA水平为64.18 ± 218.9 vs 63.54 ± 112.6 ng/L,无显著的统计学差异(P > 0.05)。既往认为就单个肿瘤标志物而言,CEA对PE的预测价值最强 [21] ,考虑本次入组的患者均为肺腺癌患者,CEA是肺腺癌的重要预测因素,本次研究入组患者的基线资料相对一致,可能是导致肿瘤标志物(CEA、SCC、NSE、pro-GRP和CYFRA211)对晚期肺腺癌合并肺栓塞的统计结果无显著的统计学差异,需要扩大样本资料及更详细的亚组分析来达到验证肿瘤标志物是否可预测晚期肺腺癌合并肺栓塞的目的。
先前的研究也指出,D-二聚体水平升高可能与晚期肺腺癌合并PE的风险呈正相关 [22] 。本次研究中D-二聚体对晚期肺腺癌合并肺栓塞的诊断价值相对较高;D-二聚体是血液凝固和分解过程中的副产物,常使血液表现为高凝状态,D-二聚体浓度升高可提高继发性纤溶活性。D-二聚体浓度低于500 ng/L排除高凝状态具有重要意义 [23] 。由于肿瘤本身是导致血液高凝状态的原因之一,故当肺腺癌患者的D-二聚体升高至1365 ng/L时,高度警惕合并肺栓塞的可能性,及早使用抗凝药物,降低病情恶化的机率。
据我们所知,肺癌合并肺栓塞临床特征分析的研究很多,但是这是首次在病理类型及肿瘤分期一定的情况下进行统计,统计过程中发现在平衡患者基线资料的情况下,其他常见的危险因素无统计学差异,在此基础上我们进行了D-二聚体与晚期肺腺癌合并肺栓塞的相关统计分析。统计结果提示D-二聚体升高是晚期肺腺癌合并肺栓塞的独立危险因素。但D-二聚体如何影响晚期肺腺癌合并肺栓塞机制仍未阐明。真实世界中的研究有诸多因素限制,这使得统计结果受到一些主观因素的限制。足够且有效的患者病例数是减少误差和偏移最佳解决方案,进而得到有高度预测价值的临界值,以便我们能够制定出更有效的预防和治疗肺栓塞的策略。
基金项目
青岛市2022~2024年医疗卫生优秀学科带头人计划(青卫政字〔2022〕6号);AMFR基因表达与人类浸润性微乳头状癌的相关性研究(2022-WJZD075)。
NOTES
*通讯作者。