摘要: 目的:本研究旨在深入探讨食管裂孔疝(EHH)合并反流性食管炎(RE)患者的临床特征,并识别相关危险因素,以便为临床治疗提供更有效的指导。方法:采用回顾性分析方法,对2023年1月至6月在青岛大学附属医院内镜中心接受胃镜检查的193例EHH患者进行研究。其中,96例合并RE的EHH患者作为观察组,另外97例未合并RE的EHH患者作为对照组。本研究比较了两组患者在一般情况(包括性别、年龄、吸烟、饮酒、BMI、高血压、糖尿病、精神状态、工作性质)、临床症状、内镜表现、饮食习惯以及幽门螺杆菌(HP)感染情况等方面的差异。结果:体重、BMI和生活习惯:在体重和BMI方面,两组患者表现出显著差异。特别是在合并反流性食管炎(RE)组中,有两种或三种不良饮食习惯的患者比例显著高于未合并RE组。吸烟、焦虑和工作性质:吸烟和焦虑状态在合并RE组中更为普遍,且该组中以脑力劳动者为主,超过了体力劳动者的比例。高血压和糖尿病:高血压和糖尿病在两组之间也显示出显著差异。临床症状:反酸和烧心的症状在合并RE组患者中更为常见。不同级别食管炎患者的特征差异:吸烟:在C级和D级反流性食管炎患者中,吸烟行为的差异达到了显著水平。BMI:A级和B级反流性食管炎患者在BMI上显示出显著差异。性别:D级食管炎与A级和B级食管炎患者在性别分布上存在显著差异。这些结果提供了关于食管裂孔疝合并反流性食管炎患者的重要临床特征和风险因素的见解,对于未来的治疗策略和管理提供了有价值的指导。结论:本研究深入探究了食管裂孔疝合并反流性食管炎患者的核心危险因素,发现关键危险因素:体重、BMI、吸烟、焦虑、工作性质、高血压、糖尿病、反酸与烧心和饮食习惯是食管裂孔疝合并反流性食管炎发展的重要因素。特别是,存在两种或三种不良饮食习惯的患者,其风险显著增加。临床特征:合并反流性食管炎的食管裂孔疝患者中,男性比例高于女性,焦虑症状更常见,且脑力劳动者多于体力劳动者。这些患者更频繁出现反酸和烧心的症状,倾向于有多种不良饮食习惯。不同级别食管炎的差异:吸烟在C级和D级反流性食管炎患者中的影响显著。BMI在A级和B级食管炎患者中是一个关键因素。性别差异在D级食管炎与A级及B级食管炎之间表现出显著的影响。
Abstract:
Objective: This study aims to thoroughly investigate the clinical characteristics of patients with Esophageal Hiatal Hernia (EHH)combined with Reflux Esophagitis (RE) and identify relevant risk factors to provide more effective clinical treatment guidance. The method employed is a retrospec-tive analysis of 193 EHH patients who underwent gastroscopy at the Endoscopy Center of Qingdao University Affiliated Hospital from January to June 2023. Among these, 96 patients with combined RE were designated as the observation group, while the remaining 97 without RE were the control group. The study compared differences between the two groups in general conditions (including gender, age, smoking, drinking, BMI, hypertension, diabetes, mental state, and nature of work), clinical symptoms, endoscopic findings, dietary habits, and Helicobacter pylori (HP) infection status. Results: Weight, BMI, and Lifestyle: Significant differences were observed between the two groups in terms of weight and BMI. Notably, in the combined RE group, a significantly higher proportion of patients had two or three unhealthy dietary habits compared to the non-combined RE group. Smoking, Anxiety, and Work Nature: Smoking and anxiety were more prevalent in the combined RE group, where a majority were mental laborers exceeding the proportion of physical laborers. Hy-pertension and Diabetes: Significant differences in hypertension and diabetes were observed be-tween the two groups. Clinical Symptoms: Symptoms of heartburn and acid reflux were more com-mon in the combined RE group. Differences in Esophagitis Levels: Smoking: Significant differences were observed in smoking behavior between levels C and D of reflux esophagitis. BMI: Significant differences in BMI were noted between levels A and B. Gender: Significant gender differences were found between level D and levels A and B of esophagitis. These findings provide insights into the critical clinical characteristics and risk factors of patients with esophageal hiatal hernia combined with reflux esophagitis, offering valuable guidance for future treatment strategies and manage-ment. Conclusion: The study delved into the core risk factors for patients with esophageal hiatal hernia combined with reflux esophagitis, identifying key risk factors: weight, BMI, smoking, anxiety, nature of work, hypertension, diabetes, heartburn, and dietary habits as significant contributors to the disease’s development. Particularly, patients with two or three unhealthy dietary habits faced a significantly increased risk. Clinical Characteristics: In patients with esophageal hiatal hernia com-bined with reflux esophagitis, a higher proportion were male, more prone to anxiety, and predomi-nantly engaged in mental labor. These patients more frequently experienced heartburn and acid reflux symptoms and tended to have multiple unhealthy dietary habits. Differences in Esophagitis Levels: Smoking had a significant impact on levels C and D of reflux esophagitis. BMI was a key fac-tor for levels A and B. Gender differences were significant between level D and levels A and B of esophagitis.
1. 引言
食管裂孔疝(hiatal hernia of esophagus, EHH)是除食管以外的任何腹腔组织结构通过扩大的膈肌食管裂孔进入胸腔形成的疝,其为膈疝中最常见者,达90%以上 [1] 。常伴有胃食管反流疾病,但常因无症状或症状轻微而被忽视。多发生于50岁以上,经报道国外疾病发生率约5.7%,国内约3.3% [2] 。而胃食管反流病(GERD),是指胃十二指肠内容物出现反流进入食管内,引起患者反酸、烧心等临床症状,对口腔、咽喉、气道等食管邻近组织造成损伤,出现哮喘、慢性咳嗽等食管外表现。内镜是主要的诊断手段,广义的GERD包括食管粘膜破损或无破损的状态 [3] 。据此可分为内镜阴性和阳性GERD,前者指内镜下病变为“0”级,但组织学已有病变的患者;后者指酸(碱)反流导致食管粘膜破损称反流性食管炎(RE) [4] 。反流性食管炎(RE)的发生及进展与食管裂孔疝(EHH)存在密切关联性,同时EHH也是引起RE难治的重要因素之一,因此及时诊断EHH合并RE患者,并根据患者一般情况(包括性别、年龄、吸烟、饮酒、BMI、高血压、糖尿病、精神状态、工作性质)、临床症状、内镜表现、饮食习惯以及HP等因素进行综合考虑,从而给予针对性、安全性、有效性诊治措施,有利于最大程度保证患者生存质量及生命安全。基于此,本研究将对EHH合并RE患者的临床特点进行对照分析。
2. 资料与方法
2.1. 一般资料
本研究选取了2023年1月年至2023年6月于青岛大学附属医院内镜中心行胃镜检查的193例食管裂孔疝(EHH)患者作为研究对象,其中将合并RE的96例EHH患者作为观察组,同期未合并RE的97例EHH患者作为对照组。
纳入标准:1) 年龄 > 18周岁;2) 符合《食管裂孔疝的内科诊断标准》:齿状线上移(>2 cm);食管裂孔压迹松弛、宽大;内镜下可见疝囊;内镜下胃底黏膜松弛、变浅或消失,提示His角变钝或拉直。3) 符合《胃食管反流病基层诊疗指南(2019年)》中GERD诊断标准:患者表现出反流、烧心等典型症状,经上消化道内镜检查存在反流性食管炎相关征象;
排除标准:1) 年龄 > 85岁或年龄 < 18岁;2) 合并消化系统恶性肿瘤;3) 既往行食管部分切除、胃底折叠术等上消化道手术史;4) 患者不配合研究及检查;5) 相关资料不全者;
材料和标准:Olympus奥林巴斯CV-290电子胃肠镜系统。它提供了多种模式,包括不同的光照模式,以帮助医生进行诊断。在内镜检查中,白光模式是最常见的标准观察模式,用于观察胃肠道的一般状况和进行基本的诊断。使用特定的A5白光模式来诊断反流性食管炎(RE)的分级,普通的白光内镜可以提供足够的视野和分辨率来进行食管病变的观察和分级.在进行食管炎症或其他胃肠道病变的诊断时,内镜医生通常会根据所见病变的特点和内镜图像的质量来确定最佳的观察模式。通过这些技术可以提病变的检出率和诊断准确性。
2.2. 方法
观察指标包括:
1) 一般情况:性别、年龄、吸烟史、饮酒史、计算体重指数(BMI)、精神状态、工作性质(脑力/体力)。其中精神状态根据汉密顿焦虑量表(HAMA)进行测试。≤6分,无焦虑症状;7~13分,可能有轻微焦虑;14~20分,有一定程度焦虑;21~28分,有明显的焦虑;≥29分,有严重焦虑。脑力劳动:指以消耗脑力为主的劳动,如管理国家事务、组织生产,以及从事政治、文化和科学研究等活动。体力劳动:指劳动者以运动系统为主要运动器官的劳动。
2) 既往史:高血压、糖尿病。
3) 临床症状:反酸、烧心。
4) 内镜表现:根据洛杉矶分级,RE可进一步分为A、B、C、D 4个等级(图1),分级标准如下:A级,指1条或1条以上食管黏膜损伤,受损长度 ≤ 5 mm;B级,指1条或1条以上食管黏膜损伤,受损长度 > 5 mm,黏膜破损无融合;C级,指至少2条食管黏膜破损,且黏膜破损相互融合,融合范围<食管全周的75%;D级,指黏膜破损且相互融合,融合范围 ≥ 食管全周的75%。
这些观察指标的来源是《中国胃食管反流病诊疗规范(2023)》。该规范为诊断和治疗食管裂孔疝和反流性食管炎提供了标准化的指导,有助于确保研究的准确性和可靠性。
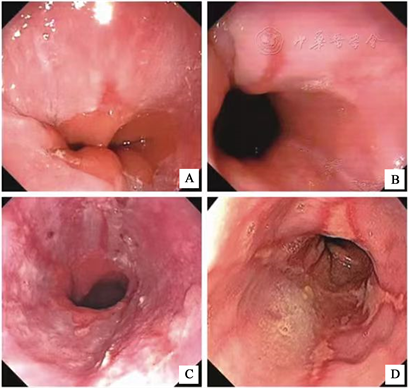 A:A级,食管黏膜受损长度 ≤ 5 mm;B:B级,食管黏膜受损长度 > 5 mm;C:C级,食管黏膜破损融合范围 < 食管全周的75%;D:D级,食管黏膜破损融合范围 ≥ 食管全周的75%。
A:A级,食管黏膜受损长度 ≤ 5 mm;B:B级,食管黏膜受损长度 > 5 mm;C:C级,食管黏膜破损融合范围 < 食管全周的75%;D:D级,食管黏膜破损融合范围 ≥ 食管全周的75%。
Figure 1. Los Angeles grading of reflux esophagitis
图1. 反流性食管炎(RE)洛杉矶分级
5) 饮食习惯:饮食过快、高脂饮食、喜食辛辣。饮食过快:根据《中国居民膳食指南》的建议,早餐最好用15~20分钟吃完,中餐和晚餐用时一般在30分钟左右。小于以上时间为饮食过快。高脂饮食:根据《成人高脂血症食养指南2023》指出,以成年人每日能量摄入2000 kcal为例,每日脂肪摄入量(包括烹调油、动物性食品及坚果等食物中的油脂)占总能量的25% (55 g)以上。每日烹调油不应超过25 g。超过以上标准为高脂饮食。喜食辛辣:包括葱、生姜、蒜、洋葱、辣椒、萝卜、芥末等。
6) HP:阴性、阳性。
关于HP结果是否阳性是通过内镜进行活检后获得的病理结果。
数据收集中一般临床资料(包括性别、年龄、吸烟、饮酒、BMI、高血压、糖尿病、工作性质)、临床症状、内镜表现、以及幽门螺杆菌(HP)感染情况通过院内病例系统查阅病历、电话随访等方式获取;精神焦虑情况、饮食习惯通过电话随访、完善汉密顿焦虑量表(HAMA)收集数据;部分患者通过发放问卷星小程序创建的汉密顿焦虑量表(HAMA)获取相关数据。
2.3. 统计学方法
采用的统计学方法:所有数据均采用SPSS 26.0统计软件对数据进行统计分析,正态分布的计量资料以均数±标准差表示,组间比较采用独立样本t检验,不符合正态分布的计量资料使用秩和检验;计数资料以比例(%)表示,组间比较采用χ2检验或者Fisher精确检验;p < 0.05有统计学意义。
3. 结果
3.1. 两组患者一般基线资料情况
符合正态分布的为体重、BMI。根据统计分析结果可知,观察组与对照组在体重、BMI、吸烟、焦虑、工作性质、高血压、糖尿病、反酸与烧心方面具有显著差异性,p < 0.05。如表1、图2。

Table 1. Comparative analysis of general baseline data between the two groups
表1. 两组患者一般基线资料对比分析
根据结果可知,两组患者在饮食情况具有显著差异,p<0.05。同时合并RE组中具有两种以及三种不良饮食习惯的患者显著高于未合并RE组人数。如表2、图3。
3.2. 观察组患者临床特征情况
根据结果可知,合并RE组内男性多于女性、焦虑人数多、脑力劳动者多于体力劳动者、有反酸烧心临床症状患者多、具有两种以及三种不良饮食习惯的患者多。如表3。并且用雷达图在多个维度上比较患者的临床特征。如图4。

Table 2. Comparative analysis of general baseline data between the two groups
表2. 两组患者一般基线资料对比分析
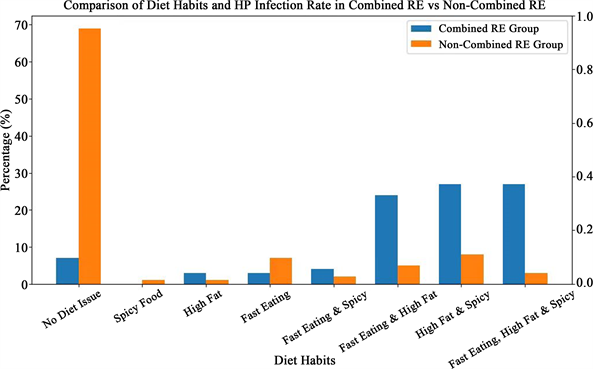
Figure 3. Comparison of dietary habits and HP infection rate 3
图3. 饮食习惯及HP感染率的比较

Table 3. Clinical characteristics analysis of patients in the observation group
表3. 观察组患者临床特征分析
续表
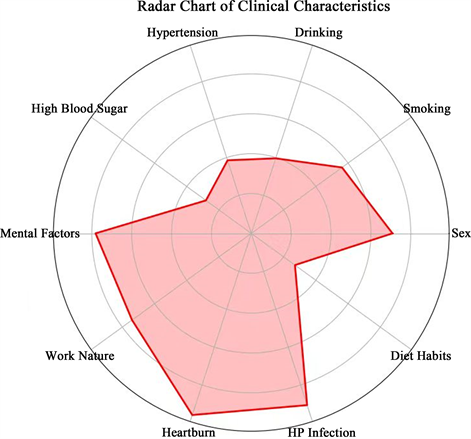
Figure 4. Multi-dimensional comparison of different clinical features radar
图4. 多维度上比较不同的临床特征雷达
3.3. 不同级别反流性食管炎患者临床特征比较
根据结果可知,不同级别反流性食管炎患者针对吸烟类别具有显著特异性,p < 0.05。如表4。并使用箱线图展示连续变量(如年龄、BMI)的分布情况。如图5。这些图表能够清晰地展示不同食管炎等级的患者在各个临床特征上的差异。

Table 4. Comparison of clinical characteristics of patients with different grades of reflux esophagitis
表4. 不同级别反流性食管炎患者临床特征比较结果

Figure 5. Show continuous variable box diagram 5
图5. 展示连续变量箱线
根据结果可知,吸烟中反流性食管炎C级和反流性食管炎D级具有显著差异性,BMI中反流性食管炎A级和反流性食管炎B级具有显著差异性,性别中反流性食管炎D级与反流性食管炎A级、反流性食管炎B级具有显著差异性,p < 0.05。如表5。

Table 5. Comparative results of clinical characteristics of patients with reflux esophagitis of different grades
表5. 不同级别反流性食管炎患者临床特征两两比较结果
4.讨论
4.1. 食管裂孔疝患者合并反流性食管炎的危险因素分析
反流性食管炎(Gastroesophageal Reflux Disease, GERD)是一种常见的消化系统疾病,主要指胃酸和胆汁等胃内容物逆流至食管,损伤食管黏膜的炎症性疾病 [5] 。常见症状包括胸骨后疼痛或不适感、胸口灼热或烧灼感、咳嗽、咳痰、喉咙痛、呕吐等。长期未得到有效治疗的GERD患者可能会导致食管炎、食管溃疡、食管狭窄、Barrett食管等并发症的发生 [6] 。本文通过设置对照组,根据统计分析结果得出食管裂孔疝患者合并反流性食管炎的危险因素是体重、BMI、吸烟、焦虑、工作性质、高血压、糖尿病、反酸与烧心、饮食习惯,且具有两种以及三种不良饮食习惯。
肥胖是食管裂孔患者合并反流性食管炎一个危险因素。有研究表明,肥胖与GERD的发病和严重程度之间存在一定的关联 [7] 。肥胖可以增加腹内压力。肥胖者由于脂肪堆积在腹部,增加了腹腔内压力,从而增加了胃酸和消化液逆流至食管的可能性,这些胃酸和消化液的逆流刺激食管黏膜,导致反流性食管炎的发生 [8] 。肥胖者由于腹部脂肪的积累,增加了膈肌和食管之间的压力差,促使食管部分脱出至腹腔,这种脱出的情况使得胃酸更容易逆流至食管,导致GERD的发生 [9] 。
研究表明,吸烟与GERD的发病和严重程度之间存在一定的关联 [10] 。吸烟可以增加胃酸分泌。研究显示,吸烟会刺激胃黏膜细胞分泌胃酸,增加胃酸的产生量,这样的高胃酸水平增加了胃酸和消化液逆流至食管的可能性,导致GERD的发生。研究表明,吸烟会降低唾液的产生,而唾液中含有保护食管黏膜的成分,如碱性磷酸酶和腺苷酸,通过降低唾液的保护作用,吸烟可能导致食管黏膜受到更严重的损伤,使得GERD的症状更加明显 [11] 。吸烟不仅增加了GERD的发病风险,还会加剧疾病的严重程度和持续时间。因此,戒烟是预防和治疗合并GERD的食管裂孔疝患者的重要措施。戒烟可以减少胃酸分泌、改善食管括约肌功能,并降低GERD的发病风险和疾病的严重程度。
焦虑是食管裂孔疝(EHH)患者合并反流性食管炎(GERD)的一个危险因素。焦虑时,人体会分泌入肾上腺素、皮质醇等物质,这些物质会影响胃肠道运动和消化功能 [12] 。胃肠道对这些应激物质的反应可能导致胃酸过多、胃肠道蠕动失调等不利的生理反应,这些不利的生理反应有可能促进GERD的发生。焦虑可能引起心率加快、呼吸急促等生理反应,这些生理反应可能会刺激胃酸和消化液的分泌,促进GERD症状的表现,如胸口灼热、胃部不适等 [13] 。虽然焦虑是GERD的一个危险因素,但是采取积极的应对措施可以减轻焦虑带来的负面影响。如可以进行心理咨询、放松训练、体育锻炼等方法来减轻焦虑,从而降低GERD症状的发生和严重程度。
脑力劳动相较于体力劳动会带来更多的精神紧张和压力,可能诱发或加重GERD的症状 [14] 。精神紧张和压力可能导致胃肠道的紧张和蠕动异常,增加胃酸分泌,从而促进GERD的发生和恶化。
高血压可能导致胃肠道的血液供应不足,影响胃肠道的正常功能,从而增加胃酸分泌和消化液的逆流风险,导致GERD的发生和恶化 [15] 。另一方面,高血压患者通常伴随着肥胖、高胆固醇、高血糖等代谢异常,这些因素本身也与GERD的发病和严重程度相关 [16] 。
高脂肪、高胆固醇饮食与EHH和GERD的发生有关 [17] 。快速进食、立即平躺等行为可以增加胃内压力,使胃酸更容易反流入食管。同时,夜宵、睡前进食等行为还可能加重GERD [18] 。
4.2. 合并反流性食管炎的食管裂孔疝患者的复杂和多因素的疾病研究发现
GERD (胃食管反流病)是一个复杂和多因素的疾病,其病因涉及多个相关因素。以下是一些关键的研究发现,揭示了GERD的多因素成因。
GERD的病因:GERD的发病机制是多因素的,包括胃肠道解剖结构的改变、下食管括约肌、食管清除和胃蠕动(胃排空)的影响等。GERD可能导致各种食管外症状和并发症,如肺炎、哮喘和睡眠呼吸暂停综合症等 [19] 。
GERD的多因素病理生理学:GERD的病理生理学是复杂和多因素的,涉及多种机制和防御因素的相互作用。例如,食管胃连接处的功能不良、胃酸反流、食管黏膜屏障的损伤、下食管括约肌的瞬时松弛等都是GERD发病的关键因素 [20] 。
GERD的影响因素:GERD的发生可能与肥胖、吸烟、饮酒、饮食习惯、药物使用和其他健康状况(如糖尿病、高血压)有关。这些因素可能通过影响胃酸分泌、食管黏膜屏障的完整性或胃肠道动力学来促进GERD的发生 [21] 。
GERD的症状与感知:GERD的症状可能因个体对食管酸敏感性的不同而有所不同。这意味着GERD的临床表现在不同患者中可能有显著差异,包括典型的食管症状(如胸骨后疼痛和烧心)和食管外症状(如咳嗽和喉咙痛) [22] 。
在GERD (胃食管反流病)的多因素风险分析中,某些因素的组合可能导致更高的风险和更严重的病情。比如:肥胖和生活方式因素,肥胖与GERD有显著关联,特别是腹部肥胖。当肥胖与不良生活方式因素(如高脂饮食、吸烟、过量饮酒)相结合时,风险可能进一步增加。这些因素共同作用可能增加腹内压力,导致食管下括约肌功能减弱,进而增加胃酸反流的风险。吸烟和饮酒,吸烟和饮酒是GERD的独立风险因素。当两者共存时,它们可能相互作用,加剧食管黏膜的损伤,并降低食管对胃酸的防御能力。这种组合可能导致更频繁和更严重的GERD症状。肥胖和糖尿病,肥胖和糖尿病的组合可能加剧GERD。糖尿病可能影响胃排空和食管动力功能,而肥胖增加腹内压力。这两种情况的结合可能导致胃酸反流加剧,进而增加GERD的严重程度。应激和睡眠障碍,应激和睡眠障碍(如睡眠呼吸暂停综合症)的组合可能对GERD产生重要影响。应激可能导致胃酸分泌增加,而睡眠障碍可能干扰正常的食管清除机制,这两者共同作用可能导致夜间GERD症状加剧。
综上所述,GERD的发病机制涉及多种因素,包括解剖结构的改变、胃酸分泌、食管黏膜的防御机制、生活方式因素等。因此,在临床实践中,对GERD的管理应考虑这些因素的相互作用和叠加效应,以更有效地预防和治疗GERD。
参考文献
NOTES
*第一作者。
#通讯作者。