1. 引言
自COVID-19新型冠状病毒肺炎疫情爆发以来,醇类消毒剂产品由于肤感清爽,安全无毒,可有效灭活病毒等特性,在我国和世界各国疫情防控工作中发挥了关键作用 [1] 。由于含醇手部消毒剂的功效与其中含有的醇类物质体积分数及复配的其他有效成分密切相关,因此疫情期间各主管部门发布的文件都对醇类消毒剂产品中的有效成分含量做出了明确规定 [2] [3] 。
随着国内外疫情的持续发展,市场对于各类消毒剂需求的显著增加,手部消毒剂产品快速迭代并衍生出了多个新品类,就配方而言,除了传统的单方醇类消毒液外,目前已有多种含乙醇和正(异)丙醇复配消毒剂上市销售 [4] ;就剂型而言,除了传统的消毒液、消毒喷剂外,还出现了免洗手消毒凝胶和免洗消毒膏等产品,这类消毒剂多数以消毒凝胶或膏体等形式存在,它们都以凝胶为载体,均匀附载一种或多种消毒成分,由于这类产品具有免洗、应用方便,性质稳定,而且在使用过程中不易洒漏、存储期间低挥发性等特点,在一定程度上丰富和扩展了醇类消毒剂的应用场景。然而彼时借疫情期间紧急上市的醇类手消毒剂产品中难免存在产品质量良莠不齐 [5] 等问题,因此导致的消毒剂含量不足可能引发潜在的耐药性等安全风险甚至出现假冒伪劣产品 [6] 等,逐渐引起公众的普遍关注。
此前已有的标准方法多数仅适用于单方液态醇类消毒剂,对于标准限定范围以外的新剂型和复配醇类消毒剂等较复杂样品中效成分的测定时,如直接使用上述方法往往测试效果不尽理想,其中主要有比重法和气相色谱法,前者显然无法直接用于测定凝胶类样品,而后者操作耗时费力不利于分析通量的提升。已有文献 [7] [8] 中规定了消毒剂中乙醇含量的测定方法,气相色谱法采用玻璃填充柱和外标法进行测定,由于填充柱目前在气相色谱检测的应用已经非常有限,醇类消毒剂的气相色谱检测多采用毛细管柱进行,故填充柱法并无实际的应用案例可循;比重法仅适用于快速测定只含乙醇和水的溶液 [9] 。关于固体、半固体消毒剂中乙醇含量测定已有蒸馏法 [10] ,但该法既显著增加了操作过程的复杂程度,又因方法耗时费力而不利于分析通量的提升。此外还有研究者尝试使用甲醇作为溶剂测定醇类消毒剂中乙醇的含量,测试效果也较可靠,但该法使用的甲醇溶剂将直接干扰甲醇残留量的判断,因而并不完全适用 [11] 。
以上这些新情况都凸显了对于醇类消毒剂中的有效成分及可能存在的禁用添加剂同时进行准确测定的重要性。因此亟需建立一套操作简便、结果准确的新方法体系并根据样品给出适配的检测方法,以满足由于醇类消毒剂产品迭代给后续分析检测工作提出的新要求。建立的成套方法对于生产企业的原料核查、生产内控及市场监管等阶段也具有一定的参考意义。
2. 材料与方法
2.1. 试剂和仪器
甲醇(99.9%,上海麦克林有限公司);乙醇(99.5%,河北百灵威有限公司);正丙醇(99%,上海麦克林有限公司);异丙醇(99.5%,上海麦克林有限公司);正丁醇(≥99.7%,阿拉丁试剂有限公司);1,2-丙二醇(≥99.7%,阿拉丁试剂有限公司);1,3-丙二醇(≥99.7%,阿拉丁试剂有限公司);丙三醇(≥99.7%,阿拉丁试剂有限公司);无水乙醇(分析纯AR,安徽安特股份有限公司);超纯水(Milli-Q,电阻率18.2MΩ·cm,美国Millipore公司)。
万分之一电子天平(感量0.1 mg,瑞士Mettler Toledo公司);涡旋混匀器(MS3 basic,德国IKA公司);超声波清洗器(KMDOS,上海科超有限公司);多功能循环恒温水浴(HWY-10上海昌吉地质仪器有限公司);数字密度仪(DMA 4501,奥地利AntonPaar公司);iS50 FT-IR傅里叶变换红外光谱仪(15~27,000 cm−1之间分辨率优于0.09 cm−1,美国ThermoScientific公司) Agilent气相色谱仪,配氢火焰离子化检测器(FID) (7890A,美国Agilent公司),配HP-INNOWAX色谱柱(HP-INNOWAX 30 m × 0.320 mm × 0.5 μm、HP-INNOWAX 60 m × 0.320 mm × 0.5 μm)及顶空进样器(PETuboMatrix 40 Trap,美国Perkin Elmer公司);载气及驱动气均为高纯氮(市售,≥99.999%)。
2.2. 测试条件
2.2.1. 气相色谱条件
色谱柱HP-INNOWAX 60 m × 0.320 mm × 0.5 μm,载气为高纯氮,载气保持恒定流速1 mL/min,进样口温度230℃,样品进样量0.2 μL,分流比30:1,程序升温初始值40℃保持7 min,以每分钟60℃升温至220℃并保持10 min,检测器230℃,氮气30 mL/min,氢气30 mL/min,空气流速300 mL/min。升温程序结束后以40℃初温后运行5 min后准备下一进样。
2.2.2. 顶空法测试条件
顶空样品瓶炉温90℃,样品平衡时间30 min,进样针温度95℃,取样体积1.0 mL,加压时间2 min,进样时间0.05 min,拔针时间0.2 min,进样压力45 psi。传输线温度150℃,进样口温度230℃,分流比10:1,其余色谱条件参照2.2.1。
2.2.3. 密度仪法测试条件
密度仪经空气校准和水标定后,将单方乙醇消毒剂样品小心注入密度仪,并确保注入的样品无气泡引入,待样品降至20℃时可直接读取密度值,取3次稳定测量的数据进行曲线拟合,用拟合曲线计算样品中的乙醇含量。
2.3. 色谱条件预实验及理论计算
2.3.1. 预实验及现有方法相关参数分析
现有方法文本所列色谱条件汇总于表1,为筛选潜在的参考方法配制含甲醇、异丙醇、乙醇、仲丁醇、正丙醇、异丁醇、正丁醇的分离度验证溶液,在各色谱条件下分别进样分析,预实验选用Agilent HP-INNOWAX (30 m × 0.320 mm × 0.5 μm)色谱柱,载气为高纯氮,载气保持恒定流速1 mL/min,进样口温度230℃,分流比30:1,样品进样量、标准曲线建立方法和色谱柱程序升温详见表1,检测器温度为230℃,氮气30 mL/min,氢气30 mL/min,空气300 mL/min。直接进样的色谱图见图1,根据色谱图可得,方法1和方法3所列填充柱主要色谱条件完全一致,鉴于目前已鲜有实验室配备填充柱,相关的应用也极少,暂用毛细管柱在上述方法所示条件下的分离结果代替,色谱图如图1(a(b))图中可见毛细管柱上试验时分离度极差,故不再进行后续条件试验;而方法2 [图1(a(a))]和方法4 [图1(a(c))]所列毛细管柱色谱谱法所分离度较优,适合作为后续方法开发的参照。
以顶空法为例,优化后的色谱条件典型色谱图见图1(b(b)),其中图1(b(a))为四种目标物与内标物谱图,图1(b(c))与图1(b(d))分别为2种含凝胶样品的典型色谱图分离度验证溶液见图1(b(b)),由图中可得,优化后的色谱条件峰型对于上述目标物均可实现较优的基线分离度且单样分析时间较为合理,适用于实际样品分析。
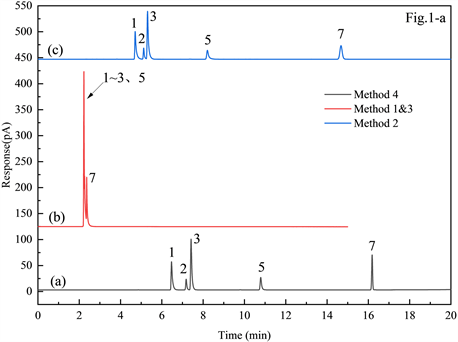
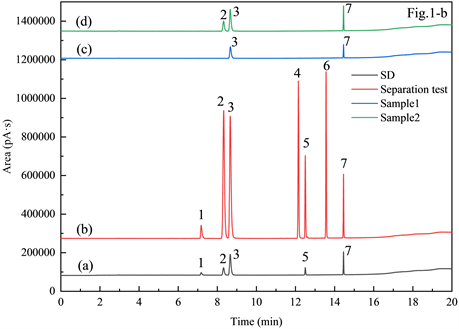
Figure 1. A chromatogram comparison of the existing method versus post-optimized method. In which: 1. Methanol; 2. Isopropanol; 3. Ethanol; 4. Sec-butanol; 5. n-propanol; 6. Isobutanol; 7. n-Butanol
图1. 现有方法与经方法优化后的色谱图比较。其中:1. 甲醇;2. 异丙醇;3. 乙醇;4. 仲丁醇;5. 正丙醇;6. 异丁醇;7. 正丁醇

Table 1. GC chromatographic condition of methods that is currently available
表1. 现有方法的色谱条件
2.3.2. 气相色谱进样口样品膨胀体积的估算
由于一般乙醇消毒剂的含醇量普遍较高(约为60 V/V%~80 V/V%),色谱法无法直接进样测定,在实际检测时需要用去离子水稀释样品后才可进样分析,因此实际用于进样的样品是含有醇类的水溶液。由2.3.1中表1可知,已有方法的色谱条件下由于忽略了样品水溶液在进样口的膨胀体积已超过一般气相色谱用衬管的容积(一般约为900 μL,衬管负荷应小于75% [12] ),故应用这些条件进样时,进样口在进样瞬间将处于过载状态,而这将导致样品蒸汽逆流损失使得数据准确度降低。作者所在实验室日常检测过程中也时有发生因方法缺陷致使分析数据异常的情况,实际检测时样品溶剂蒸汽体积Vg可根据公式(1)进行估算 [13] 。
(1)
(1)式中:A:样品溶剂密度(g/mL)/溶剂分子量(g/mol);B:15/(15 + 色谱柱头压[psi]);C:(进样口温度[℃] + 273)/273;I:液体进样体积(μL)。
根据(1)式估算了含醇手消毒剂配方中可能出现的有效成分、辅料和杂质在进样口230℃,柱前压为15 psi,进样量1 μL时各物质估计膨胀体积比汇总于表2,其中沸点、密度和相对分子质量引自文献 [14] 。
根据表2的膨胀体积估算结果可知,若要在上述条件下应用直接液体进样法分析醇类物质,且要同时保持样品膨胀体积≤75%衬管容积,则样品的进样量应控制在0.3 μL以下。
2.3.3. 含凝胶样品直接进样法数据稳定性的潜在影响因素
根据作者所在实验室的日常检测和前期调研,目前应用于醇类消毒剂的凝胶类物质主要是卡波姆和透明质酸钠,其中卡波姆(Carbopol)是丙烯酸键合烯丙基蔗糖或季戊四醇烯丙醚的高分子聚合物。作为一种新型的高分子材料和优良的药用辅料,它已在制剂领域已有广泛的应用 [15] [16] [17] 。透明质酸钠是一种天然直链多糖,由(1→4)-β-D葡萄糖醛酸和(1→3)-2-乙酞氨基-β-D-葡萄糖结合而成的双糖结构单元所组成的高分子聚合物 [18] 。根据这两种物质的结构式(图2(c))可知由他们组成的高分子聚合物上应含有较多的羟基、亚胺、酮和醚等官能团。

Table 2. An estimated expansion volume of the solvent in sample after vaporization
表2. 样品中溶剂气化后的膨胀体积估算
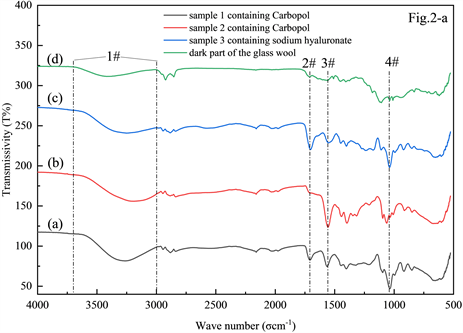
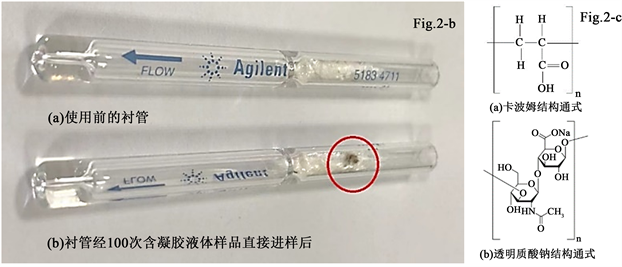
Figure 2. Structural and infrared spectra of hydrophilic thickener found in gel-containing samples
图2. 含凝胶样品中常见增稠剂的结构通式及其红外光谱图
作为消毒剂中凝胶的主要成分,这类物质在进样过程中残留在进样口衬管的玻璃棉上,并伴随进样过程而逐渐积累,而且由于其自身的不挥发特性及附带的额外醇羟基等活性基团的存在,而对后续进样的峰型和定量结果造成影响。对于这一问题,我们考察了一根应用于凝胶类乙醇消毒剂样品直接液体进样约100次后的衬管玻璃棉(扣背景后)上的深棕色残留物质及三个含凝胶样品在230℃下烘干48 h的实际样品残留物分别进行红外光谱扫描,结果如图2(a),衬管使用前后外观对比见图2(b),结构通式见图2(c)。
图2(a)中可见1#峰较宽,3000~3600 cm−1属于O-H键的伸缩振动峰,据此可推断衬管中的主要残留物可能含有丰富的羟基;2#峰1700 cm-1附近来自饱和脂肪酮的振动吸收峰;3#峰1560 cm−1附近主要由亚胺基上C-N键的弯曲振动贡献,4#峰1090~1020 cm−1附近主要来自脂肪胺类物质C-N键和醚C-O键的伸缩振动。综上可知,所得红外光谱结果均符合上述两种凝胶残余物的红外光谱特征。
因此如果选用直接液体进样,实验过程中应随时关注样品峰型变化,且进样序列不可过长,建议每个序列每个批次每批实验完成后都应重新更换衬管和隔垫,以免造成不同批次数据的批间差异。
2.3.4. 醇类物质含量的计算公式
现有标准 [7] [8] [10] 给出的计算公式均只适用于含乙醇水溶液产品,对于含凝胶的醇类消毒剂中的醇类物质含量计算暂未见诸报道,因此补充了公式(2)~(4),经验证(2)式和(3)式对单方、复配醇类消毒剂及含凝胶的醇类消毒剂剂型均适用,(4)式用于内标法涉及的校正因子计算 [19] 。
(2)
(3)
(4)
(2)~(4)式中:
:目标物的体积百分数
:目标物的质量百分数,Ci:经外标法或内标法计算的试样中各醇类物质含量(mg/L);V:样品定容体积(mL);
:原始样品在20℃下的密度(g/cm3);m:试样中的样品称样量(g);
:各醇类物质在20℃下的密度(g/cm3);fi:各醇类物质的相对校正因子;mi:校正曲线测试时校正样中各醇类物质标品的称样量(g);mBu:校正曲线测试时校正样中正丁醇标品的称样量(g);Ai:校正曲线测试时校正样中各醇类物质标品的峰面积;ABu:校正曲线测试时校正样中正丁醇标品的峰面积。
3. 结果与讨论
3.1. 初筛方法
单方乙醇消毒剂成分一般比较简单,主要由乙醇和去离子水经简单混合而成。对于不同浓度的乙醇水溶液,可先测定样品密度再查表 [20] 确定其中乙醇的体积分数(V/V)%。为验证不同浓度的乙醇水溶液实测密度与乙醇体积百分比之间的相关关系,使用市售无水乙醇和纯水配置如表3所示乙醇水溶液浓度系列,通过所得数据建立的拟合模型反推其中乙醇的体积分数(V/V)%并与气相色谱法的测定结果进行交叉比对并分别计算相对偏差,结果列于表3,拟合曲线见图3(a)。
由表3可知对于单方乙醇消毒剂而言,通过密度仪测定的密度数据与查表给出的乙醇密度相对偏差<1%,根据建立的数学模型反推得到的乙醇查表所得的乙醇的体积比(V/V)%与经气相色谱法测定结果的相对偏差也<1%,以较高精度确认了通过密度法测定单方乙醇消毒剂中乙醇的体积比(V/V)%的精密度和准确度满足常规检测的需求。经实际样品验证应用该拟合曲线初测126批次单方乙醇消毒剂样品时,预测结果与实际气相色谱法测定结果存在2.4%~9.8%的相对偏差,平均偏差为5.2%,模拟样品测定与实际样品初测之间存在平均5.2%的相对偏差,可能原因包括但不限于不同厂商潜在的表外添加剂、去离子水纯度影响及实验期间的密度测定误差等。总之,密度法尽管存在一定的偏差,但仍可作为单方乙醇消毒剂中乙醇体积分数(V/V)%的快速初筛方法并根据密度测定值,大致预判样品中醇类物质的含量区间,实际样品拟合曲线见图3(b),模拟样品和实际样品的拟合函数及其反函数结果见表4。
3.2. 气相色谱仪器测定方法
3.2.1. 标准曲线系列的配置
在万分之一天平上分别准确称取甲醇、正丙醇、异丙醇标准品各约1.0 g、正丁醇约0.5 g,乙醇约4.0 g分别至于已事先加入约30 mL去离子水的不同的50 mL容量瓶中,初步摇晃使各单物质标准溶液溶解后分别用20℃去离子水定容至50.00 mL刻线,得到含有上述各单一物质的储备液,再次混匀后备用,使用时,根据样品中各物质含量,合理设置各分析物的标准曲线浓度点。上述单物质溶液可在4℃冰箱稳定保存2个月。

Table 3. Comparison of quantitative results between density method and gas chromatography method for unilateral ethanol disinfectant
表3. 单方乙醇消毒剂密度法和气相色谱法定量结果比较
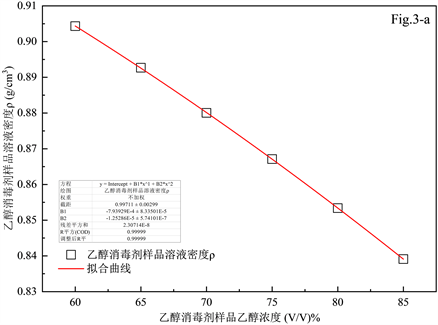

Figure 3. The data fitting results of simulated samples and real samples
图3. 模拟样品与实际样品的数据拟合结果

Table 4. Data fitting functions and their inverse functions
表4. 数据拟合函数及其反函数
3.2.2. 样品前处理
1) 对于有效成分检测时,在万分之一天平上准确称取约1.0 g样品于预先装有约50 mL去离子水的100 mL容量瓶中,2) 对于甲醇杂质成分的检测,样品称样量应为5.0 g,称样时样品应直接滴入去离子水中,尽可能避免沾到容量瓶内壁,否则应立即用去离子冲入容量瓶中,应用内标法时还应按照要求称取相应质量的内标物质详见2.2.4,空白试验同法测定,样品应平行测定2份,称样量均精确至±0.2 mg。样品经初步混合后再加入去离子水至100 mL容量瓶的刻线下方并密塞,将容量瓶置于恒温水槽中,待容量瓶中的样品溶液液温平衡后再用恒温至20℃的去离子水定容至刻线并在涡旋混合器上经3000 r/min涡旋1 min,此后将容量瓶置于20℃恒温水浴的超声清洗器超声分散10 min后再次混匀样品溶液置于恒温水槽中备用。
3.2.3. 直接液体进样
3.2.2中样品用0.22 μm微孔滤膜过滤,并弃去前1 ml初滤液,取续滤液装入样品瓶加盖密封,仪器条件设置见2.2.1,实验过程中样品所在区域也保持20℃恒温;
3.2.4. 顶空进样
用经20℃热平衡后的10 mL单刻度移液管准确移取10.00 mL样品溶液于预先加入0.1 g分析纯NaCl的20 mL顶空瓶后立即用封口钳将顶空瓶盖密封,顶空仪及气相色谱条件详见2.2.1和2.2.2。
3.2.5. 内标法
上述3.2.2中样品称量结束后分别再称取约0.35 g正丁醇对照品,后续定容及样品处理方法见3.2.2~3.2.4。
3.3. 方法学
3.3.1. 工作曲线、检出限和定量限
使用选定的色谱条件分别测定空白溶液和2.3.3中配制的阴离子标准溶液稀释系列,根据连续基线噪音和标准曲线第一点各离子的峰高分别计算方法检出限和定量限,其中方法检出限为3倍空白溶液的标准偏差(S/N = 3),定量限为10倍的空白溶液的标准偏差(S/N = 10),各离子的工作曲线、相关系数、检出限和定量限如下表5所示。
根据表5可知,优化后的直接进样气相色谱法即使将进样量降至表1所示标准方法的1/3以下(0.3 μL)时,计算得到的方法检出限仍然能与标准方法或此前文献报道方法处于同一水平,显示出本法提出的上述色谱条件具备良好的实际应用效果。

Table 5. Operating curve, Limit of detection and Limit of quantitation
表5. 工作曲线、检出限和定量限
(1) 注:表中所列顶空–气相色谱法(外标法)使用在GC-MS仪器加装的GC-FID数据工作站,故积分所得响应值、积分结果所代表的物理意义与直接进样(外标法)所用FID的信号强度不一致,所得工作曲线斜率不同由换算基准差异造成,并不直接反映该FID检测器对目标物的响应差异。
(2) 注:本列检出限数据系文献报告值代入2.3.4式(2)并按照本法的取样和稀释倍数换算后的等效值,前缀(E)表示外标法,(I)表示内标法。
3.3.2. 精密度
如2.3.4所示,通过向超纯水中加入不同质量的醇类物质及杂质对照品的储备溶液,制成相当于各自标准曲线20% (低)、50% (中)和80% (高)浓度的模拟加标样品连续测定6次(n = 6),所得结果计算相对标准偏差(RSD%),得出低、中、高浓度的精密度,结果均在5%以内,如下表6所示。

Table 6. Standard precision of different analytes
表6. 不同分析物精密度
(1)注:同表5 (1)注。
根据表6可知,4种方法六次重复进样的峰面积或校正因子的RSD%在0.1%~3.8%之间,其中,内标法的精密度数据显著地优于外标法,对此我们认为原因主要是自动进样器无法保证每次的进样量完全一致,若可接受的RSD%在5%以内,则上述4种方法均可使用。表中可见顶空进样的内标法的校正因子要大于直接进样的内标法,可能原因是内标法的进样过程与外标法不一致,直接进样时,包括内标物在内的所有醇物质在进样口的气化过程无歧视效应,而顶空进样时由于各种醇类物质的沸点不同,故沸点最高的正丁醇挥发量因显著低于甲醇、异丙醇和正丙醇,因此顶空进样的响应因子要高于直接进样。
3.3.3. 加标回收率
如2.3.4所示通过向空白样品中加入不同质量的阴离子混合储备溶液,制成低、中、高浓度的阴离子溶液加标样品,根据加入阴离子标准溶液的质量浓度,计算阴离子的加标回收率,所得加标回收率在97.2%~101.7%之间,实验数据如下表4所示。
从表7可得异丙醇、乙醇、正丙醇三种有效成分和杂质甲醇的加标回收率在95.7%~101.7%之间,加标回收率验证结果满意,从数据准确度而言,内标法相对于外标法更具优势。
3.4. 优化的日常检测工作流程
为了定量说明上述4种测定方法适用的场景根据此前实验获得的数据,编制表8,其中制样所需时间的估算过程如下:每次测定5个不同样品,每个样品称取2份平行样,色谱仪器维护、色谱柱更换时间以10 min计,另需配制一条包含6个点的标准曲线,其他操作参见4.2节,由于所建立的方法色谱运行时间基本一致,故分析时间不列入比较范围。

Table 7. Precision of different anion labeling experiments in ultrapure water
表7. 超纯水中不同阴离子加标实验的精密度

Table 8. Characteristic parameter of the four proposed methods
表8. 四种测定方法的特性参数
对表8中对应列数据用最值归一化方法处理,所得数据汇总于表9,计算公式见式(5)。
(5)
(4)式中:
:表7中选定列第i行参数归一化后的赋值;xi:表7中选定列第i行的值;xmin:表7中选定列数据的最小值;xmax:表7中选定列数据的最大值。
根据表9数据可知,外标法的归一化总分也都比内标法高,意味着外标法的数据精度略逊于内标法,为校正这种定量方法引入的偏差,必须引入内标物做相应的校正,因此我们在日常检测过程中推荐如图4的检测工作流程供参考。

Table 9. Normalized scores of the four proposed methods
表9. 四种方法的归一化得分
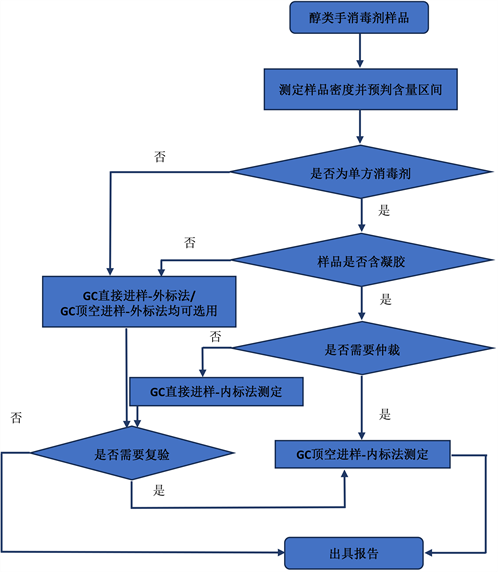
Figure 4. Recommended inspection workflow
图4. 推荐的检测工作流程
4. 结论
因现有测试方法数据精密度欠佳的原因,本文在此基础上进行系统地分析,提出了含醇手消毒剂中醇类物质有效成分及其中有害杂质的成套的新测试方法,实现在低于传统方法进样量时对于异丙醇、乙醇、正丙醇三种表内有效成分和一种有害杂质甲醇的同时测定,且方法检出限基本处于同一水平。针对含醇手消毒剂的新剂型,提供了4种备选方法,并分别对各方法的线性、精密度加标回收率做了详细验证,结果显示对于一般应用,4种方法的准确度均符合要求,其中内标法的准确度优于外标法,显示内标法有望作为仲裁方法。此外还在实验基础上对GB 26373《乙醇消毒剂卫生标准》的计算公式做了增加,新增的公式可以完全覆盖含醇手消毒剂的所有剂型。并且进一步提出了含醇手消毒剂检测工作的推荐工作流程。总之,优化后的方法组合可以满足含醇手消毒剂中有效成分及其中有害杂质的分析测定需求,检出限基本相当于或优于现有方法,可为日常检查提供有益的参考。
基金项目
浙江省市场监督管理局科技计划项目(ZC2023045)。
参考文献
NOTES
*通讯作者。