1. 引言
栀子(Gardenia jasminoides Ellis)是茜草科的一种常绿灌木,叶子嫩绿,花香浓郁 [1] 。
在我国用做中药材历史悠久,其主要产于湖南、江西、湖北、浙江及福建等地,系湖南产地道药材之一。其味苦性寒,主归心、肺、三焦经,具有泻火除烦,清热利尿,凉血解毒等功效,临床广泛用于热病心烦,黄疸尿赤,血淋涩痛,血热吐衄,目赤肿痛,火毒疮疡等证 [2] 。
现代研究表明,栀子主要含有环烯醚萜类[如去乙酰车叶草酸甲酯(deacetyl asperulosidic acid methylester, DAAME)、栀子苷等]、萜类(如西红花苷I、西红花苷II、苦番红花素等)、黄酮类(如芦丁等)、三萜类等成分 [3] ,具有抗炎、调节免疫、抗氧化、治疗心血管系统疾病等药理作用 [4] [5] 。有研究表明,不同叶果型栀子植株果内栀子苷和西红花苷含量存在显著差异,而且同一栽培群体中的栀子植株存在着丰富的遗传多样性 [6] 。
基于内部简单重复序列(inter-simple sequence repeats, ISSR)是一种显性分子标记,具有较高的多态性、重复性、稳定性且操作简便等诸多优点,已广泛应用在埃及小麦(Egyptian wheat)、硬粒小麦(Triticum durum)、钩刺山羊(Aegilops triuncialis)、大麦(Hordeum vulgare)等小麦及野生近缘属种的遗传多样性研究 [7] 。
本实验以湖南长沙宁乡33份山栀优良株系为研究对象,建立ISSR-PCR反应体系,通过NTSYS软件和PopGen软件进行聚类分析和遗传多样性分析。本研究利用ISSR标记分析湖南宁乡山栀遗传多样性,为湘山栀优良新品种选育提供科学依据。
2. 材料与方法
2.1. 仪器与试剂
2.1.1. 仪器
PCR仪;电泳仪;Bio-Rad凝胶成像系统;离心机;专用纯水机。
2.1.2. 试剂
植物基因组DNA提取试剂盒(艾科瑞生物工程有限公司);引物(生工生物工程股份有限公司合成);琼脂糖;核酸染料GelGreen;PCR试剂盒(艾科瑞生物工程有限公司)。
2.2. 试验材料
以湖南长沙宁乡33份山栀优良株系为试验材料,采集健康幼嫩叶片若干(挂标签标记该采样植株),迅速装入塑料自封袋,带回实验室,置于−80℃超低温冰箱保存,供DNA提取用。采样点为湖南省长沙市宁乡喻家坳乡涌泉山村(112˚14'23E~112˚22'43E;28˚9'25N~28˚17'14N),样品隶属于华中(HZ)居群。
2.3. 提取方法
2.3.1. DNA提取
按照SteadyPure植物基因组DNA提取试剂盒说明书的步骤提取山栀嫩叶的DNA:将新鲜的山栀嫩叶样本进行液氮研磨,并磨好的样本粉末转移至1.5 mL离心管中,然后向其中迅速加入500 μL的Buffer LS-3和10 μL的50 × DTT Buffer,再加入10 μL的RNase A,振荡混匀。使离心管于56℃均匀受热,10 min。
加入62.5 μL (Buffer LS-3的1/8体积)的Buffer PA充分混匀,冰上放置5 min,12,000 rpm离心5 min,取上清,加入与上清等体积的Buffer BS-2,充分混匀。
转移至Plant DNA Mini Column中过柱(注意每次过柱的体积量不要超过750 μL),室温静置1 min后,室温下12,000 rpm离心1 min,弃滤液;加入500 μL的Buffer WA,12,000 rpm离心1 min,弃滤液;加入750 μL的Buffer WB,12,000 rpm离心1 min,弃滤液;再次加入750 μL的Buffer WB,12,000 rpm离心1 min,弃滤液;将Mini Column安置于新的2 mL Collection Tube上,12,000 rpm离心2 min。
将Mini Column安置于新的1.5 mL 离心管上,在Mini Column膜的中央处加入50 μL的Elution Buffer,室温静置2 min,然后12,000 rpm离心2 min洗脱DNA;为获得更大收量重复洗脱一次。
注意:
尽量使用新鲜的实验材料,以确保提取的基因组DNA不被降解,长时间保存的样本置于−80℃保存;
Buffer WB在使用前已经加入了63 mL的100%乙醇;
洗脱时,将Elution Buffer加热至50℃~65℃使用,以提高洗脱效率。
2.3.2. ISSR-PCR反应
利用PCR仪,使用相同材料作为模板对不同的ISSR引物进行筛选,得到扩增条带清晰,利于进行后续遗传分析的引物。再以湖南长沙宁乡山栀优良株系的DNA为模板,选取最佳退火温度56.3℃和20 μL的反应体系:0.35 μL Accurate Taq DNA Polymerase (5 U/μL),2.8 μL浓度为25 mmol/L的Mg2+,1.6 μL浓度为2.5 mmol/L的dNTPs,1 μL浓度为10−2 mmol/L的引物,1 μL的模板DNA,2 μL的Buffer溶液,最后添水至20 μL。ISSR-PCR的扩增程序为94.0℃、1 min;98.0℃、10 s;56.3℃、15 s;68.0℃、2 min,共35个循环,最后4℃保存。反应产物ISSR采用1.2%琼脂糖凝胶电泳,1 × TAE缓冲液,120 V跑胶40 min。电泳结束后紫外凝胶成像系统下观察拍摄,并保存。
2.3.3. 数据分析
采用NTSYS软件和PopGen软件进行聚类分析和遗传多样性分析。
3. 结果分析
3.1. DNA提取质量检测
用琼脂糖凝胶电泳检测其DNA浓度,电泳图单一条带且无明显拖带(图1),说明提取的DNA质量较好,可用于ISSR标记。
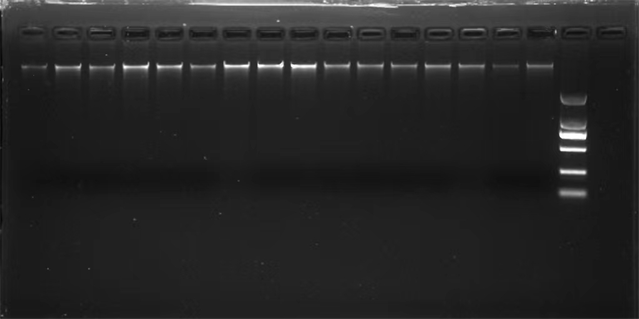
Figure1. The quality of extracted DNA
图1. DNA提取质量检测图
3.2. ISSR引物筛选和最优体系
使用118号材料对U801-U900共100条ISSR引物进行筛选,最终选出扩增条带清晰、多态性明显、重复性小的U840作为后续试验中的ISSR引物,引物序列及结果见表1。每个引物扩增出的DNA条带范围为0~5条,扩增产物长度介于100~2000 bp (图2),以250~2000 bp的扩增条带居多。

Table 1. Primers and amplification results
表1. 引物及扩增结果
备注:5’→3’,其中N = (A, G, C, T),R = (A, G),Y = (C, T),B = (C, G, T) (I.e.notA),D = (A, G, T) (I.e.notC),H = (A, C, T) (I.e.notG),V = (A, C, G) (I.e.notT)。

Figure 2. Analysis of amplification results
图2. 扩增结果图
经过对PCR最优体系的探寻,ISSR-PCR反应体系确定为(20 μL):模板DNA 30 ng;Mg+ 3.5 mmol/L;dNTPs 0.2 mmol/L;引物0.5 μmol/L;TaqDNA聚合酶1.75 U。选取最佳退火温度56.3℃。
在操作时需向体系中添加:0.35 μL Accurate Taq DNA Polymerase (5 U/μL),2.8 μL浓度为25 mmol/L的Mg2+,1.6 μL浓度为2.5 mmol/L的dNTPs,1 μL浓度为10−2 mmol/L的引物,1 μL的模板DNA,2 μL的Buffer溶液,添水至20 μL。ISSR-PCR的扩增程序为94.0℃、1 min;98.0℃、10 s;56.3℃、15 s;68.0℃、2 min,共35个循环,最后4℃保存。
3.3. 遗传差异
采用PopGen 1.32软件进行遗传差异分析,得到表2,从表中可看出,33份栀子种质资源的Na、Ne、H和I的值分别为1.3333、1.1589、0.0974、0.1512,说明本次实验材料的遗传多样性与代表性较低,这与本次采用的优选栀子取材地相同的情况比较一致。

Table 2. Primers and amplification results
表2. 引物及扩增结果
从不同条带来看,等位基因数(na)的范围是1.0000到2.0000,平均值为1.3333;有效等位基因数(ne)的范围是1.0000到1.7835,平均值为1.1589;Nei’s遗传多样性指数范围是0.1453到0.4393,平均值为0.0974;Shannon’s多态性指数(I)的范围是0.2760到0.6312,平均值为0.1512。
3.4. 聚类分析
选用U840作为引物对本实验中33份山栀优选样品DNA进行PCR扩增,扩增结果如图3所示。
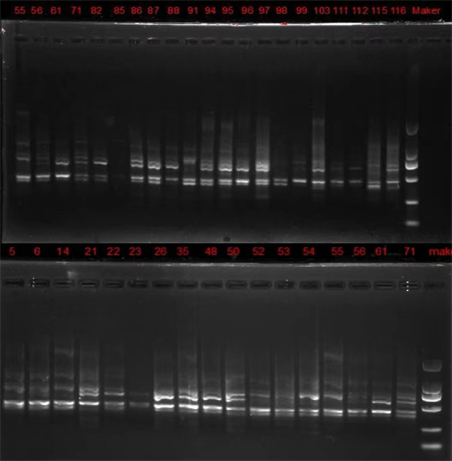
Figure 3. Amplification results of high-quality gardenia under optimal system
图3. 最优体系下优选栀子扩增电泳图

Figure 4. Results of the SAHN cluster analysis
图4. SAHN聚类分析结果图
从图3中可以看出,33个优选样品的NDA在500 bp和750 bp长度含量最高、1000 bp长度次之(除85号栀子效果较差);少部分优选样品含有长度为2000 bp的DNA (如14号、35号、55号、94号、95号、103号);没有优选样品含有长度为100 bp或200 bp的DNA。图像有些许拖带的原因可能是电压不稳或TAE缓冲液污染。
采用NTSYSpe2.1软件对33份优选样品进行SAHN聚类分析。从图4中可以看出,所有栀子样本在阈值0.65处分为两支,其中98号优选栀子和其他栀子相似系数最小,单独成一支。其他的优选栀子样品聚为一支,在这一支中于约0.695处分为两个姊妹支,其中112号优选栀子单独成一支,其余优选栀子成一大支。这一大支在阈值0.83处分为两支,这两只各自在遗传系数为0.862和0.894左右处再次分出两亚支。
4. 结论与讨论
本研究以湖南长沙宁乡的优质栀子为材料,采用ISSR分子标记方法对其种质进行分类,通过NTSYS和POPGEN软件对其进行遗传多样性分析:POPGEN分析结果显示同一居群的山栀单株遗传多样性并不大,这与焦雁翔等 [6] 采用叶果型分析得出的同一栽培群体遗传多样性丰富的结果不一致。这可能是因为叶果型关注地仅仅为整体植株的某个或某些性状特征,而分子标记是基于整体植株遗传水平的分析;聚类结果显示可将优选栀子划分为两类,98号独成一支,其余33株虽然聚为一大类,但112号相对而言遗传距离远一些。这些聚类结果可以为后续选择亲缘关系远的亲本作为参考依据,同时也说明分子标记可以较为精准地实现各试材的亲缘鉴别。
利用遗传距离远的种质作为亲本来产生性状更好的杂交品种对良种选育很有帮助,在传统的栀子育种中,常采用形态、物理和化学性状进行分析,而分子标记手段不受环境、植物生理状态等因素的影响,具有较好的稳定性。本研究结果可为下一步鉴别山栀各居群间种质资源亲缘关系提供成熟技术体系,为新品种选育提供科学依据。
基金项目
湖南省大学生创新创业训练计划项目(湘教通[2022]174号);湖南省企业科技特派员计划(2021GK5006)。