1. 引言
黄连是我国常用的中草药之一,具有清热燥湿,泻火解毒的功效 [1] [2]。小檗碱亦称黄连素,它作为一种从中草药中分离出的季铵生物碱,是黄连抗菌的主要有效成分,也是一种抗微生物的药剂。小檗碱和表小檗碱是黄连药材中两种重要的异喹啉型生物碱成分,二者互为同分异构体 [3] [4]。近年来,发现小檗碱许多新的药用价值,对此,国内外学者也进行了大量的研究,小檗碱有望成为一种良好的药物,并具有广阔的应用前景。
目前,大量文献研究小檗碱的药理作用,主要侧重于研究小檗碱有效改善胃肠道功能,熊红萍等人研究了小檗碱有助于改善2型糖尿病患者胃肠激素、肠道菌群失调现象 [5]。有关小檗碱抑制作用的相关研究也有人报道,任晓凤等人研究发现,小檗碱对数种肿瘤细胞均有抑制作用 [6]。另外,郑芳昊等人采用高效液相色谱法分析测定伤科黄水中6个生物碱的含量,其中就含有小檗碱和表小檗碱 [7]。
然而,药理学研究表明,小檗碱具有抗菌、抗炎、抗高血压、抗糖尿病等药理活性 [8] [9];Li等人用实验和量子化学方法讨论了小檗碱分子结构和抑制物效果 [8] [10]。表小檗碱较小檗碱药理活性更强,其抗氧化和降血糖作用强于小檗碱 [8] [11]。此外,研究表明,小檗碱和表小檗碱两者无论在药理活性还是在体内吸收、分布等药动学特性上均存在差异和选择性 [8] [12]。小檗碱和表小檗碱的结构、紫外光谱和红外光谱特征仍需要系统研究。本文采用量子化学方法系统地研究了小檗碱和表小檗碱的结构、紫外光谱和红外光谱特征。
2. 计算方法
密度泛函理论是一种研究多电子体系的电子结构方法。本文的理论计算采用密度泛函理论(DFT)中的B3LYP方法,本文通过Chemdraw、GaussView5.0软件构建出同分异构体(化学式都为
)的小檗碱和表小檗碱的初始构型(见图1)。对于C、H、O、N原子采用了6-311G**基组,并在Gaussian09软件包中完成。本论文经过多次优化,并采用B3LYP/6-311G**对小檗碱和表小檗碱进行了频率分析,并无虚频,说明结构合理,进而得到小檗碱和表小檗碱的稳定结构,计算了小檗碱和表小檗碱的结构参数,进而比较了小檗碱与表小檗碱的区别。分子中原子的电荷分布采用的方法是自然键轨道电荷布局分析法。基于优化的结构,采用PBE0/6-311G**方法计算水溶液中小檗碱和表小檗碱的紫外光谱。因理论计算未考虑非谐效应,故根据计算方法和基组水平B3LYP/6-311G**,小檗碱和表小檗碱的红外光谱采用0.967作为频率校正因子。
3. 结果与讨论
3.1. 构型参数和能量分析
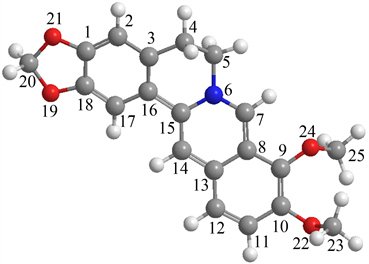 (a) 小檗碱
(a) 小檗碱 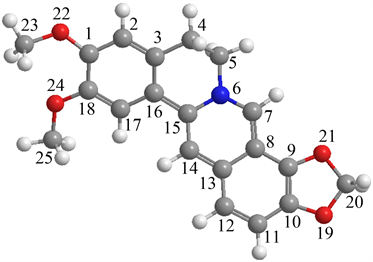 (b) 表小檗碱
(b) 表小檗碱
Figure 1. Geometric configuration of berberine and epiberberine
图1. 小檗碱和表小檗碱几何构型
通过对比经优化后小檗碱和表小檗碱的能量数据,可知小檗碱更稳定。图1为小檗碱和表小檗碱的结构式,为了便于小檗碱和表小檗碱进行比较,将主要原子按上面的顺序标记。小檗碱和表小檗碱的取代区别是两个甲氧基与亚甲二氧基的取代位置对调。

Table 1. Energy data of berberine and epiberberine at different intensities
表1. 小檗碱和表小檗碱不同多重度下的能量数据
本文分别计算了多重度为1~6的小檗碱和表小檗碱,发现多重度为2、4、6是不可能的,而多重度为1、3、5是正确的,上表列出了小檗碱和表小檗碱在1、3、5不同多重度下对应的能量数据,由表1数据可知,小檗碱和表小檗碱均以单重态、三重态、五重态的形式稳定存在,且为单重态时稳定。单重态的小檗碱比三重态的小檗碱能量低0.072 a.u. (189.036 kJ×mol−1),三重态的小檗碱比五重态的小檗碱能量低0.100 a.u. (262.550 kJ×mol−1)。而单重态的表小檗碱比三重态的表小檗碱能量低0.058 a.u. (152.279 kJ×mol−1),三重态的表小檗碱比五重态的表小檗碱能量低0.097 a.u. (254.674 kJ×mol−1)。单重态的小檗碱比单重态的表小檗碱能量低0.002 a.u. (5.251 kJ×mol−1),说明小檗碱更稳定。
3.2. 键长分析
由图2数据可知,当小檗碱的1、18位上的亚甲二氧基被甲氧基取代后,C(1)-C(18)、C(1)=C(2)、C(17)=C(18)键长变长,C(2)-C(3)、C(16)-C(17)键长变短。当小檗碱的9、10位上的甲氧基被亚甲二氧基取代后,C(8)-C(9)、C(9)=C(10)、C(10)-C(11)键长变短,C(11)=C(12)、C(8)-C(13)键长变长。
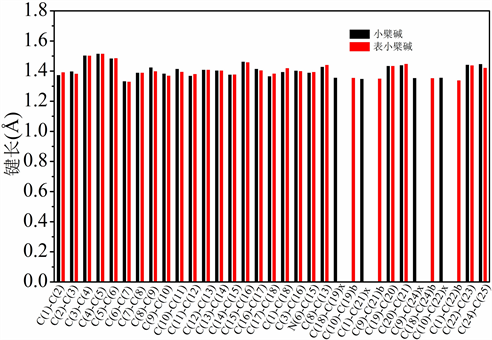
Figure 2. Bond length data between major atoms in berberine and epiberberine
图2. 小檗碱和表小檗碱中主要原子间的键长数据
3.3. 电荷分析
采用自然键轨道电荷布局分析法分析了小檗碱和表小檗碱分子中主要原子及主要原子组成六元环的电荷分布,相关数据列于图3。在讨论分析中,将C(1)-C(2)-C(3)-C(16)-C(17)-C(18)组成的六元环标记为六元环a,将C(3)-C(4)-C(5)-N(6)-C(15)-C(16)组成的六元环标记为六元环b,将N(6)-C(7)-C(8)-C(13)-C(14)-C(15)组成的六元环标记为六元环c,将C(8)-C(9)-C(10)-C(11)-C(12)-C(13)组成的六元环标记为六元环d。由图3数据可知,无论是小檗碱还是表小檗碱分子上的杂原子N、O都带负电荷。当小檗碱的1、18位C上的亚甲二氧基被两个甲氧基取代后,C(1)所带的正电荷增多、C(16)、C(17)所带的负电荷也增多,C(2)所带的负电荷减少,而C(18)所带的正电荷基本不变。当小檗碱的9、10位上的两个甲氧基被亚甲二氧基取代后,C(8)、C(11)、C(13)所带的负电荷都增多,C(9)、C(10)所带的正电荷减少,C(12)所带的负电荷也减少。相对于小檗碱的六元环a,表小檗碱的六元环a所带的正电荷增多,代表表小檗碱中六元环失去更多的电子。而表小檗碱的六元环b、六元环c较小檗碱的六元环b、六元环c所带负电荷增多,表示表小檗碱中六元环b、六元环c得到的电子增多。表小檗碱的六元环d较其在小檗碱所带的正电荷减少,说明表小檗碱的六元环d失去的电子少于小檗碱的六元环d失去的电子。可见,亚甲二氧基的吸电子能力小于两个甲氧基。
3.4. 紫外光谱分析
图4为在结构优化基础上,对水溶液中小檗碱采用TD-B3LYP/6-311G**和TD-PBE0/6-311G**方法计算的紫外光谱。前人的紫外光谱实验中小檗碱的吸收峰位于245、348和421 nm。采用TD-B3LYP/6-311G**方法计算的紫外光谱中小檗碱的吸收峰位于251、357和448 nm,采用TD-PBE0/6-311G**方法计算的紫外光谱中小檗碱的吸收峰位于242、344和424 nm。可见,采用TD-PBE0/6-311G**方法计算紫外光谱更与实验数据吻合。下面的紫外光谱数据都是采用TD-PBE0/6-311G**方法计算所得。
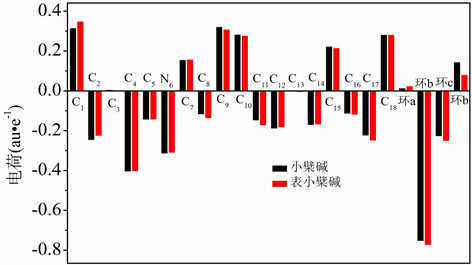
Figure 3. Charge distribution of atoms or rings in berberine and epiberberine
图3. 小檗碱和表小檗碱中原子或环所带的电荷分布
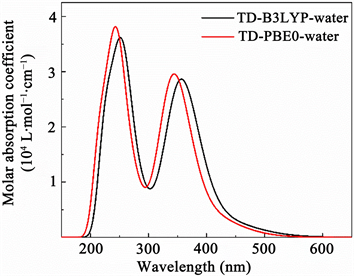
Figure 4. The UV spectra of berberine in aqueous solvent were calculated by TD-B3YP and TD-PBE0 methods
图4. 采用TD-B3YP和TD-PBE0方法计算的小檗碱在水溶剂中的紫外光谱
 (a)
(a)  (b)
(b)
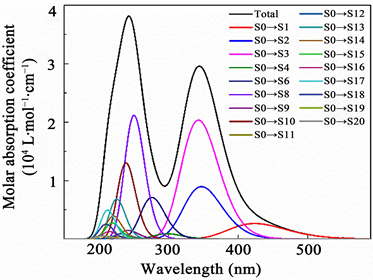
Figure 5. The UV spectra and transition contributions of berberine and epiberberine
图5. 小檗碱和表小檗碱的紫外光谱及跃迁贡献图
由图5的檗碱和表小檗碱的紫外光谱及跃迁贡献图,可知,相对于小檗碱的吸收峰243、344和424 nm,表小檗碱的吸收峰发生了红移,位于254、349和455 nm,且222 nm处出现了肩峰。进一步将小檗碱和表小檗碱的紫外光谱吸收峰位置和分子轨道跃迁对应,分析紫外光谱吸收起因。
小檗碱的243 nm处峰48.0%来自S0~S8跃迁和32.6%来自S0~S10跃迁。根据表2的激发性质和图6的分子轨道图,可知243 nm峰主要来自甲氧基上孤对电子到苯环d上的n®π*电子跃迁。344 nm处峰30.1%来自S0~S2跃迁和68.7%来自S0~S3跃迁。结合表2的激发性质和图6的分子轨道图,可知344 nm处峰主要由于杂环c和苯环d的π®π*跃迁引起。424 nm处峰60.9%来自S0~S1跃迁、15.3%来自S0~S2跃迁和23.8%来自S0~S3跃迁。根据表2的激发性质和图6的分子轨道图,424 nm处峰主要来自亚甲二氧基的p电子与苯环b组成的p-π共轭电子到杂环c和苯环d的π®π*跃迁引起。

Table 2. Excitation properties of berberine
表2. 小檗碱的激发性质
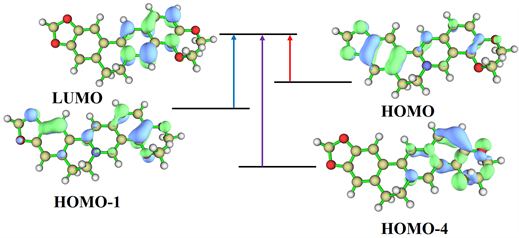
Figure 6. Molecular orbital diagram of berberine
图6. 小檗碱的分子轨道图
表小檗碱的222 nm处峰19.1%来自S0~S13跃迁、11.8%来自S0~S14跃迁、29.4%来自S0~S15跃迁和12.6%来自S0~S18跃迁。结合表3的激发性质和图7的表小檗碱分子轨道图,可知222 nm处峰主要由于p电子和苯环上的π电子组成的p-π共轭的电子跃迁引起。254 nm处峰14.8%来自S0~S6跃迁和67.9%来自S0~S7跃迁。根据表3的激发性质和图7的表小檗碱分子轨道图可推断出,254 nm处峰主要由于杂环c和苯环d的π®π*跃迁引起。349 nm处峰98.5%来自S0~S3跃迁,根据表3的激发性质和图7的表小檗碱分子轨道图可推断出,349 nm处峰主要由于苯环a和苯环d到杂环c的π®π*跃迁引起。455 nm处峰87.9%来自S0~S1跃迁、11.0%来自S0~S3跃迁。根据表3的激发性质和图7的表小檗碱分子轨道图可推断出,455 nm处峰主要来自分子骨架整体的p-π共轭的电子到杂环c和苯环d的π®π*跃迁引起。综上所述,相对于小檗碱,亚甲二氧基和二个甲氧基互换位置的表小檗碱的紫外光谱对应的分子轨道跃迁发生明显变化。

Table 3. Excitation properties of epiberberine
表3. 表小檗碱激发性质
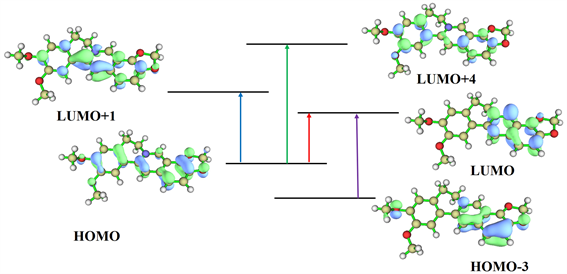
Figure 7. Molecular orbital diagram of epiberberine
图7. 表小檗碱的分子轨道图
3.5. 红外光谱分析

Figure 8. Infrared spectra of berberine and epiberberine
图8. 小檗碱和表小檗碱的红外光谱图
由图8可知,小檗碱的1476 cm−1甲氧基中C-H的面内摇摆,而表小檗碱的甲氧基中C-H的面内摇摆振动位于1491 cm−1,发生了蓝移。小檗碱红外光谱的最强峰位于1344 cm−1处,为骨架振动,而表檗碱红外光谱的最强峰也是骨架振动位于1324 cm−1处,相对于小檗碱发生了红移。小檗碱的1201 cm−1为杂环c的C-N和C-O伸缩振动,而表小檗碱的杂环c的C-N和C-O伸缩振动红移,位于1113 cm−1。小檗碱的1255 cm−1为苯环a的呼吸振动,而表小檗碱的苯环a的呼吸振动蓝移,位于1262 cm−1。小檗碱的1015 cm−1为亚甲二氧基的C-O伸缩振动,而表小檗碱的998 cm−1为亚甲二氧基的C-O伸缩振动,相对于小檗碱红移。
3.6. 偶极矩和极化率分析
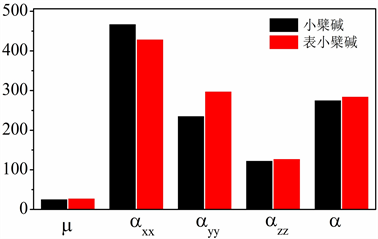
Figure 9. Dipole moment m (D) and polarization α (C×m2×V−1) of berberine and epiberberine
图9. 小檗碱和表小檗碱的偶极矩m (D)及极化率α (C×m2×V−1)
分子空间对称性强弱可以由偶极矩数值大小来衡量,进而推导至分子的极性强弱。图9是小檗碱和表小檗碱两种分子的基态偶极矩和分子极化率计算值。由图9数据可知,小檗碱的偶极矩为26.817 D,表小檗碱的偶极矩为28.594 D。相对于小檗碱,表小檗碱的偶极矩稍大。
分子的极化率是分子中原子极化、电子极化和定向极化三者因素的总和。图9列出了极化率α各个分量的计算值,根据公式α = (αxx + αyy + αzz)/3,可得到α的平均值。由图9数据可知,小檗碱的极化率为(468.752 + 236.886 + 123.865)/3 = 276.501 (C×m2×V−1),表小檗碱的极化率为(430.034 + 298.868 + 128.348)/3 = 285.750 (C×m2×V−1),表小檗碱的极化率比小檗碱的极化率大9.249 (C×m2×V−1),表小檗碱极化率数值相对大些。
4. 结论
本文系统地采用密度泛函理论方法研究了黄连药材中两种重要的异喹啉型生物碱成分小檗碱和表小檗碱,并分析了它们的紫外光谱和红外光谱特征。同分异构体中,单重态的小檗碱、表小檗碱最稳定。表小檗碱的紫外光谱相对于小檗碱,发生了红移。表小檗碱在222 nm处出现了肩峰,由来自其氧原子的p电子和苯环上的π电子组成的p-π共轭的电子跃迁引起。相对于小檗碱,表小檗碱的骨架振动、杂环c的C-N和C-C的伸缩振动红移,而苯环a的呼吸振动蓝移。与小檗碱相比,表小檗碱的偶极矩和极化率增大。
基金项目
郑州师范学院青年骨干教师资助培养计划(QNGG-211562);郑州师范学院科研启动专项经费资助(2018);国家级大学生创新创业训练计划项目(202212949002);郑州师范学院大学生创新创业训练计划项目(DCY2021031);郑州师范学院大学生科研创新基金项目(2021008)。
NOTES
*通讯作者。