1. 引言
大豆脂肪氧合酶属氧化还原性酶,分布广,廉价易得。它能催化氧化含cis,cis-1,4-戊二烯结构的多元不饱和脂肪酸及其酯得到氢过氧化衍生物,在风味物质、药物、洗涤剂、涂料、增塑剂等的合成中可作为重要的中间体 [1] [2]。LOX采用可再生的油脂资源为底物,其酶催化作用将植物油脂转化为具高附加值的产品,可以减小对石油产品的依赖,在能源短缺的今天有重要的工业意义,是值得不懈努力研究的目标。
目前对LOX下游产品的开发主要分两个方向。一方面是开发设计出具有多烯结构的非天然底物,并基于该底物对LOX酶进行分子改造,合成具有特殊用途的物质 [3] [4]。另一方面从已经开发成熟的优势底物亚油酸的产物氢过氧化亚油酸出发,经去氢得到具共轭三键的桐油类脂肪酸,或经Diels-Alder反应生成二聚酸等 [5] [6] [7]。作者前期开发了一条利用脱脂豆粕高效率合成氢过氧化油脂的工艺 [8],考虑到天然的羟基酸油脂只有蓖麻油,远满足不了市场需求,若将氢过氧化油脂进一步还原制得具有蓖麻油结构的羟基油脂,将非常有前景。
本章用亚硫酸钠还原氢过氧化玉米油制备羟基玉米油,考察了溶剂种类、浓度、还原剂用量、反应温度、时间等因素对还原反应的影响,得到一条酶–化学法绿色制备羟基十八碳二烯脂肪酸玉米油的工艺(见图1)。
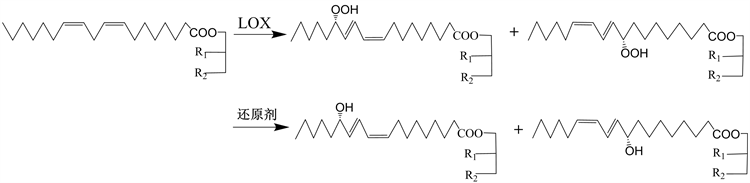
Figure 1. Preparation of hydroxy octadecadiene fatty acid glycerides by enzymatic-chemical method
图1. 酶–化学法制备羟基十八碳二烯脂肪酸甘油酯
2. 实验部分
2.1. 实验试剂与材料
大豆(东北吉林),玉米油(购于本地大润发超市);二甲酚橙(AR,上海试剂三厂);过氧化氢异丙苯(80%,Sigma);硼酸,硼砂,硫酸铵,氯化钠,氢氧化钠,氢氧化钾,亚硫酸钠,三氟化硼,酚酞,2,6-叔丁基-4-甲基酚(BHT),邻苯二甲酸氢钾(基准试剂),浓硫酸(98%),盐酸,乙醚,无水乙醇,甲醇,乙酸乙酯,正己烷,石油醚(60℃~90℃),N,N-二甲基甲酰胺(DMF),均为AR级(国药集团化学试剂有限公司)。
Shimadzu GC-2010气相色谱检测器;多功能食品粉碎机 (SQ2130D,上海帅佳电子);紫外可见分光光度计(TU-1901,北京普析通用);离心机(LD4-2,北京医用离心机厂)。
2.2. 油脂组分分析
在55℃水浴中,将1滴油脂溶解于2 mL NaOH甲醇溶液(0.5 mol/L),皂化30 min。静置冷却后,加入硫酸酸化,萃取出脂肪酸层洗至中性。将脂肪酸层与2 mL三氟化硼–甲醇溶液煮沸5 min,冷却后加入1 mL石油醚(60℃~90℃)和饱和氯化钠溶液震荡片刻,静置分层,用注射器抽出醚层作GC分析(SrAdv色谱工作站,PEG 20 M极性毛细管柱(30 m × 0.32 mm × 0.5 μm))。
2.3. 油脂酸价、皂化值分析
分别参照GB/T5530-2005测定玉米油的酸值 [9],GB/T5534-1995测定皂化值 [10]。
2.4. LOX酶催化制备氢过氧化油脂
参照文献 [7] 方法制备。
2.5. 薄层色谱分离氢过氧化油脂粗产物
展开剂A组成为甲苯:乙酸乙酯:乙醚:乙酸(75:13:10:1.2),展开剂B组成为正己烷:乙醚:甲酸(64:16:2)。取活化好的硅胶G板,用笔记下起始和终止的位置,用定容毛细管取试样点于薄板上,待溶剂挥发后,放入盛有展开剂A的玻璃密闭展开槽中,待溶剂行至4 cm处,取出薄层板晾干,再放入另一有展开剂B的玻璃槽中。展开剂行至终止处取出。待薄板展开剂挥发后,用碘显色,可见展开的氢过氧化油脂产物和反应物玉米油两点。用乙醚溶解收集的氢过氧化油脂的点,多次萃取分离后得到产物。
2.6. 亚硫酸钠还原氢过氧化油脂
称取0.5 g氢过氧化玉米油置于50 mL反应瓶中,加入适量有机溶剂溶解,边搅拌边滴加一定量亚硫酸钠水溶液。密闭、恒温、搅拌状态下反应。反应结束加入乙醚萃取(每次7 mL,萃取3次),合并萃取液。水洗、饱和食盐水洗萃取液,除去乙醚,得到还原产物。
2.7. 氢过氧化玉米油的含量分析
用二甲酚橙法测定产物中氢过氧化物的含量 [11]。样品吸光度测量值与过氧化氢异丙苯标准曲线对照求得氢过氧化物的摩尔量,并计算出氢过氧化物的得率。所有单因素分析的实验点相对误差在2%以内。
氢过氧化玉米油产率的计算公式(1)如下:
(1)
式中M玉米油为878。W代表氢过氧化物粗产品的质量。式(1)中的3代表每摩尔玉米油分子中含3摩尔脂肪酸。
3. 结果与讨论
3.1. 玉米油组分和性质分析
采用气相色谱分析玉米油中各脂肪酸含量。由表1可知,玉米油中亚油酸的含量为47.7%,还含有少许亚麻酸为1.9%,则多不饱油脂含量计49.6%。玉米油的酸价、皂化值列于见表2。根据各组分比例和皂化值、酸价计算得玉米油的平均分子量为878。

Table 2. The acid value and saponification value of the corn oil
表2. 玉米油的酸价、皂化值
3.2. 薄层色谱分离氢过氧化油脂粗产物
经二甲酚橙法分析氢过氧化油脂粗产物中氢过氧化玉米油含量为29.8%。经薄层色谱两次展开后,得到初步纯化的氢过氧化玉米油,其含量为82%。用紫外图谱分析玉米油和氢过氧化玉米油,如图2所示。玉米油中的非共轭双键在202 nm处有最大吸收,酶促反应生成的氢过氧化玉米油在230 nm左右有吸收峰,初步判断为新生成的共轭双键所形成的峰。
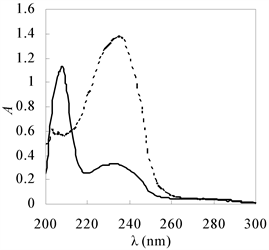 —玉米油 ﹉﹉氢过氧化玉米油。
—玉米油 ﹉﹉氢过氧化玉米油。
Figure 2. UV spectra of corn oil and its hydroperoxide
图2. 玉米油及其氢过氧化物的紫外图谱
3.3. 溶剂效应
施金金等前期采用乙醇为溶剂还原氢过氧化亚油酸,成功高产率制备了羟基亚油酸。本文中的玉米油较亚由酸在乙醇中的溶解性差很多,因此要考虑溶剂效应,选择更为合适的溶剂。选择具有代表性的DMF、乙醇和乙酸乙酯进行比较考察。结果如图3所示,DMF体积达65%时,还原产率达91.5%。乙醇为溶剂时,其体积占90%时,羟基十八碳二烯脂肪酸玉米油的产率达89%。乙酸乙酯为溶剂时,体系为两相,当乙酸乙酯体积占75%时,还原产率达89.7%。三者中DMF具有最好的溶解性,但存在成本高、毒性大的缺点,所以进一步比较乙醇和乙酸乙酯两种溶剂的表现。
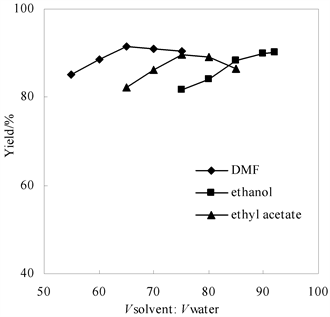 n (-OOH):n (Na2SO3) = 1:1, 2 h, 10˚C.
n (-OOH):n (Na2SO3) = 1:1, 2 h, 10˚C.
Figure 3. Effects of solvent type on the reducing reaction
图3. 溶剂对还原反应的影响
3.4. 时间对还原反应的影响
考察在乙醇和乙酸乙酯两种溶剂体系中,羟基十八碳二烯脂肪酸玉米油还原反应的时间进程(如图4所示)。反应初期(30 min以内),转化率随时间几乎成直线上升,乙醇体系的还原反应速度略高于乙酸乙酯体系的还原反应速度。推测是因为乙酸乙酯的两相体系传质速率没有乙醇体系快。乙醇/水体系在1.5 h时还原反应达到平衡,乙酸乙酯/水两相体系反应2 h后实现平衡,两者最终转化率接近,均达到90%。
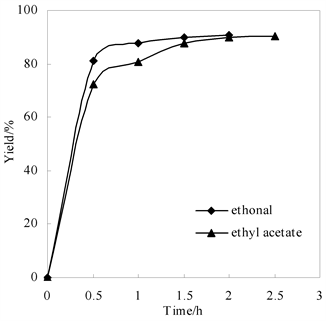 n (-OOH):n (Na2SO3) = 1:1, 10˚C
n (-OOH):n (Na2SO3) = 1:1, 10˚C
Figure 4. Effects of time on the reducing reaction
图4. 时间对还原反应的影响
3.5. 亚硫酸钠用量对反应的影响
由图5可知,还原剂亚硫酸钠用量对体系有着较大影响。当亚硫酸钠:氢过氧化玉米油脂(n:n) = 1.2时,乙醇/水体系的还原率达最高90%。对乙酸乙酯/水体系,还原剂用量为1.35时还原产率达最高。
 1.5 h,10℃,90% (v/v) 乙醇;2 h,10℃,75% (v/v) 乙酸乙酯
1.5 h,10℃,90% (v/v) 乙醇;2 h,10℃,75% (v/v) 乙酸乙酯
Figure 5. Effects of the dosage of Na2SO3 on the reducing reaction
图5. 亚硫酸钠用量对还原反应的影响
3.6. 温度对还原反应的影响
考察10℃~30℃下温度对还原体系的影响,如图6所示。对于乙醇/水体系,温度为15℃时体系还原产率达最高91%。但在乙酸乙酯/水体系中,温度为25℃时还原产率才达到最大值为90%。温度可以影响体系的传质,温度越高,传质效果越好。对乙酸乙酯/水双相体系,对传质的要求更高,所以最优温度也相对较高。虽然乙酸乙酯/水体系使用的溶剂量较少,但还原剂用量、温度时间成本却都提高了,而且乙酸乙酯没有乙醇绿色环保,综合考虑采用乙醇体系更为合适。
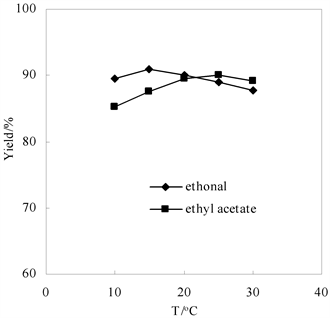 1.5 h,n (-OOH):n (Na2SO3) = 1:1.2,90% (v/v) 乙醇;2 h,n (-OOH):n (Na2SO3) = 1:1.35, 75% (v/v) 乙酸乙酯
1.5 h,n (-OOH):n (Na2SO3) = 1:1.2,90% (v/v) 乙醇;2 h,n (-OOH):n (Na2SO3) = 1:1.35, 75% (v/v) 乙酸乙酯
Figure 6. Effects of the temperature on the reducing reaction
图6. 温度对反应的影响
4. 结论
以大豆脂氧酶好氧催化氧化玉米油所得的氢过氧化玉米油为原料,然后将亚硫酸钠溶于水相,以乙酸乙酯/乙醇稀释氢过氧化玉米油酯,进行还原反应得到十八碳二烯脂肪酸甘油酯。考察了溶剂、时间、温度及还原剂亚硫酸钠用量对还原产率的影响。对于乙醇/水体系,乙醇为溶剂,其体积占90%时,反应1.5 h,n(Na2SO3):n(-OOH) = 1.2:1时,羟基十八碳二烯脂肪酸玉米油的产率达91%。对乙酸乙酯/水双相体系,当乙酸乙酯体积占75%时,反应2 h,n(Na2SO3):n(-OOH) = 1.35:1,25℃下,羟基十八碳二烯脂肪酸玉米油的产率达90%。
NOTES
*通讯作者。