1. 前言
芭蕉Musa basjoo Sieb. et Zucc.为芭蕉科芭蕉属多年生草本植物,芭蕉全株皆可入药 [1],其中芭蕉根茎是贵州习用苗药芭蕉根,具有清热解毒、止渴利尿等功效,收载于《贵州省中药材、民族药材质量标准》中 [2]。研究表明芭蕉根具有抑制α-葡萄糖苷酶(a-Glu)、降低糖尿病小鼠空腹血糖、抗炎、镇痛等作用 [3] [4] [5]。此外,芭蕉花在我国西南地区及东南亚多个国家常作为药食两用的药材 [6] [7] [8] [9],中医记载:芭蕉花,其味甘淡、微辛,性凉,具有化痰软坚、平肝、和瘀、通经等功效,民间常用芭蕉花炖猪心以治疗怔忡不安和心绞痛,芭蕉花炖猪肺以治肺痨和支气管炎,壮族地区将芭蕉花用于治疗糖尿病,而研究表明芭蕉花具有明显的降血糖、调节血脂的作用 [1] [10]。
课题组前期从芭蕉根中分离出五环三萜类成分羽扇豆酮 [11],其具有抑制a-Glu、乙酰胆碱脂酶(AchE)活性及蛋白酪氨酸磷酸酶1B (PTP1B)活性及抗氧化作用,对链尿佐菌素联合高脂饲料诱导的2型糖尿病大鼠胰岛素抵抗有改善作用 [12] [13] [14]。此外,研究表明芭蕉花和香蕉花都具有抑制a-Glu活性及抗糖尿病的作用 [3] [15] [16]。因此,为探究芭蕉花抑制a-Glu活性作用是否与含羽扇豆酮有关,且芭蕉花中是否也含有与芭蕉根相同的抗糖尿病活性成分羽扇豆酮,本实验从芭蕉的花和苞片中分离羽扇豆酮,采用HPLC法对其含量进行测定,并应用于同科同属植物香蕉(Musa balbisiana)和野蕉(Wild Musa basjoo)的花和苞片中,以期为寻找和扩大抗糖尿病活性成分羽扇豆酮药用资源提供依据。
2. 材料与仪器
2.1. 材料与试剂
香蕉、芭蕉、野蕉的花和苞片(收集于云南、广东、广西、贵州等地区),经贵州民族大学民族医药学院王祥培教授鉴别为香蕉、芭蕉、野蕉的干燥花蕾及苞片;羽扇豆酮对照品(贵州中医药大学药物分析实验室自制,纯度 ≥ 98%)。200~300目硅胶G (上海青岛化工有限公司);乙腈、甲醇为色谱纯(美国TEDTA公司);成分分离用95%乙醇、石油醚、乙酸乙酯等有机试剂均为国产分析纯。
2.2. 仪器与设备
Agilent1100高效液相色谱仪(美国),带有四元泵溶剂洗脱系统、柱温箱、自动进样器;NOVA-400 MHz 型核磁共振仪(Varian公司),TMS内标物;HP-5973质谱仪(惠普);X-4型熔点测试仪(北京科技仪器有限公司);AL204-IC/万分析天平(METTLERTOLEDO仪器有限公司);HS-10260T超声波清洗机(天津市恒奥科技发展有限公司);HH-6数显恒温水浴锅(常州澳华仪器有限公司);DZF-O型减压真空干燥箱(上海贺德实验设备有限公司);RE-5210旋转蒸发仪(上海亚荣生化仪器厂)。
3. 实验方法与结果
3.1. 化学成分研究
3.1.1. 化合物分离纯化
分别取芭蕉、香蕉及野蕉的花和苞片样品各1.5 kg,加95%乙醇浸泡(物料比1:6,w/v) 1天,过滤,连续浸泡5次,合并滤液,回收乙醇并浓缩至浸膏,分别用石油醚和乙酸乙酯萃取,回收溶剂,得到浸膏,经硅胶柱色谱分离,以石油醚–乙酸乙酯(100:0→100:1)进行梯度洗脱,不同流份用薄层色谱检验,合并成分相同的流份,分别回收溶剂得到各白色晶体,用无水乙醇进行重结晶后得到针状结晶。将各针状结晶置于60℃的真空干燥箱内抽真空干燥至恒重,得到芭蕉、香蕉、野蕉的花和苞片中白色针状结晶化合物,将白色针状结晶化合物进行核磁共振鉴定。
3.1.2. 白色针状结晶结构鉴定
从芭蕉、香蕉、野蕉的花和苞片中得到的白色针状结晶都具有相同的核磁鉴别结果,其结果如下。
白色结晶,mp 170℃~172℃;EI-MS m/z:424;1H-NMR (CDCl3, 400 MHz):δ4.68 (d, 1H),δ4.56 (d, 1H),δ1.07 (s, 6H),δ1.67 (s, 3H),δ1.08 (s, 3H),δ1.04 (s, 3H),δ0.96 (s, 3H),δ0.94 (s, 3H);13C-NMR (CDCl3, 125 MHz):d 213.4 (C-3),150.2 (C-20),109.4 (C-29),52.2 (C-5),49.9 (C-9),48.7 (C-18),47.1 (C-19),46.0 (C-4),45.3 (C-14),41.6 (C-17),41.0 (C-8),36.0 (C-22),35.4 (C-1),33.9 (C-13),32.8 (C-10),32.7 (C-16),31.4 (C-2),29.7 (C-7),29.2 (C-21),28.0 (C-15),27.2 (C-23),27.0 (C-12),25.9 (C-11),24.9 (C-24),20.2 (C-6),19.1 (C-30),18.6 (C-28),18.3 (C-25),17.9 (C-26),10.7 (C-27)。
通过与文献报道的结果相比较 [17],白色粉末为羽扇豆酮,结果表明芭蕉、香蕉、野蕉的花和苞片中都含有羽扇豆酮。
3.2. 芭蕉、香蕉、野蕉的花和苞片中羽扇豆酮的含量测定
3.2.1. 色谱条件
1) 波长的选择
课题组前期采用HPLC法及UPLC法测定芭蕉根中羽扇豆酮的含量 [18] [19] [20],其最佳的检测波长为206 nm,本实验应用多波长紫外检测器进行检测,其在206 nm左右达到最大的吸收,故本实验以206 nm作为检测波长。
2) 柱温的考察
分别在柱温为25℃、30℃、35℃进样检测,结果发现在25℃时羽扇豆酮分离效果最佳,峰形完整,故以25℃作为检测的温度。
3) 流速的考察
分别以0.7 ml/min、0.8 ml/min、1 ml/min的流速进样检测,结果表明流速在1 ml/min时羽扇豆酮的分离效果较好,峰形完整,故以1 ml/min作为进样流速。
4) 流动相的考察
分别采用流动相为甲醇–乙腈 = 1:1 (v:v),考查单泵和双泵的分离效果,结果以甲醇–乙腈 = 1:1 (v:v)单泵的基线稳定,故以醇–乙腈 = 1:1 (v:v)单泵为流动相。
综上所述,本实验确定的最佳色谱条件为:采用Diamonsil-C18色谱柱(4.6 mm × 250 mm, 5 μm);流动相:乙腈–甲醇 = 1:1 (v:v);流速1 mL/min;检测波长206 nm;柱温25℃;进样量为20 μL。
3.2.2. 供试品的制备
1) 提取方式的考察
取香蕉花(福建漳州)粉末约1 g,精密称定,加甲醇50 ml,分别超声提取和水浴回流提取2次,每次90 min,合并滤液,水浴挥干溶剂,加甲醇定容至10 ml,按照“3.2.1”项下的色谱条件进行测定,结果如表1所示。
2) 提取溶剂的考察
分别以甲醇、乙醇、50%甲醇、50%乙醇为提取溶剂提取,按照“3.2.1”项下的色谱条件进行测定,结果如表1所示。
3) 提取次数的考察
分别以相同溶剂和提取方式考查提取次数的影响,即提取1次、2次、3次,按照“3.2.1”项下的色谱条件进行测定,结果如表1所示。

Table 1. Extraction results of different extraction methods, extraction solvents and extraction times (n = 3)
表1. 不同提取方式、提取溶剂和提取次数的提取结果(n = 3)
综上所述,香蕉花最佳的提取方式是将香蕉花药材粉碎,过四号筛,取粉末约1 g,精密称定,置圆底烧瓶中,加入甲醇50 mL,水浴回流2次,每次90 min,过滤,合并滤液,水浴挥干溶剂,加甲醇定容至10 ml,用0.22 μm的微孔滤膜滤过,即得供试品溶液。
3.2.3. 对照品溶液的制备
精密称取羽扇豆酮对照品约10 mg,置于25 ml的容量瓶内,加甲醇至刻度,制备成含羽扇豆酮为0.1786 mg/ml的对照品溶液。
3.2.4. 系统适应性
按“3.2.1”项下的色谱条件下,分别吸取甲醇、对照品溶液和供试品溶液注入液相色谱仪,色谱图见图1,图2,图3,芭蕉、香蕉、野蕉的花和苞片中羽扇豆酮与相邻峰的分离度均大于1.5,理论塔板数按羽扇豆酮峰计算不低于8000。
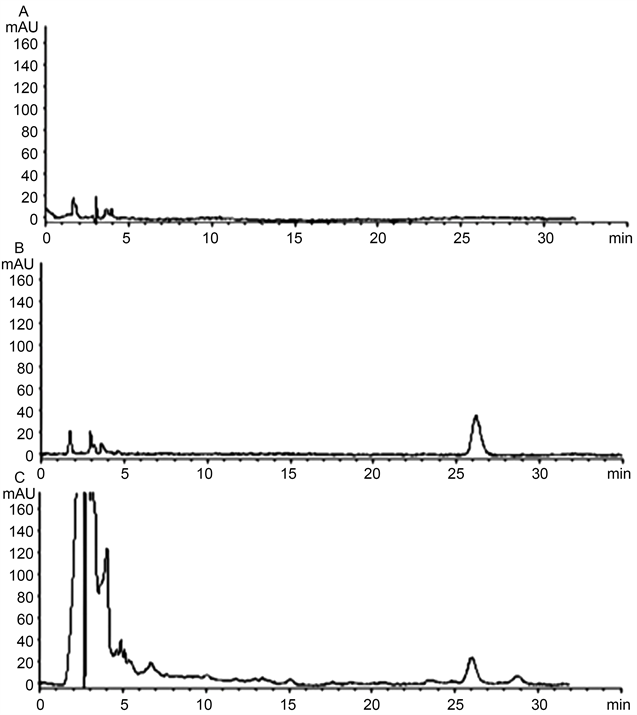
Figure 1. Representative HPLC chromatograms of blank (A), standards (B) and M. Paradisiacal samples collected from Fujian (C)
图1. 空白、对照品溶液和供试品色谱图(A、B、C分别为空白溶剂、羽扇豆酮、福建香蕉花)
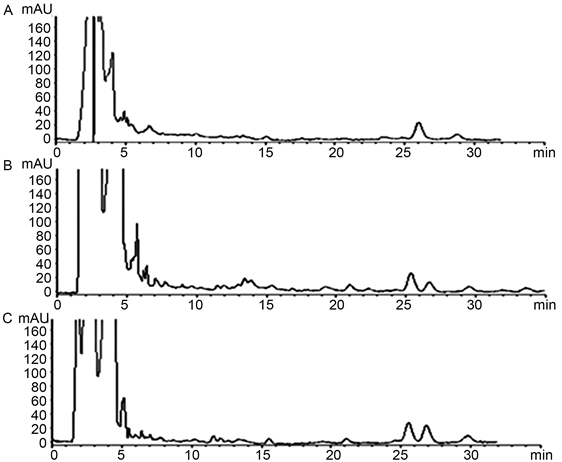
Figure 2. The HPLC chromatograms of the flowers in M. paradisiacal (A), Wild M. basjoo (B), M. basjoo Siebold (C)
图2. 花色谱图谱(A、B、C分别为香蕉花、野焦花、芭蕉花)
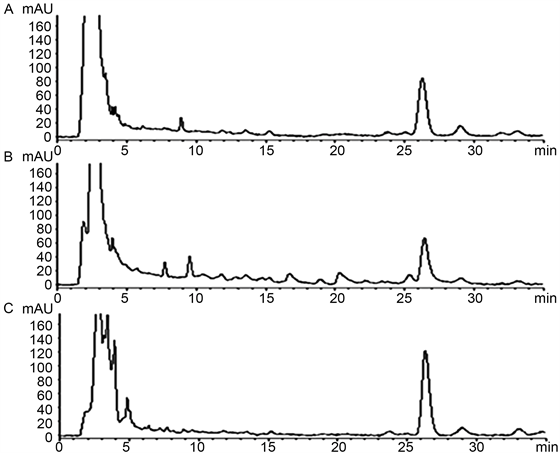
Figure 3. The HPLC chromatograms of the bracts in M. paradisiacal (A), Wild M. basjoo (B), M. basjoo Siebold (C)
图3. 苞片色谱图谱(A、B、C分别为香蕉苞片、野蕉苞片、芭蕉苞片)
3.2.5. 方法学考察
1) 线性关系考察
按“3.2.3”项下对照品溶液配置方法配置对照品母液,分别稀释成以下浓度:0.0749、0.1049、0.1499、0.2099、0.2548、0.2998 mg/ml,按“3.2.1”项下的色谱条件进样测定,以对照品浓度为横坐标,峰面积为纵坐标,绘制标准曲线,得到羽扇豆酮的线性方程为Y = 7293.3X − 45.71 (R2 = 0.9995),羽扇豆酮的浓度在0.0749~0.2998 mg/ml之间的线性关系良好。
2) 精密度实验
按“3.2.3”项下方法制备的对照品溶液精密吸取20 μL注入色谱仪,按“3.2.1”项下色谱条件重复进样6次,记录羽扇豆酮的峰面积与保留时间,计算得羽扇豆酮保留时间和峰面积的RSD值分别为0.24%、0.85%,表明仪器的精密度好。
3) 稳定性实验
取样品粉末(福建漳州花),按“3.2.2”项下方法制备供试品溶液,分别于室温下放置0,2,4,6,8,10 h后,按进样测定,记录保留时间和峰面积。计算羽扇豆酮的保留时间和峰面积的RSD值分别为0.24%、1.71%,表明供试品溶液在室温下放置10 h内的稳定性良好。
4) 重复性实验
取样品粉末(福建漳州花),精密称定,平行6份,分别按“3.2.2”项下方法制备供试品溶液,按“3.2.1”项下色谱条件进样测定,记录峰面积,测得羽扇豆酮的含量平均值为2.4015 mg/g,保留时间和峰面积的RSD值分别为0.13%、2.63%,表明该方法重复性良好。
5) 加样回收率实验
取已知含量的香蕉花样品(福建漳州花)粉末6份,每份约0.50 g,精密称定,置圆底烧瓶中,加入适量的羽扇豆酮对照品溶液,按“3.2.2”项下方法制备供试品溶液,按“3.2.1”项下色谱条件进样测定,记录峰面积,计算羽扇豆酮回收率,结果见表2,羽扇豆酮回收率在96.56%~103.48%之间,RSD为2.23%,表明该方法准确度良好。
6) 检测限和最低检测限的确定
取对照品溶液进行不断稀释,以信噪比为10时得到检测限,以信噪比为3时得到最低检测限,结果羽扇豆酮的检测限为0.1499 mg/ml,最低检测限为0.0450 mg/ml。
3.2.6. 芭蕉、香蕉、野蕉的花和苞片中羽扇豆酮的含量测定
取各样品的花和苞片粉末,分别按“3.2.2”项下方法制备供试品溶液,再按“3.2.1”项下色谱条件进样测定,记录峰面积,以对照品羽扇豆酮作为对照,以标准曲线法计算羽扇豆酮的含量,结果见表3。

Table 3. Levels of lupenone in flowers and bracts of the M. paradisiacal, Wild M. basjoo, M. basjoo Siebold
表3. 不同品种花和苞片中的羽扇豆酮含量
由表3及图4数据分析可知,通过比较芭蕉、香蕉、野蕉三个品种中羽扇豆酮含量发现,三个品种的花中羽扇豆酮含量:香蕉 > 野蕉 > 芭蕉;苞片中羽扇豆酮含量:芭蕉 > 野蕉 > 香蕉。芭蕉、香蕉、野蕉的苞片中羽扇豆酮含量均大于花中羽扇豆酮含量。
比较三个品种同植株花和苞片中羽扇豆酮含量,发现三个品种均以苞片中羽扇豆酮含量高于花中的含量,见图4。其中以野蕉和芭蕉的花和苞片中羽扇豆酮含量差异最大,如广西玉林野蕉1号苞片中的羽扇豆酮是花中含量的4倍以上;云南景洪芭蕉1号苞片中的羽扇豆酮的含量也是花中含量的4倍以上。
3.2.7. 芭蕉、香蕉、野蕉的花和苞片中羽扇豆酮含量差异性分析
用SPSS.20软件对三个品种花和苞片中的羽扇豆酮含量进行差异性分析,组间比较采用LSD检验,P < 0.05为差异有统计学意义。结果表明,香蕉花与野蕉花中羽扇豆酮含量比较,差异无统计学意义(P > 0.05);香蕉花与芭蕉花中羽扇豆酮含量比较,差异具有统计学意义(P < 0.05);野蕉花与芭蕉花中羽扇豆酮含量比较,差异具有统计学意义(P < 0.05)。说明芭蕉、香蕉、野蕉三个品种的花中羽扇豆酮含量具有一定的差异,结果见表4。

Table 4. Comparison of the statistics of the flowers of M. paradisiacal, Wild M. basjoo, M. basjoo Sieboldin pairs
表4. 香蕉、野蕉及芭蕉的花两两比较统计结果
*表示具有显著性差异(P < 0.05)。
香蕉与野蕉苞片中羽扇豆酮含量比较,差异无统计学意义(P > 0.05);香蕉与芭蕉苞片中羽扇豆酮含量比较,差异具有统计学意义(P < 0.05);野蕉与芭蕉苞片中羽扇豆酮含量比较,差异具有统计学意义(P < 0.05)。说明芭蕉、香蕉、野蕉三个品种苞片中羽扇豆酮含量具有一定的差异,结果见表5。

Table 5. Comparison of the statistics of the bracts of M. paradisiacal, Wild M. basjoo, M. basjoo Sieboldin pairs
表5. 香蕉、野蕉及芭蕉的苞片两两比较结果
*表示具有显著性差异(P < 0.05)。
3.2.8. 芭蕉同花序老花及嫩花中羽扇豆酮含量测定
取同产地、同采收期、同花序的芭蕉老花和嫩花样品粉末,分别按“3.2.2”项下方法制备供试品溶液,再按“3.2.1”项下色谱条件进样测定,记录峰面积,以对照品羽扇豆酮作为对照,以标准曲线法计算羽扇豆酮的含量,结果见表6。
由表6可知,5批芭蕉样品中,只在芭蕉老花中检测出羽扇豆酮,且检出的羽扇豆酮含量均低于仪器最低检测限,表明羽扇豆酮主要存在于芭蕉花老的花蕊中,羽扇豆酮为药材的次生代谢产物,这可能与老嫩样品的代谢有关。

Table 6. Levels of Lupenone in tender flowers and old flowers of M. basjoo Siebold
表6. 芭蕉老花和嫩花的羽扇豆酮含量
3.2.9. 芭蕉同花序老、嫩苞片中羽扇豆酮含量测定
取芭蕉同种花序老、嫩苞片样品粉末,分别按“3.2.2”项下方法制备供试品溶液,再按“3.2.1”项下色谱条件进样测定,记录峰面积,以对照品羽扇豆酮作为对照,以标准曲线法计算羽扇豆酮的含量,结果见表7。

Table 7. Levels of Lupenone in tender bractss and old bracts of M. basjoo Siebold
表7. 芭蕉老苞片和嫩苞片中羽扇豆酮的含量
由表7可知,5批芭蕉老嫩苞片中,均以老苞片中羽扇豆酮含量高于嫩苞片,这可能与羽扇豆酮在老、嫩苞片中的次生代谢强度有关。
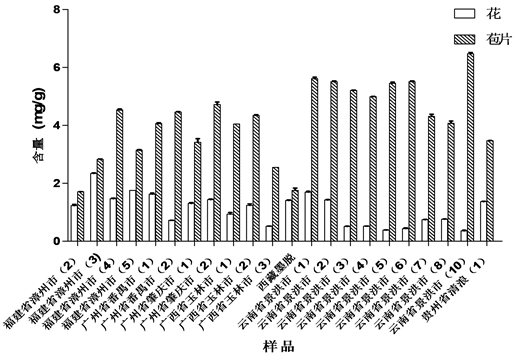
Figure 4. The lupenone level of flowers and bracts from the same inflorescence
图4. 同植株花和苞片的含量比较
4. 讨论
芭蕉、香蕉、野蕉同为芭蕉科芭蕉属植物,其果实和花常食用,食用的芭蕉花主要是野生芭蕉花,其中傣族将芭蕉花视为傣族食花文化的代表。芭蕉花中富含蛋白质、氨基酸、膳食纤维、矿物质,具有低脂肪、低热量的特点 [21] [22],研究表明芭蕉花中豆甾醇和β-胡萝卜苷在抗肿瘤方面具有一定作用 [23] [24] [25] [26]。课题组前期从芭蕉根、茎、叶中分离检测出含有羽扇豆酮。此外,还从香蕉、野蕉及皇帝蕉的果皮中检测出羽扇豆酮,为进一步扩大抗糖尿病活性成分羽扇豆酮原药材来源,本实验从芭蕉、香蕉、野蕉的花和苞片中分离鉴定出羽扇豆酮,并采用HPLC法建立香蕉、野蕉及芭蕉花中羽扇豆酮含量测定方法。从芭蕉、香蕉及野蕉的花中分离得到羽扇豆酮,国内外研究表明羽扇豆酮能降低血糖、血脂、改善胰岛素抵抗和葡萄糖耐量,在抗炎和治疗糖尿病等方面具有生物活性 [12] [13] [14]。本实验测定25批芭蕉、香蕉及野蕉的花和苞片中羽扇豆酮的含量,考察了色谱条件及样品的制备方法,建立具有高分离度、分析时间短、高提取效率等优点的含量测定方法。
芭蕉、香蕉及野蕉的花和苞片中羽扇豆酮含量测定结果表明,三者的苞片中羽扇豆酮含量明显高于花,以芭蕉苞片中羽扇豆酮含量最高,香蕉及野蕉的苞片中羽扇豆酮含量差异较小;香蕉花中羽扇豆酮含量最高,芭蕉花中羽扇豆酮含量最低,其中香蕉与野蕉中羽扇豆酮含量无较大差异。实验比较了芭蕉同植株老嫩花和老嫩苞片中羽扇豆酮含量的差异,均以老花大于嫩花、老苞片大于嫩苞片的规律呈现。还比较了同植株花和苞片中羽扇豆酮的含量,结果均以苞片大于花,提示羽扇豆酮在花和苞片中的代谢程度不一致,在苞片中的代谢旺盛,尤其在老花和老苞片中代谢更为旺盛。综上所述,本实验建立有效测定香蕉、野蕉及芭蕉花和苞片中羽扇豆酮含量的方法,同时也表明香蕉、野蕉及芭蕉的花和苞片可作为抗糖尿病活性成分羽扇豆酮的原药材来源。
基金项目
国家自然科学基金资助项目(No. 81860737)。
NOTES
*通讯作者。