摘要: 本文首次提出采用2,6-二-(2-吡啶基)-4-吡啶甲酸(配体L)-H
2O
2-HRP测定HRP酶浓度的新体系。利用紫外考查HRP催化H
2O
2氧化配体L体系的光谱变化。在pH = 7.2,25℃下,配体L浓度为6 × 10
−6 mol/L,H2O2浓度为1 × 10
−4 mol/L时,回归方程为A = −0.0034x + 1.072,线性相关系数为0.9909,该体系的检测范围可达10
−8~10
−9 mol/L,灵敏度较高,操作简便,抗干扰能力强,稳定性好,可用作检测游离HRP酶的新方法,具有实际的应用前景。
Abstract:
A new system for the determination of horseradish peroxidase concentration by 2,6-di-(2-py- ridyl)-4-picolinic acid (ligand L)-H2O2-HRP was proposed for the first time. The spectral changes of ligand L system catalyzed by HRP for H2O2 oxidation were investigated by UV method. At pH = 7.2 and 25˚C, the ligand L concentration is 6 × 10−6 mol/L, H2O2 concentration is 1 × 10−4 mol/L, the regression equation is A = −0.0034x + 1.072 and the linear correlation coefficient is 0.9909. The detection range of the system can reach 10−8~10−9 mol/L. This method has high sensitivity, simple operation, strong anti-interference ability and good stability. It can be used as a new method for the detection of free HRP enzyme and has practical application prospects.
1. 引言
辣根过氧化物酶(Horse Radish Peroxidase,简称HRP)是一种含有血红素辅基的糖蛋白复合酶,比活性高、耐热酸碱,能够在相对宽泛的条件下催化氧化许多芳香类化合物,被普遍用于食品工业、污水处置、分析检测和合成等领域。关于HRP的测定,目前的化学发光法稳定性和灵敏度不够理想,且很多试剂国内尚无供应,不利于推广。HPLC法样品量要求偏多且灵敏度偏低,操作也相对繁琐 [1] [2]。
三联吡啶衍生物对大多数过渡金属离子都具有很强的成键能力,其配位形式主要为三齿鳌合或双齿鳌合 [3] [4]。近年来,三联吡啶衍生物因其构造和功能多样化亦受关注,在分子识别、分子催化剂、抗肿瘤药物和自组装等领域都有广泛的应用前景 [5] [6] [7] [8] [9]。在三4’位置引入羧基可以与各种金属Mn+构成丰富的配位,进而形成多种新结构的配合物,而且羧基配体能溶于弱碱性水溶液,易与生物大分子发生相互作用 [10] [11]。本文首次提出2,6-二-(2-吡啶基)-4-吡啶甲酸(配体L,结构见图1)-H2O2-HRP体系测定HRP酶浓度的新体系。在pH 7.2的磷酸盐缓冲溶液中,以辣根过氧化物酶催化过氧化氢氧化配体L形成水溶性产物,通过测定体系紫外吸光度变化以确定辣根过氧化物酶浓度。配体L易于合成,且在接近中性的条件下能溶于水和HRP作用,与HRP的最适作用pH范围十分匹配。

Figure 1. The structure of 2,6-di-(2-pyridyl)-4-picolinic acid
图1. 2,6-二-(2-吡啶基)-4-吡啶甲酸结构
目前未见2,6-二-(2-吡啶基)-4-吡啶甲酸用于检测HRP酶浓度的研究。本文以UV-Vis技术测定HRP催化H2O2氧化配体L的体系。结果表明该体系中的HRP酶促反应灵敏度高,反应迅速,重现性高且稳定。本方法可用于游离HRP的检测,操作简便,有望用于医药工业、食品检测、环境监测以及探究生命体信息规律等诸多领域,可为HRP检测的发展和完善提供有用信息和多样性选择。
2. 实验部分
2.1. 实验试剂与仪器
2,6-二-(2-吡啶基)-4-吡啶甲酸,辣根过氧化物酶(HRP),阿拉丁;30% H2O2,NaOH,KOH,NaHSO3,无水乙醇,分析纯,西陇化工股份有限公司。TU-1901紫外–可见光谱仪,北京普析通用仪器有限责任公司。
1) 2,6-二-(2-吡啶基)-4-吡啶甲酸溶液:准确称取一定量配体L,加pH 7.2磷酸缓冲液,后移入250 mL容量瓶中,定容成浓度为5 × 10−4 mol/L的溶液,常温保存,稀释为不同浓度为后续使用。2) 辣根过氧化物酶溶液:准确称取一定量HRP溶于水,移入250 mL容量瓶中,配制成1 × 10−6 mol/L的溶液,放入4℃冰箱中保存,稀释为不同浓度供后续使用。
2.2. 实验方法
分别以pH7.2磷酸缓冲液和水为参比,扫描200~400 nm范围内配体L和HRP酶的紫外光谱。固定配体L的浓度为1 × 10−5 mol/L,H2O2和配体保持过量,配制系列浓度的HRP,测试其紫外吸收强度,绘制工作曲线,并寻找检测限。
3. 实验结果
3.1. 配体与HRP酶体系的紫外吸收图谱
图2是配体、HRP以及配体L-HRP-H2O2体系的紫外吸收光谱。HRP酶在紫外区无明显的吸收。配体L在紫外区有较强的吸收,参照文献 [12] 可以推断210~260 nm处的吸收峰来自配体L的激发态(II-II*),与之对应的在366 nm处有强荧光发射峰。在配体L与HRP浓度比小于100:1时,配体的紫外吸收被酶所覆盖,210~260 nm范围内的紫外吸收峰消失。由此可知,对于配体L-HRP-H2O2体系,当配体过量时(大于100:1),可尝试利用其紫外光谱检测HRP酶的浓度。
 C (配体L) = 6 × 10−6mol/L,C (HRP) = 1.76 × 10−7mol/L,C (H2O2) = 1 × 10−4mol/L,反应时间0.5 h1) 配体;2) 配体L-HRP-H2O2;3) HRP
C (配体L) = 6 × 10−6mol/L,C (HRP) = 1.76 × 10−7mol/L,C (H2O2) = 1 × 10−4mol/L,反应时间0.5 h1) 配体;2) 配体L-HRP-H2O2;3) HRP
Figure 2. UV absorption spectra of ligand L, HRP and ligand L-HRP-H2O2 system
图2. 配体L、HRP以及配体L-HRP-H2O2体系的紫外吸收光谱
3.2. 配体浓度对体系吸光度的影响
图3是加入梯度浓度的配体L溶液所测得的紫外吸收图谱。随着配体L加入浓度的增加,体系的紫外吸收依次增加。在210~250 nm出现最高峰,在250~300 nm以及300~350 nm处也分别出现了两个明显的吸收峰。在此浓度范围内配体L与吸光度呈较好的正相关。
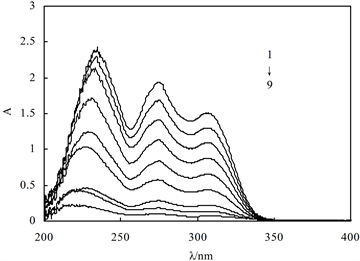
 1-9:C (配体L) = 1.4, 1.2, 1.0, 0.8, 0.6, 0.4, 0.2, 0.12, 0.06 (×10−4 mol/L)C (HRP) = 1.056 × 10−7 mol/L,C (H2O2)= 1 × 10−4 mol/L,反应时间0.5 h
1-9:C (配体L) = 1.4, 1.2, 1.0, 0.8, 0.6, 0.4, 0.2, 0.12, 0.06 (×10−4 mol/L)C (HRP) = 1.056 × 10−7 mol/L,C (H2O2)= 1 × 10−4 mol/L,反应时间0.5 h
Figure 3. Effect of ligand L concentration on ligand L-HRP-H2O2 system
图3. 配体L浓度对配体L-HRP-H2O2体系的影响
3.3. 体系反应时间
影响体系吸光度的因素很多,如时间、浓度、pH、反应,温度等。反应随催化时间的增加,体系的吸光度亦增加,在前10 min几乎呈线性。但20 min之后,则速度增加缓慢,渐趋于平衡,见图4。达到平衡后的体系非常稳定,24 h内吸光度保持基本恒定,见表1。
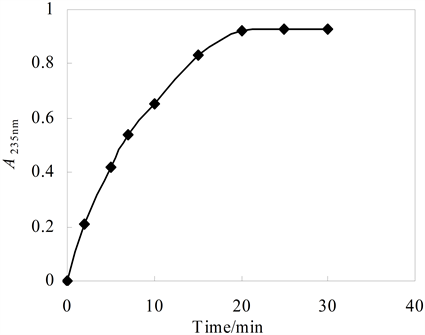 C (配体L) = 0.4 × 10−4 mol/L,C (HRP) = 1.056 × 10−7 mol/L,C (H2O2) = 1 × 10−4 mol/L
C (配体L) = 0.4 × 10−4 mol/L,C (HRP) = 1.056 × 10−7 mol/L,C (H2O2) = 1 × 10−4 mol/L
Figure 4. Reaction process of ligand L-HRP-H2O2 system
图4. 配体L-HRP-H2O2体系的反应进程

Table 1. Time stability of ligand L-HRP-H2O2
表1. 配体L-HRP-H2O2体系的时间稳定性
3.4. 温度和pH对体系的影响
温度不仅影响酶反应速率,而且影响酶的稳定性。HRP酶反应在40℃左右为比较适宜,较高温度时反应速率有所提升,但不利于酶的稳定。本体系在室温下即可得到满意的反应速率,且室温操作较为节能方便,故本实验在室温下进行。
HRP催化作用的最佳pH是中性或弱酸性。配体L在中性条件下溶解性较差,在酸性时易溶于有机溶剂。经实验测试配体L在pH = 7.2的弱碱性体系中溶解良好,该pH也在HRP催化反应的最适pH范围,因此该体系的pH定为7.2。
3.5. 检测限
图5是梯度浓度的配体L的紫外吸收光谱,旨在寻找适宜的最低配体浓度。结果显示,配体L浓度为6 × 10−6 mol/L时峰值低于0.15,浓度进一步降低导致紫外吸光度低于0.1,误差将放大,失去测量准确度。因此体系配体L浓度最好应高于6 × 10−6 mol/L。
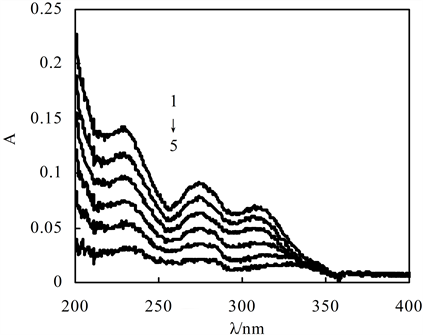 C (配体L): 1-6: 6.0, 5.0, 4.0, 3.0, 2.0, 1.0 × (10−6 mol/L)
C (配体L): 1-6: 6.0, 5.0, 4.0, 3.0, 2.0, 1.0 × (10−6 mol/L)
Figure 5. UV absorption spectra of ligand L
图5. 配体L的紫外吸收光谱
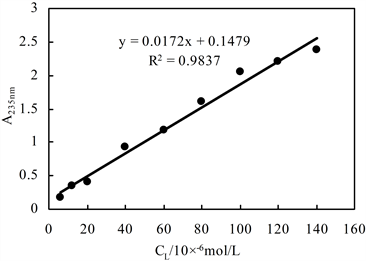
3.6. 工作曲线
图6是配体L-HRP-H2O2体系在235 nm波长下的HRP酶工作曲线。从工作曲线上看,吸光度变化范围0.8~1.2,回归方程为A = −0.0034x + 1.072,其线性相关系数为0.9909。配体L-HRP-H2O2体系对于HRP的检测范围可达10−8~10−9 mol/L,灵敏度高,操作简便,具备一定的应用价值。按照上述实验方法,重复十次实验,计算其相对标准偏差为 4.05%,表明方法精密度良好。
 C (配体) = 6 × 10−6 mol/L; C(H2O2) = 1 × 10−4 mol/L;反应时间0.5 h
C (配体) = 6 × 10−6 mol/L; C(H2O2) = 1 × 10−4 mol/L;反应时间0.5 h
Figure 6. UV working curve of ligand L-HRP-H2O2 system
图6. 配体L-HRP-H2O2体系紫外工作曲线
4. 结论
HRP对H2O2氧化配体L的反应具备灵敏的催化作用,配体L-HRP-H2O2体系在紫外吸收光谱235 nm处出现最高峰,且吸光度与HRP的浓度也呈现良好的线性关系,检测限可达10−8~10−9 mol/L。该2,6-二-(2-吡啶基)-4-吡啶甲酸-H2O2-HRP体系的灵敏度高,操作简便,可作检测游离HRP的新方法,具有实际的应用前景。
基金项目
国家青年自然科学基金(21801139)资助。
NOTES
*第一作者。
#通讯作者。