1. 引言
能源的短缺以及化石燃料的消耗和带来的污染,使得我们迫切需要更清洁的能源,光能是地球上可持续的清洁能源之一,它与我们的生活息息相关,高效合理的利用光能源对人类的未来生活至关重要。光催化的出现已经引起了人们对光能的使用,并将其转化为其他可收集利用的能源。并且通过光催化技术来降解和分解污染物具有以下几个优点 [1] [2]:一是能够将绝大部分有机污染物完全分解为CO2和H2O等小分子物质,不会产生二次污染;二是光催化过程简单易操作,其光催化原料成本低廉;三是利用光能引发光催化的过程时,不管是光能源还是光催化剂都是可再生和可循环利用的。因此,光催化技术以及光催化材料已经成为目前最为活跃的研究方向之一。
在过去的几十年里,在光催化研究领域中,TiO2以其优异的抗化学性能、光腐蚀性能以及价格低廉等优点成为研究最为广泛的光催化剂之一 [3],但也却存在一些缺陷 [4] [5]:一是TiO2带隙较宽(宽度为3.2 eV),只能吸收波长较短的紫外(即对应的吸收光谱为387 nm),而太阳光谱中紫外光仅占5%,因此单独的TiO2对光能源的利用率极低;二是光生载流子的复合率高,导致光催化效率较低。所以这些缺点大幅度限制了TiO2的广泛应用。因此,国内外科研人员对TiO2进行改性进行了大量科研工作,并取得了大量的成果。对TiO2进行改性的目的和作用是:一是减小禁带的宽度,扩大吸收波长的范围,使其在可见光下也能发挥良好的光催化性能;二是加入了捕获剂以阻止或者减缓光生电子–空穴对的复合,使其光量子效率有所提高;三是提高光催化材料的稳定性等等 [6]。常见的改性方法有:复合半导体、贵金属沉积、非金属掺杂、金属离子掺杂、多元共掺杂等。
2. TiO2晶体结构及其光催化作用机理
2.1. TiO2晶体结构
TiO2在自然界中有金红石、锐钛矿和板钛矿三种晶型结构。而二氧化钛的锐钛矿结构和金红石结构,是两种得到广泛研究的晶体结构。两种晶体的最小结构单元都是TiO2八面体,这些八面体以不同的方式公用边角形成不同的晶型,在金红石结构中,八面体共用两个对边形成线形链,线形链再共用角上的氧原子,相互连接形成晶体。锐钛矿没有角共用,可以看作锯齿形链通过边共用形成的晶体。而晶体结构上的差别导致不同晶型质量密度、电子结构性质以及光催化活性不同。锐钛矿和金红石型都具有光催化活性,其中锐钛矿型TiO2的光催化活性较为优异。原因是锐钛矿型晶格比金红石型的缺陷多,能产生更多的氧空位来捕获电子,从而使光催化光生空穴和电子较金红石型不容易复合。此外,相对金红石来说,锐钛矿型仅仅是一种亚稳态,因此其活性较高,光催化活性也会相应的高 [7]。
2.2. TiO2的光催化作用机理
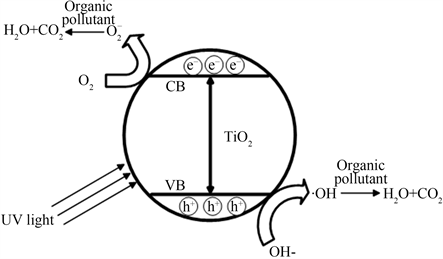
Figure 1. Schematic illustration of the photocatalytic mechanism of semiconductor in the literature [7]
图1. 文献 [7] 中半导体光催化机理示意图
在大多数情况下,在空气和水溶液光催化反应才能发生,这是因为自由基基团的产生是氧气或水分子和光生电子及光生空穴结合,当用能量大于或者等于TiO2半导体的带隙能的光照射时,TiO2能够被激发产生光生电子–空穴对,电子–空穴对在迁移过程中如果没有被电子受体或者电子施体所捕获,那么电子–空穴对又有部分能重新复合,使能量以热能或者其他形式散发掉。然而,当催化剂表面有合适的俘获剂(如H2O或O2)存在时,会抑制电子和空穴对的重新复合,而在其重新复合之前,催化剂表面就会发生氧化–还原反应。在光催化半导体中,空穴具有强的氧化能力,大多情况下与表面吸附的H2O或者OH-离子反应产生具有强氧化性的羟基自由基,光催化反应机理示意图(见图1)和反应式 [7]:
(1)
(2)
光生电子与催化剂表面吸附的氧分子反应生成超氧自由基(
),其反应式如下:
(3)
(4)
(5)
上面的反应过程中,有氧化性很强的羟基自由基(∙OH)和超氧离子自由基(
)产生,能够把吸附样品在表面上的大部分有机物污染物和一部分无机污染物氧化,将它们最终被降解为CO2和H2O等无机小分子。
3. 改性纳米TiO2复合材料在光催化领域研究进展
3.1. 复合半导体改性
TiO2是典型的金属氧化物半导体材料,具有成本低、无毒、化学稳定性好及能带结构合理等优点,被公认为是一种优良的光催化材料 [7]。由于半导体具有独特的能带结构,所以可作为光催化领域的催化剂。在光照下,半导体价带(VB)中的电子可以被激发到导带(CB)上,然后产生电子和空穴,CB上的电子参与了还原反应,VB上的空穴参与了氧化反应 [8]。然而,TiO2光催化剂在实际应用中还存在一些有待解决的问题。例如,金属氧化物由于其宽带隙只能使用紫外线,而紫外线只占太阳光的一小部分。所以通过对材料进行复合改性,扩大材料吸收波长的范围和提高光催化性能尤为重要。复合半导体改性方法可分为半导体–半导体复合物和半导体–绝缘体复合物。
3.1.1. 半导体–半导体复合
在光催化剂中构建异质结,实现了电子–空穴对的有效分离,提高了复合材料的光催化活性。Qiu等 [9]
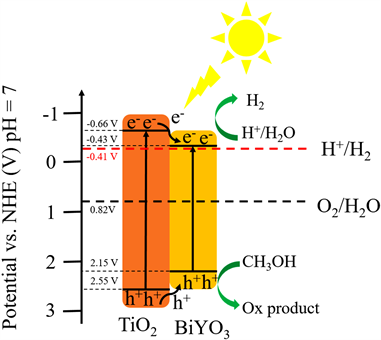
Figure 2. Transferred schematic of photogenerated electrons and holes in TiO2/BiYO3 composites in the literature [9]
图2. 文献 [9] 中TiO2/BiYO3复合材料中光生电子和空穴的转移示意图
通过首次采用溶胶–凝胶法合成了TiO2/BiYO3光催化剂,并对其进行了光催化分解水制氢活性的研究,通过研究发现:复合光催化剂的光催化析氢速率分别是TiO2的10倍和BiYO3的57倍。这是因为TiO2和BiYO3两种材料复合形成了I型异质结构,而这种结构促进了光诱导电子的转移和光生载流子的分离,
所以大大提高了复合后光催化剂的光催化活性。根据实验数据,Qiu等 [9] 还提出了光照下TiO2/BiYO3光催化析氢的机理,如图2所示。在光照下,TiO2价带(VB)中的电子被激发到导带(CB)上,产生电子和空穴。TiO2的CB中的光激发电子首先转移到BiYO3的CB中,而光生空穴则从TiO2的VB转移到BiYO3的VB中,形成I型异质结(图2)。在I型异质结中,光生电子和空穴有不同的传输路径,可以避免电子和空穴的复合。
Fan等 [10] 通过简单的两步法溶剂热/水热法制备了花状CeO2/TiO2异质结构。如图3所示,制备的样品由小CeO2颗粒定向聚集在自组装的有序花状TiO2纳米棒上,CeO2/TiO2异质结构除了尺寸上略有收缩外,基本保持了所制备的TiO2的形貌。与纯CeO2、纯TiO2和市售的P25相比,制备的花状CeO2/TiO2异质结构在紫外光下对罗丹明B的降解具有明显的增强作用。这种花状CeO2/TiO2异质结构增强的光催化活性可以归因于TiO2与CeO2异质结构的耦合作用所带来的电荷分离的改善。

Figure 3. SEM images of (a) pure TiO2; (b) flower-like CeO2/TiO2 heterostructures in the literature [10]
图3. 文献 [10] 中扫描电镜图像:(a) 纯TiO2;(b) 花状CeO2/TiO2异质结构
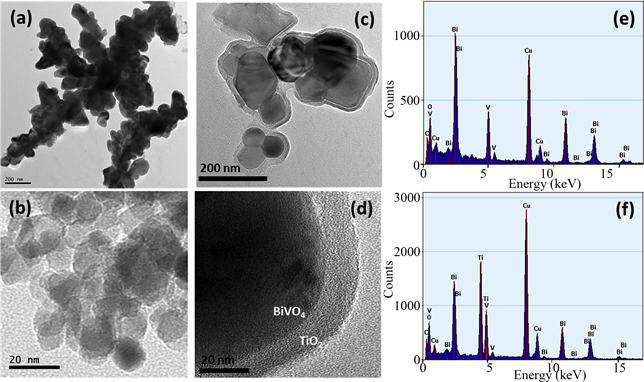
Figure 4. TEM images of (a) BiVO4 nanoparticles showing dendritic structure; (b) TiO2 nanoparticles showing agglomerated structure; (c) BiVO4/TiO2 core-shell nanoparticles; and (d) magnified image of BiVO4/TiO2 core-shell nanoparticles clearly showing the formation of core-shell structure; TEM-EDS analysis of (e) BiVO4 nanoparticles; and (f) BiVO4/TiO2 coreshell heterostructures in the literature [11]
图4. 文献 [11] 中透射电镜图像:(a) BiVO4纳米粒子显示树枝状结构;(b) TiO2纳米粒子显示团聚结构;(c) BiVO4/TiO2核壳纳米粒子;(d) BiVO4/TiO2核壳纳米粒子的放大图;(e) BiVO4纳米粒子和f)BiVO4/TiO2核异质结构的TEM-EDS分析
Mannan等 [11] 通过水热法制备了原始的BiVO4,TiO2和BiVO4/TiO2核壳异质结构纳米粒子。从图4中TEM图像显示了纳米颗粒的形成,BiVO4 (图3(a))的平均粒径约为80~100 nm,TiO2 (图4(b))样品的平均粒径约为10~15 nm。样品芯壳BiVO4/TiO2纳米颗粒的TEM分析(图4(c)和图4(d))清楚地表明,在BiVO4粒子上有一层约10 nm厚的TiO2涂层。此外,核–壳组成由能量分散X射线光谱法(图4(e)和图4(f))确认,其清楚地揭示了BiVO4样品仅由Bi、V和O组成,但在BiVO4/TiO2核壳纳米颗粒中存在一种添加元素Ti,因此证实了核–壳纳米颗粒的形成。这种制备的核壳异质结不仅能在可见光区提供高的光吸收,而且能形成交错的BiVO4/TiO2异质结,促进电荷的分离和转移,与原始的BiVO4和TiO2相比,复合后的光催化剂降解有机污染物的效率显著提高。
Acharyulu等 [12] 以纳米碳球为模板,采用水热法制备了TiO2/SnO2空心球。通过对TiO2/SnO2空心球的XRD、EDS、SEM分析,证实了TiO2/SnO2空心球是一种粒径约为200 nm的非均相晶体异质复合氧化物。这种空心球小于单个TiO2和SnO2氧化物的尺寸。用紫外可见分光光度计对复合氧化物空心球进行了4种不同染料的光催化活性研究:亚甲基蓝(MB)、刚果红(CR)、甲基橙(MO)和罗丹明B (RhB),在0至270分钟之间,观察到光吸收率随着时间间隔的增加而降低。对于所研究的不同染料的最大光降解率不同,其降解顺序为CR > MO > MB > RhB。结果表明,TiO2/SnO2 (2:1)复合空心球具有良好的光催化活性,可用于净化水、抗菌活性、传感器等领域。
Dalia等 [13] 采用溶胶–凝胶法制备了两种生物活性炭样品(P2600和SB)。通过实验说明了低费米能p型半导体(BiOCl)和高能n型半导体(TiO2)之间的异质结有助于减少甚至消除由于两个半导体之间的内部电场结合而产生的电子–空穴复合。BiOCl-TiO2复合体系在可见光照射下表现出很强的活性,而单独的TiO2或BiOCl则不具有这种活性。这种光催化活性随BiOCl-TiO2的重量比而变化,实验结果表明,PTi-75复合材料和缎纹BTi-50的光催化活性最高。BiOCl晶体的特定平面(001、101和102)在TiO2即时存在的情况下,通过次级相互作用在不存在间隙取代的情况下被修饰。因此,可发生能带重叠,从而增强了复合材料的光催化活性。在光催化过程中,自由基(∙OH)和超氧离子(
)都参与了光催化过程,但
的贡献更大。可见光下BiOCl导带产生的电子在光催化过程中(与空穴相比)起着更为重要的作用,从而产生超氧离子,最终降解苯酚。在可见光下降解苯酚过程中,光催化活性改变了复合物(BiOCl-TiO2)中铋(Bi3+, Bi0)和钛(Ti4+, Ti3+)的能态。所得光催化剂,特别是P2600基光催化剂,在苯酚光降解过程中可达到3倍以上,且效率极高。
3.1.2. 半导体–绝缘体复合
在半导体和绝缘体(如SiO2、ZrO2等)复合中,绝缘体主要起载体的作用。郑亚超等 [14] 研究了不同的模板对材料的孔径和比表面积的影响,如图5所示,通过采用不同的模板剂合成了介孔SiO2-TiO2复合材料,表明非离子型模板剂(P123、F127)合成介孔材料的孔径和比表面积相比阳离子型模板剂(HEDA)更大。由表1可知,SiO2@P123材料孔径是最大的,并且其表面以及内部结构中附着了较多TiO2颗粒,因而其光催化性能较掐他两种材料较好,所以可吸附更多的罗丹明B,这也使罗丹明B与TiO2的接触面积大大增大了,从而高效率的利用了TiO2光催化性能,增加了材料的降解率。由测试光催化结果可知,在30 min内,这三种复合的光催化材料可以达到吸附平衡,很容易看出SiO2-TiO2@F127和SiO2-TiO2@HEDA材料的吸附性能远低于SiO2-TiO2@P123材料,其光降解顺序可由大到小依次排为SiO2-TiO2@P123 > SiO2-TiO2@F127 > SiO2-TiO2@HEDA,以P123为模板制备的光催化材料30 min内对罗丹明B的吸附近80%,在光照120 min后SiO2-TiO2@P123对罗丹明B的降解率可达到98%。

Table 1. Surface area, pore volume and average pore size of mesoporous materials in the literature [14]
表1. 文献 [14] 中所用材料的比表面积、孔体积及平均孔径
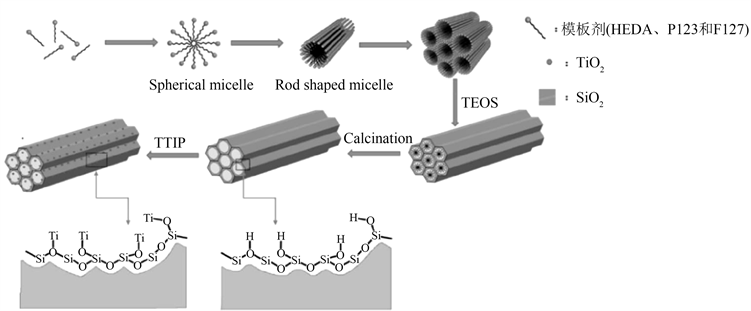
Figure 5. Schematic representation of the synthesis route for mesoporous SiO2 and mesoporous SiO2-TiO2 in the literature [14]
图5. 文献 [14] 中介孔SiO2和介孔SiO2-TiO2材料的制备示意图
3.2. 贵金属沉积
当半导体表面和贵金属(如Ag、Au、Pt等)接触时,载流子重新分布,电子从费米能级较高的n-半导体转移到费米能级较低的金属,直到它们的费米能级相同,从而形成肖特基势垒。另外,由于贵金属区域表面等离子体共振(LSPR)效应可以显著增强光激发半导体的光响应,并且能够通过充当电子陷阱去减少光生载流子的复合 [15] [16],从而提高光氧化还原反应速率。
Meng等 [17] 采用磁控溅射法在硅和石英衬底上沉积含银体积分数为0%~20%的Ag-TiO2纳米结构薄膜,并在950℃的条件下退火1 h。实验研究了光催化活性与银含量的关系,发现银含量会影响TiO2薄膜的相结构,并且薄膜中的银是金属Ag,并非银离子。随着银的含量从0增加到20%,薄膜的光催化活性首先增加,然后下降,适量(2.5%~5%)的银添加可以显着增强TiO2薄膜的光催化活性。增强的光催化活性主要归因于薄膜可见光吸收区域的扩展,锐钛矿相的存在,氧阴离子自由基O2−和表面Ti3+的反应中心的增加以及电子与空穴之间在薄膜表面更好的分离。
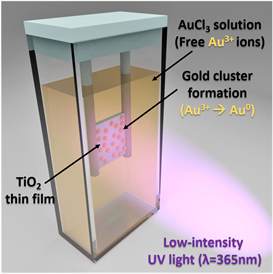
Figure 6. Schematic representation of the photocatalytic deposition of Au structures on TiO2 thin film surface in the literature [18]
图6. 文献 [18] 中光催化沉积Au结构在TiO2薄膜表面的示意图
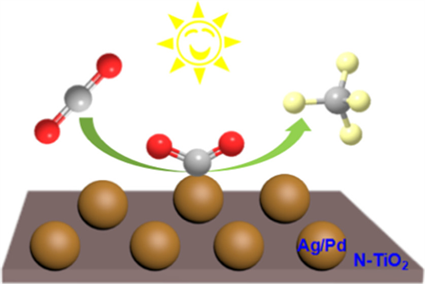
Figure 7. Schematic diagram of Ag/Pd/TiO2 photocatalyst reducing CO2 to CH4 in the literature [19]
图7. 文献 [19] 中Ag/Pd/TiO2光催化剂将CO2还原为CH4示意图
Salih等 [18] 通过在反应溅射的TiO2薄膜上光催化沉积Au纳米颗粒(NPs)来制备具有高度光催化的Au-TiO2混合薄膜,如图6所示。实验通过更改可见光(Vis)和紫外线(UV)的比例,研究了Au纳米颗粒对整体光催化活性的等离子体和非等离子体贡献。虽然Vis/UV的逐渐增加(≤0.24/1)导致Au-TiO2杂化结构的光催化性能稳定提高,但Vis/UV的进一步增加(≥0.30/1)并没有进一步促进这种增强。在这种高比例下光催化性能没有增加的原因可能是,等离激元激发的电子似乎开始促进TiO2中的电子–空穴复合,这大大降低了光催化性能。
开发一种能在温和条件下CO2转化为CH4的光催化剂对于目前的光催化研究领域尤其重要。Tan等 [19] 设计了一种用于高效CO2转化的光催化剂,即Ag/Pd双金属纳米合金沉积在氮掺杂TiO2纳米片上的新型光催化剂,如图7所示。合成的Ag/Pd/TiO2光催化剂具有以下优点:一是将尺寸小、分布范围窄的Ag/Pd双金属纳米粒子固定在TiO2纳米片上,可以增强可见光光响应,减少TiO2表面光生电荷的电子空穴复合,二是氮被引入TiO2纳米片,这可以提高电荷分离效率并扩大光催化剂在可见光区域的范围;三是Ag/Pd/TiO2光催化剂中存在丰富的表面缺陷和氧空位,有利于光激发电荷转移和二氧化碳活化。合成的Ag/Pd/TiO2光催化剂可以在温和的条件下有效地将CO2还原为CH4,而不产生任何其他含碳产品,并且CH4的最大产率可达79.0 mol∙g−1∙h−1。此外,已合成的Ag/Pd/TiO2光催化剂不仅可以很好的回收利用,还具有较高的活性以及选择性,所以这种光催化材料将在催化不同的化学反应中得到更多的应用。
3.3. 非金属掺杂
非金属掺杂是指把N、C、F、S等非金属元素引入到半导体催化剂的晶格中,使其带隙变宽,增强在可见光下的光响应,以使得光催化的活性有所提高 [20]。首先,在1986年,由Sato [21] 发现TiO2中引入氮可使TiO2在可见光下产生响应;直到2001年,Asahi [22] 制备了在紫外光和可见光下具有活性的掺氮TiO2,这才引起了科研人员对非金属元素掺杂TiO2的广泛研究。
Kang等 [23] 采用简便的水热法和光辅助的方式成功制备了具有高比表面积和{001}面暴露的N、F共掺杂的缺氧TiO2 (RNTT-x,x为硼酸处理时间)。如图8所示,实验中使用较低危害的(NH4)2TiF6来促进具有{001}晶面的NH4TiOF3单晶的生长;再通过H3BO3溶液将NH4TiOF3转移到TiO2中,同时释放N、F,再通过光辅助过程中引入氧空位,同时实现N、F的掺杂。此外,这种采用光辅助所制备的样品在可见光照射下对苯酚和罗丹明B (RhB)光降解活性远比其他文献中好,这可能归因于以下两个因素:一是TiO2中存在Vo’s (氧空位和一个电子结合)可以形成一系列缺陷来缩小TiO2的带隙,从而增强了可见光的吸收;二是{001}面的暴露,Vo’s以及通过掺杂克服了电子和空穴分离较差的问题。这种用于增强可见光响应和电荷分离的光辅助耦合方法可以为各种应用中光催化材料的合理设计和合成提供指导。
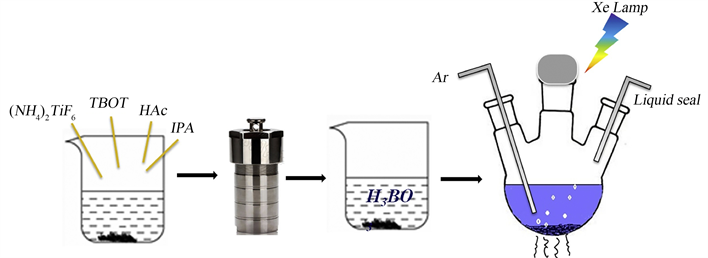
Figure 8. Schematic of the preparation of N, F co-doped oxygen-deficient TiO2 in the literature [23]
图8. 文献 [23] 中制备N、F共掺杂的缺氧TiO2示意图
Wang等 [24] 采用浸渍法制备了C、N、F三掺杂TiO2纳米管。掺杂后的C、N、F/TiO2NTs拥有良好的光催化性能,可以通过分析电子态密度(DOS)来解释。图9是锐钛矿型TiO2和C、N、F/TiO2体系的总密度以及N、C、F原子的总密度,可以看出,由于电子结构的巨大变化,C、N、F/TiO2的带隙明显改变。如图9(a)所示,纯锐钛矿的DOS计算表明,锐钛矿的价带边缘主要由O-2p轨道组成,而导带主要由Ti-3d轨道组成。C、N、F原子的PDOS与C、N、F/TiO2的DOS分开,如图9(b)所示。显然,C、N、F/TiO2的带隙充满了由C,N和F原子提供的电子。N、F的2p轨道的PDOS改变了锐钛矿的价带边缘,并改善了电子跃迁,因为N、F原子取代了锐钛矿中的O原子;C原子的贡献反映在导带中,因为C原子取代了Ti原子,如图10所示。DOS分析表明C、N、F原子的三掺杂可以改善电子跃迁并缩小锐钛矿型TiO2的带隙。此外,C、N、F三掺杂TiO2在紫外光和模拟阳光下的催化活性均得到提高,这应归因于C、N、F三掺杂引起TiO2中电子跃迁得以改善。
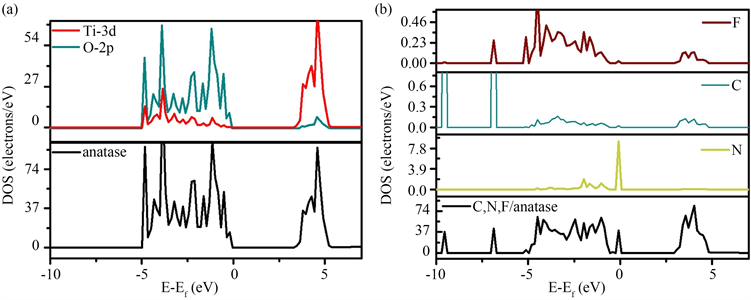
Figure 9. Density of States for a) pure anatase TiO2 and b) C, N, F/TiO2 system in the literature [24]
图9. 文献 [24] 中电子态密度图:(a) 纯锐钛矿型TiO2;(b) C、N、F/TiO2系统的态密度
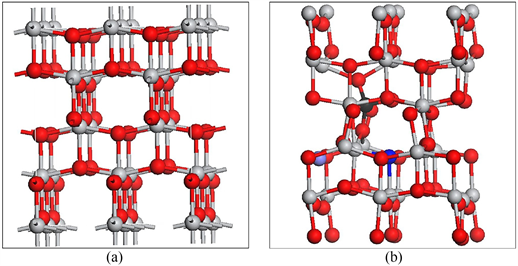
Figure 10. Geometries of (a) bulk anatase TiO2 and (b) C, N, F/TiO2, where red, grey, dark grey, blue and purple denotes oxygen, titanium, carbon, Nitrogen and fluorine respectively in the literature [24]
图10. 文献 [24] 中原子模型图:(a) 锐钛矿型TiO2;(b) C、N、F/TiO2,其中红色,灰色,深灰色,蓝色和紫色表示氧,钛,碳,氮和氟
3.4. 金属离子掺杂
金属离子掺杂是指在TiO2半导体催化剂表面掺杂Fe、Zn、Co、Cr等的金属离子或稀土元素 [25]。在TiO2半导体催化剂中掺杂金属离子可以引入缺陷或者改变结晶度,从而改变粒子的结构以及表面性质,这不仅能影响电子和空穴对的复合率,还可使TiO2的吸收波长范围扩大到可见光区,促进光生电子与空穴的的分离,提高光能的转化及利用的效率,从而最终增强光催化剂的活性 [26] [27] [28] [29] [30]。
Kirit等 [31] 报道了用溶胶–凝胶技术制备的[Mn,Co]xTiO2 (x = 0.01,0.02及0.04)纳米晶的生长,并对其在零下30℃冷冻干燥处理12小时,所得凝胶在200℃、400℃、600℃和800℃等不同温度下进行热处理,其平均晶粒尺寸为6~60 nm,如图11所示。从图12可以看出,在25.22˚、25.49˚和25.6˚处的衍射峰表明主晶相为锐钛矿相,没有其他相的迹象。过渡金属掺杂导致TiO2表面氧空位的减少,并通过吸附在TiO2粒子表面来抑制其他相的结晶。27.47˚处的峰值表明800℃下存在金红石相。价金属阳离子、锰、钴离子可与TiO2表面上的Ti4+反应,Ti4+还原为Ti3+,抑制锐钛矿向金红石的转化,并且在250 w的紫外光下,成功地证明了光催化降解甲醛。因此,TiO2纳米颗粒中掺杂一定的金属离子将有助于提高其作为光催化剂的光催化效率。

Figure 11. SEM image of 4% Mn, Co doped TiO2 sample in the literature [31]
图11. 文献 [31] 中4%的Mn和Co掺杂TiO2样品的SEM图
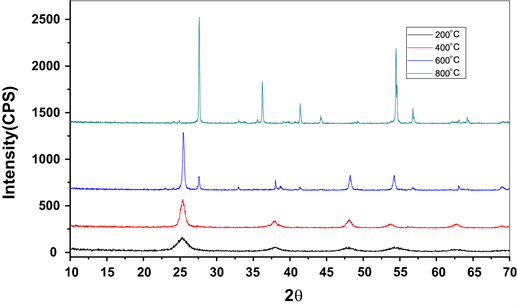
Figure 12. XRD Spectra of Mn and Co doped TiO2 at different temperatures in the literature [31]
图12. 文献 [31] 中不同温度下Mn和Co共掺杂TiO2的XRD光谱
Siteng等 [32] 报道了新型均匀掺杂Fe(III)的TiO2纳米涂层的光催化活性,该材料的制备过程分为两步,包括:1) 氧代TiO2纳米颗粒成核,通过Fe(acac)3掺杂,在溶胶–凝胶微混合反应器中反应沉积在玻璃基板上以及2) 热处理。纳米涂层的光催化测试是在连续流固定珠反应器中对乙烯降解进行的,如图13所示,该催化剂在Fe/Ti摩尔比为0.005%时显示出最佳性能;另一方面,它对350℃至450℃之间的处理温度不敏感。对此他们提出了一个理论模型,该模型解释了反应速率与Fe(III)掺杂的关系:考虑了VB-空穴在Fe3+上的局域化及在Fe2+上的湮灭之间的竞争。该模型允许将锐钛矿型TiO2中Ti4+上CB电子的定位半径估计为4 nm,从而将纳米颗粒TiO2光催化剂的最佳尺寸定义为8 nm。这些改变使其掺杂后的光催化剂具有了更好的光催化性能。
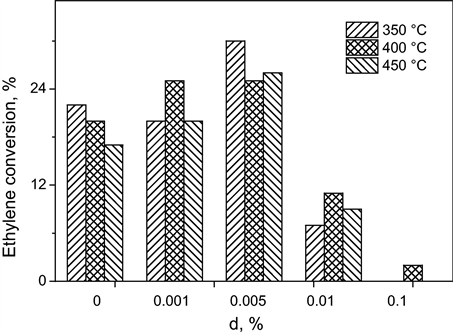
Figure 13. Ethylene conversion of Fe(III)-TiO2 photocatalysts as a function of dopant concentration and heat treatment temperature in the literature [32]
图13. 文献 [32] 中Fe(III)-TiO2光催化剂的乙烯转化率随掺杂浓度和热处理温度的变化图
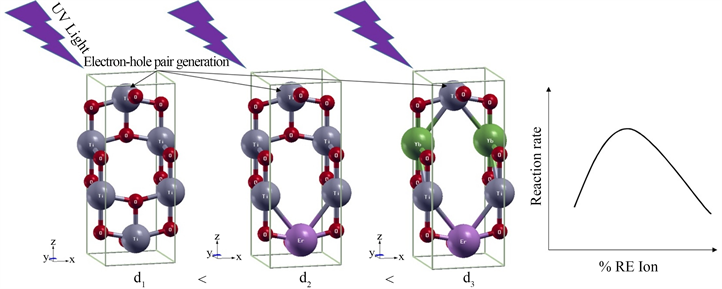
Figure 14. Comparison of photocatalytic performance of TiO2 doped with rare earth elements erbium (Er) and ytterbium (Yb) in the literature [33]
图14. 文献 [33] 中掺杂稀土元素铒(Er)和镱(Yb)的TiO2及光催化性能比较示意图
稀土元素与半导体结合组成的光催化材料一直是近几年研究的焦点之一,也取得了一定的成果,例如通过掺杂稀土元素提高了一些光催化剂的光催化反应速率。Vignesh等 [33] 通过对水热法进行了改进,合成了纯锐钛矿和稀土离子掺杂的二氧化钛,研究了掺杂稀土铒(Er)和镱(Yb)离子的TiO2对实际污染物(苯酚)和模型污染物的光催化降解的影响,实验研究的目的是量化这些掺杂剂对光催化降解速率的影响,并严格评估导致二氧化钛稀土离子掺杂性能提现象的原理。在模拟太阳光照下,稀土掺杂剂在低负载下增强了苯酚的水相光降解,增强程度因催化剂组成而异。如图14所示,这种增强光催化的原因是铒(Er)和镱(Yb)离子结合到TiO2相中,使相由无定形和锐钛矿组成,并且在低掺杂水平下,这种掺入的欲望更加强烈。
3.5. 多元共掺杂
共掺杂是通过引入多种元素起到协同调节性能的方法,金属离子掺杂可以在晶格中引入缺陷或者改变晶格的类型,来改变TiO2的能带结构,提高复合材料的催化活性;而非金属掺杂主要是改变晶体的禁带宽度,从而提高电子–空穴对的分离效果 [34] [35] [36]。共掺杂的目的不仅是为了使TiO2材料可以在可见光下使用,同时还提高这种材料的光催化效率 [37]。
Lin等 [38] 采用一步微波辅助水热法制备了一系列金属离子(M = Cr,Ni,Cu,Nb;R = 1000 × M/Ti摩尔比)和氮共掺杂的TiO2光催化剂。在紫外光和可见光照射下,以甲醇作为空穴清除剂的条件下研究了光催化分解水的性能,H2析出速率随掺杂金属原子及其掺杂浓度的变化而显著变化。从图15和图16可以看出,铜掺杂的TiO2−xNx催化剂表现出优于其他样品的光催化活性。Cu-R-TiO2−xNy样品具有最高的光活性,在紫外光照射下,H2生成率为27.4 mmol∙g−1∙h−1,在可见光照射下的H2产生速率为283 μmol∙g−1∙h−1。因此,结果表明,M-R-TiO2−xNy的光催化活性随共掺杂金属离子和掺杂量的不同而不同,在四种不同类型的共掺杂剂和三种M/Ti原子比中,Cu-10-TiO2−xNy在紫外光和可见光照射下具有最高的光催化分解水活性。Cu-10-TiO2−xNy的光催化活性的显著增强归因于铜和氮共掺杂形成杂质态增强可见光吸收的协同效应,以及介孔TiO2−xNy框架内高度分散的铜,提高了电荷分离效率。
Zhao等 [39] 采用阳极氧化法在钛箔基底上成功地制备了Ti3+,N共掺杂TiO2纳米管阵列(NTA)薄膜,然后在400℃下煅烧2 h,TiO2NTA具有很高的紫外和可见光吸收能力,窄带隙为2.74 ev,这是由于Ti3+自掺杂引起的,Ti3+位位于导带以下0.46 ev,N的2p表面态比价带高1.04 ev。通过一系列的控制实验,研究了制备工艺参数对TiO2NTAs管长和管径的影响。在模拟太阳光照射下,通过对罗丹明B溶液的光降解作用,评价了两系列不同管长(相似直径)和不同直径(相似管长)的Ti3+,N共掺杂TiO2NTA的光催化活性。结果表明,Ti3+,N共掺杂TiO2NTAs的光催化活性随管径从81 nm减小到62 nm略有提高,但当管长从0.57 μm增加到2.03 μm时,其光催化活性明显增强,因此Ti3+,N共掺杂TiO2NTAs的光催化活性明显提高,共掺杂的TiO2NTAs可以通过简单地在适当范围内调节管长和管径来增强。自由基捕获实验表明·OH是RhB光降解的主要活性物质。此外,光生空穴也部分参与了光降解反应。
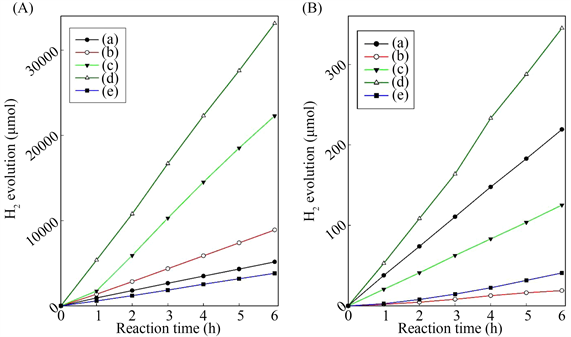
Figure 15. Time course of H2 evolution on M-R-TiO2-xNy catalysts photocatalysts: (a) TiO2−xNy; (b) Cr-10-TiO2−xNy; (c) Ni-10-TiO2−xNy; (d) Cu-10-TiO2−xNy; (e) Nb-10-TiO2−xNy from aqueous methanol solution under (A) UV light irradiation and (B) visible light irradiation in the literature [38]
图15. 文献 [38] 中在M-R-TiO2−xNy催化剂上H2放出的时间过程:(a) TiO2−xNy;(b) Cr-10-TiO2−xNy;(c) Ni-10-TiO2−xNy;(d) Cu-10-TiO2−xNy;(e) Nb-10-TiO2−xNy,(A)是紫外线照射和(B)是可见光照射
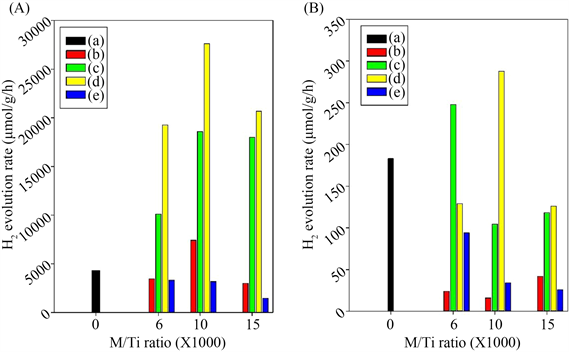
Figure 16. Average of H2 evolution rate on M-R-TiO2−xNy catalysts photocatalysts: (a) TiO2−xNy; (b) Cr-R-TiO2−xNy; (c) Ni-R-TiO2−xNy; (d) Cu-R-TiO2−xNy; (e) Nb-R-TiO2−xNy (R = 6, 10, 15) from aqueous methanol solution under (A) UV light irradiation and (B) visible light irradiation in the literature [38]
图16. 文献 [38] 中M-R-TiO2−xNy催化剂光催化剂上的平均H2析出速率:(a) TiO2−xNy;(b) Cr-R-TiO2−xNy;(c) Ni-R-TiO2−xNy;(d) Cu-R-TiO2−xNy;(e) Nb-R-TiO2−xNy (R = 6, 10, 15),(A)是紫外线照射和(B)是可见光照射
4. 总结与展望
本文从复合半导体、贵金属沉积、非金属掺杂、金属离子掺杂和多元共掺杂五个方面系统地讲述了改性纳米TiO2光催化剂,分析了每种改性后的优缺点及其研究进展。虽然全球面临着全球化的环境污染以及能源不足的问题,但太阳光源则是一种可再生且绿色的能源,但是我们可以采用光催化剂吸收光能源来降解污染物,解决一部分能源和污染的问题。近些年来,TiO2这一类光催化剂的改性研究已经取得很大的成果,但是其中仍存在一些问题。首先,TiO2原本价格低廉,但通过改性可能会使其成本大大提高,所以在提高改性后光催化性能的同时又能使其成本增幅不大,这是较为关键的问题之一。其次,任何光催化剂都可能造成污染,而TiO2光催化剂颗粒又极其细小,在使用的过程中很容易损失,所以提高其回收率也是目前较为重要的问题。随着未来研究的不断深入,越来越多的改性方法将会被发现和改善,所制备的光催化剂也会越来越低廉,性能优越以及有着较高的回收率。
NOTES
*通讯作者。