摘要: 体细胞胚胎发生技术在植物快繁、种质资源保存、遗传转化、基因工程等领域具有广阔的应用前景和经济价值。迄今,椪柑体细胞胚胎发生的生理变化尚不清楚。本研究以椪柑胚性愈伤组织为起始材料进行体细胞胚的诱导,选取椪柑体细胞胚诱导过程中四个阶段的培养物:即刚接种的胚性愈伤组织(EI0)、转成黄色的胚性愈伤组织(EI1)、肉眼可见的胚状体(EI2)和出现50%以上的胚状体(EI3),进行可溶性蛋白含量、H
2O
2水平及抗氧化酶[过氧化物酶(Peroxidase, POD)、过氧化氢酶(Catalase, CAT)、超氧化物歧化酶(Superoxide Dismutase, SOD)]活力的测定。结果表明:可溶性蛋白含量先下降后逐渐升高;过氧化氢含量先逐渐上升后下降;从EI0到EI2过程三种酶活力都表现出先升高后下降的变化规律,但在EI2到EI3过程,POD、CAT活力下降,SOD活力则升高。
Abstract:
Somatic embryogenesis technique has already been widely applied in rapid clonal propagation of plant, preservation of germplasm resources, genetic transformation, genetic engineering, and other fields. The physiological of somatic embryogenesis in citrus is unclear to date. Embryonic calli of Ponkan were used for induction of somatic embryogenesis. The four materials during in-duction of somatic embryogenesis in the Ponkan were selected: inoculated embryonic calli (EI0), yellow embryonic calli (EI1), the embryos that can be seen with the naked eye (EI2) and more than 50% of the embryos (EI3). The content of soluble protein first declined and then increased gradually; the content of hydrogen peroxide gradually increased and then decreased; during EI0 to EI2, three types of enzyme activity increased and then decreased; but during EI2 to EI3, the activity of POD and CAT decreased, and the activity of SOD increased.
1. 引言
体细胞胚胎发生(Somatic Embryogenesis),简称体胚发生,是指体细胞在特定条件下,未经性细胞融合而通过与合子胚类似发育途径形成新个体的形态发生过程。在离体培养条件下,体胚发生途径有两种,直接与间接发生途径 [1]。直接发生途径指从外植体上直接分化出来,不经过愈伤组织这一阶段,如山茶、咖啡、茄子等。间接发生途径指外植体首先脱分化形成愈伤组织再分化出体胚,如胡萝卜、枸杞、龙眼、石刁柏等。目前,体胚发生技术已广泛地应用于植物快繁、种质资源保存、遗传转化、基因工程等领域 [1]。
植物体胚发生过程实质上就是细胞分化过程,在分化的过程中必然发生有氧代谢,而活性氧是有氧代谢过程中的一种副产品。因此,体胚发生过程中也会发生活性氧变化及应激响应 [2] [3]。在许多植物上已开展了这方面的研究,其中包括蛋白含量、活性氧含量、酶活力等变化研究。例如,在伏令夏橙、石刁柏、大蒜、滇楸、莳萝等多数植物中,可溶性蛋白含量呈现单峰变化趋势,其变化是先上升后下降 [4] [5] [6] [7] [8]。在花烛、刺五加等少数植物中,其体胚发生过程中可溶性蛋白含量呈现双峰的变化趋势,即先上升后下降再上升 [9] [10] [11]。一般而言,活性氧含量在体胚诱导早期上升,而在体胚发育后期下降。例如,Ma等 [12] 在香蕉的研究中发现,H2O2含量在愈伤组织发育至球形胚时上升,但在球形胚直至成熟胚时下降;Dhir等 [8] 发现在莳萝愈伤组织诱导体胚过程中,H2O2含量表现出同样的变化规律。但在花榈木的研究中,活性氧只在子叶胚阶段显著上升 [13]。在植物体胚发生过程中,不同抗氧化酶活力变化差异较大,且无特定变化规律。
虽然在不少植物上已开展体胚发生相关工作,但椪柑体细胞胚胎发生的生理变化尚不清楚。基于此,本论文以椪柑胚性愈伤组织为起始材料进行体细胞胚的诱导,分析该过程中其可溶性蛋白含量、三种抗氧化酶活力和活性氧水平的动态变化,以期了解抗氧化系统在柑橘体细胞胚胎发生中的作用。
2. 材料与方法
2.1. 植物材料
供试材料取自华中农业大学作物遗传改良国家重点实验室的椪柑(Citrus reticulata Blanco cv. Ponkan)胚性愈伤组织(郭文武教授惠赠)。胚性愈伤组织由珠心胚诱导产生,保存于MT基本培养基中,每20 d继代一次。
2.2. 椪柑体细胞胚的诱导方法
参照付春华 [14] 的方法并做适当修改。取MT培养基上继代培养20 d的椪柑胚性愈伤组织接种于体细胞胚诱导培养基(MT + 2%甘油 + 0.7%琼脂);置于光照培养室进行培养(光照周期为16 h/8 h,温度为25℃ ± 1℃,3000 lux);观察椪柑愈伤组织变化并做好记录。
2.3. 生理生化指标的测定及数据分析
植物组织样本准备:于超净工作台内,称取样品,加入10 ml磷酸缓冲液,加适量石英砂于冰上研磨,将组织溶液于振荡机上充分混匀后,取2 ml溶液,12,000转/分,4℃下离心20 min,取上清液用于生理生化指标的测定。
可溶性蛋白含量、SOD、POD的测定参照李合生 [15] 的方法。可溶性蛋白含量测定以牛血清蛋白做标准曲线,采用考马斯亮蓝比色法,结果以mg/g表示;SOD活力测定采用NBT光还原法,SOD活力单位以抑制NBT光化还原的50%为一个酶活力单位;POD活力测定采用愈创木酚法,以每分钟A值增加0.01为1个活力单位,结果以U/mgprot表示。
过氧化氢含量、CAT活力均采用南京建成试剂盒测定。过氧化氢含量测定主要步骤为:准备空白管、标准管和测定管;在各管中分别加入试剂一,之后在各管中分别加入蒸馏水、163 mmol/L过氧化氢标准品应用液以及样本;混匀,37℃准确反应1分钟后,再分别加入试剂二;于405 nm处,1 cm光径,蒸馏水调零,测各管吸光度值。CAT活力测定原理:CAT分解过氧化氢的反应可通过加入钼酸铵而迅速中止,剩余的过氧化氢与钼酸铵作用产生一种淡黄色的络合物,在405 nm处测定其生成量,可计算出结果CAT的活力,结果以U/mgprot表示。
每个试验进行了6次独立重复,测定的数据采用SPASS16.0软件进行统计分析,用EXCEL软件绘制图形。
3. 结果与分析
3.1. 椪柑体细胞胚的诱导
将椪柑胚性愈伤组织(图1A)接种于含2 %甘油的MT培养基上培养,15天后胚性愈伤组织已大量增殖,且颜色都转为黄色(图1B);30天后胚性愈伤组织开始分化出肉眼可见的球形胚状体(图1C);45天后球形胚状体增加至50%以上(图1D)。根据椪柑体胚发育进程,我们选用上述四个阶段的培养物(EI0、EI1、EI2和EI3)进行后续的生理和分子试验。
3.2. 椪柑体细胞胚诱导过程中生理生化指标的变化
3.2.1. 椪柑体细胞胚诱导过程中可溶性蛋白含量的变化
如图2所示,在椪柑体细胞胚诱导过程中可溶性蛋白含量先下降后逐渐升高。其中EI3的可溶性蛋白含量最高,达55.43 mg/g;EI1的最低,为9.99 mg/g。四个时间点的培养物其可溶性蛋白含量存在显著差异。在EI1~EI3阶段,可溶性蛋白含量逐渐上升,且在EI3时达到最高,这说明胚状体形成初期需要大量的蛋白质。

Figure 1. The induction of somatic embryogenesis of Ponkan. Note: (A) Inoculated embryonic calli (EI0); (B) Yellow embryonic calli (EI1); (C) Embryos that can be seen with the naked eye (EI2); (D) More than 50% of the embryos (EI3)
图1. 椪柑体细胞胚的诱导。(A) 刚接种的胚性愈伤组织(EI0);(B) 转成黄色的胚性愈伤组织(EI1);(C) 肉眼可见的胚状体(EI2);(D) 出现50%以上的胚状体(EI3)

Figure 2. The change of soluble protein contents during the induction of somatic embryogenesis of Ponkan. Note: different letters represent significant differences (P < 0.05)
图2. 椪柑体细胞胚诱导过程中可溶性蛋白含量的变化。注:不同字母代表在0.05水平差异显著
3.2.2. 椪柑体细胞胚诱导过程中过氧化氢含量的变化
如图3所示,在椪柑体细胞胚诱导过程中过氧化氢含量先逐渐上升后下降。其中EI2的过氧化氢含量最高,达12.28 mmol/gprot;EI0的最低,为3.05 mmol/gprot。这暗示着胚状体形成的早期阶段需要较高的活性氧含量。
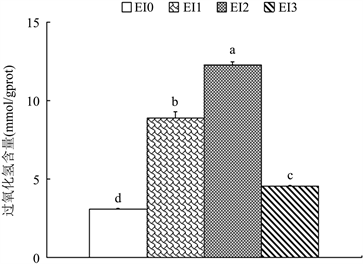
Figure 3. The change of hydrogen peroxide contents during the induction of somatic embryogenesis of Ponkan. Note: different letters represent significant differences (P < 0.05)
图3. 椪柑体细胞胚诱导过程中过氧化氢含量的变化。注:不同字母代表在0.05水平差异显著
3.2.3. 椪柑体细胞胚诱导过程中SOD、POD、CAT活力的变化
如图4所示,在椪柑体细胞胚诱导过程中,从EI0到EI2阶段三种酶活力都表现出先升高后下降的变化规律。其中,在椪柑愈伤组织转入含甘油的诱导培养基15天后,三种抗氧化酶活力都显著上升。这表明愈伤组织分化形成体胚的起始阶段可能存在氧化胁迫(EI1的活性氧含量是EI0的2.91倍),激活了体内抗氧化系统。而在EI2到EI3阶段,POD、CAT活力下降,SOD活力则升高。说明SOD活力上升可能对胚状体进一步发育有促进作用。
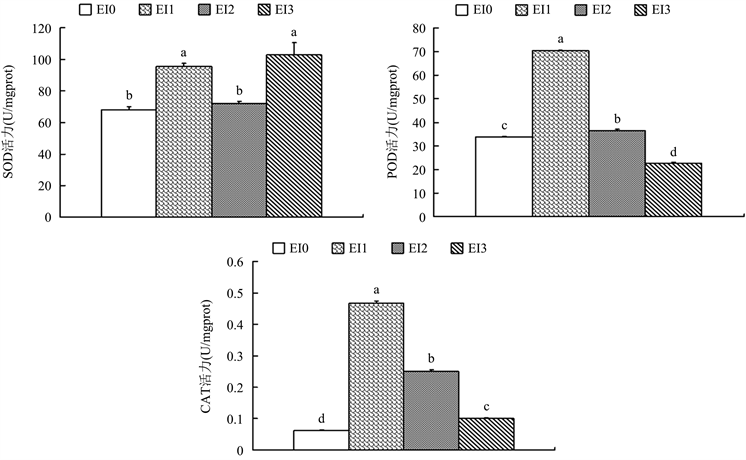
Figure 4. The change of SOD, POD, CAT activity during the induction of somatic embryogenesis of Ponkan. Note: different letters represent significant differences (P < 0.05)
图4. 椪柑体细胞胚诱导过程中SOD、POD、CAT活力的变化。注:不同字母代表在0.05水平差异显著
4. 讨论
蛋白质是生命活动的物质基础和重要调节物质,蛋白质数量和种类反映出植物代谢水平和发育阶段。因此,体胚发生过程中必然伴随着蛋白质含量的变化。已有研究表明,体胚发生与蛋白质含量的变化有密切关系,蛋白质在体胚发生的重要转折时期为其提供物质与能量 [16]。通过对不同植物体胚发生过程中蛋白质含量分析发现多数植物表现出相似的变化趋势 [5] [6] [7] [8] [9],可以分为以下两个阶段。第一阶段指胚性愈伤组织至形成球形胚时,蛋白质含量呈现上升变化趋势,可见蛋白质为体胚的发生提供了物质基础;第二阶段指球形胚至成熟胚时,蛋白质含量出现持续下降,可能是细胞内蛋白质被转化成糖类或其他物质以供体胚发生所需。本研究中,可溶性蛋白含量在椪柑愈伤组织至体胚发育初期整体出现上涨,但在诱导早期可溶性蛋白含量出现下降。这可能因为愈伤组织长期继代于MT培养基中,转到甘油培养基后由于生长环境的改变从而引起蛋白含量的变化。刘华英 [4] 采用不同处理条件来诱导柑橘体胚时,发现细胞生长环境的变化也会引起蛋白质含量的变化。
活性氧不仅在有氧代谢过程中产生,当植物受到各种胁迫时也会导致活性氧的增加。活性氧对于植物来说是一把双刃剑,因为植物的生长发育离不开活性氧,但是当植物体内活性氧超过细胞所能承受的值时则会造成细胞膜损伤甚至细胞死亡。已有研究表明,在植物体胚发生过程中,活性氧含量和抗氧化酶活力会发生显著变化 [7] [8] [10] [12] [13] [17] [18] [19]。本研究结果表明,在EI0到EI1时,过氧化氢含量及SOD、POD、CAT三种酶活力都增加;在EI2时,H2O2含量达到最大值,但三种酶活力都下降;在EI3时,H2O2含量、CAT、POD活力下降,但SOD上升。所以,我们推测细胞内保持较高水平的活性氧有利于细胞的增殖和体胚的诱导 [8] [12] [13] [20]。然而产生的活性氧来自何处目前尚不清楚,如能借助有效的活性氧探针揭示活性氧来源将有助于调控体胚发生。另外,值得注意的是,本研究中这三种酶活力变化趋势不一样,其中POD与CAT活力变化一致。可见,这三种酶在椪柑体细胞胚诱导中起着不同的作用,其具体调控机制还有待进一步研究。
基金项目
江苏省自然科学基金(BK20181454);扬州大学科技创新培育基金(2019CXJ120)。
NOTES
*共同第一作者。