摘要: 聚三亚甲基碳酸酯(PTMC)因其具有表面溶蚀性特点、良好的生物相容性以及药物缓释性在可降解植入器械如血管支架表面改性上表现出广阔的应用前景。基于金属–酚表面化学构建的一氧化氮(NO)催化释放功能涂层已经被证实应用血管支架表面改性具有抗凝血、抑制平滑肌细胞增殖和促进内皮再生等多重生物学功能。然而,该NO催化释放涂层能否应用于可降解PTMC材料表面改性还未有过报道。因此,本研究采用旋涂的方法在支架材料表面首先制备PTMC涂层,随后基于金属–酚表面化学,利用没食子酸(gallic acid, GA)和硒代胱胺(selenocystamine, SeCA)共价结合形成网络结构,以Cu
2+作为交联剂将上述网络结构进行交联,探究PTMC涂层表面构建具有Cu
II-GA/SeCA网络结构的NO催化涂层。研究结果证明,得益于GA多酚具有的广谱材料粘附特性,在PTMC涂层表面成功地构建了Cu
II-GA/SeCA涂层,且实现了NO催化释放速率在2~6.2 × 10
−10 mol × cm
−2 × min
−1之间可调控。催化释放的NO通过特异性上调血小板环磷酸鸟苷(cGMP)表达抑制血小板的粘附与激活,证实了基于金属–酚表面化学的NO-催化释放涂层能应用于可降解聚合物涂层表面改性。
Abstract:
Polytrimethylene carbonate (PTMC) shows broad application prospects in surface modification of degradable implantable devices such as vascular stents due to its surface erosion characteristics, good biocompatibility and drug slow release. The functional coating for the catalytic release of nitric oxide (NO) based on metal-phenol surface chemistry has been proven to have multiple biological functions such as anticoagulation, inhibition of smooth muscle cell proliferation, and promotion of endothelial regeneration by surface modification of vascular stents. However, it has not been reported whether the NO catalytic release coating can be applied to the surface modification of degradable PTMC materials. Therefore, in this study, the spin coating method was used to first prepare the PTMC coating on the surface of the stent material, and then based on the metal-phenol surface chemistry, the use of gallic acid (GA) and selenocystamine (SeCA) covalently combined to form network structure, using Cu2+ as a cross-linking agent to cross-link the above-mentioned network structure, and explore the construction of a NO catalytic coating with CuII-GA/SeCA network structure on the surface of the PTMC coating. The research results prove that, thanks to the broad-spectrum material adhesion characteristics of GA polyphenols, CuII-GA/SeCA coatings were successfully constructed on the surface of PTMC coatings, and the NO catalytic release rate was adjusted between 2~6.2 × 10−10 mol × cm−2 × min−1. Catalytic release of NO inhibits platelet adhe-sion and activation by specifically up-regulating the expression of platelet cyclic guanosine phos-phate (cGMP), confirming that the NO-catalytic release coating based on metal-phenolic-(amine) surface chemistry can be applied to the surface of degradable polymer coatings modified.
1. 引言
医用奥氏体316L不锈钢(SS)由于其优异的力学性能被广泛地应用于血液接触类医疗器械中 [1]。而不锈钢支架在植入的过程中可能会因为损伤血管内壁以及介入材料表面的刺激,诱发血小板的粘附与激活,从而导致了血栓的形成 [2]。且316L SS在临床中不可避免地存在一些有害离子的溶出,可能对人体产生致敏、致畸等潜在风险 [3],例如不锈钢支架植入后镍离子溶出会导致镍过敏及炎性反应,从而增加支架植入后再狭窄的风险 [4] [5]。因此,阻隔有害离子的溶出以及抗凝血活性分子的引入成为优化其生物相容性的关键。
聚三亚甲基碳酸酯(PTMC)是目前研究较多的一种可生物降解脂肪族聚碳酸酯材料,具有表面溶蚀的降解特点,且降解产物没有酸性,生物相容性良好,使其作为药物洗脱支架载药涂层具有较大的潜力 [6]。且PTMC有良好的柔韧性与弹性,这使其可以均匀地覆盖在材料的表面,起到阻隔植入材料与血液接触的作用,但PTMC没有抑制血小板的粘附与激活的作用,这可能会导致血栓的形成。
一氧化氮(NO)是内皮细胞分泌的一种十分重要的信号分子 [7]。具有优异的抗凝血功能 [8]。人体内的NO供体(GSNO)被一氧化氮合酶(NOS)催化后产生NO,增加了血小板中环鸟磷酸苷cGMP水平而降低激活血小板所需的Ca2+浓度,从而抑制血小板的粘附与激活。近年来研究者通过在材料表面构建NO释放/催化型涂层来提高其血液相容性。
有机硒和Cu2+催化内源型NO供体RSNO释放NO一直是NO催化领域的重要的策略 [9]。本研究基于金属–酚(胺)表面化学改性方法提出了一种新型的NO催化策略,利用没食子酸(GA)和硒代胱胺(SeCA)共价结合形成网络结构,再以Cu2+作为交联剂将上述网络结构交联,在PTMC涂层上形成具有催化释放NO功能的类仿生涂层,以共价结合协同配位作用的方式形成的涂层,结构相对稳定,同时利用两种催化单元,也使得这种涂层的NO催化方式较为可控。
2. 实验部分
2.1. 实验材料
实验所用试剂:没食子酸(GA, Sigma);硒代胱胺(SeCA, Sigma);氯化铜(CuCl2, Sigma);聚三亚甲基碳酸酯(PTMC10万分子量,济南岱罡生工程有限公司);四氢呋喃(纯度 ≥ 99.0%,阿拉丁);氢氧化钠(NaOH, Sigma);新鲜全血(购于成都市血液中心);cGMP ELISA试剂盒(上海沪峰生物科技有限公司,中国)。
实验所用仪器:美国凯美特公司型号为KW-4A旋涂机;德国Kruss公司的型号为DSAeco Plus的水接触角检测仪;美国Termo Fisher Scientific公司的型号为XSAM800的X-射线光电子能谱仪;美国GE analytical公司的型号为NOA 280i的NO分析仪;日本电子株式会社型号为JSM-7800F的扫描电子显微镜。
2.2. 各类涂层的制备
涂层制备过程如图1所示,通过旋涂的方法将PTMC旋涂在316L SS表面,为体系提供PTMC基底,再采用“一步浸涂法”在PTMC涂层表面沉积一层CuII-GA/SeCA涂层,起到催化释放一氧化氮的功能。
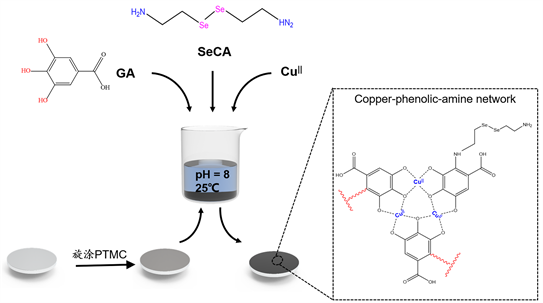
Figure 1. The schematic diagram of preparation different coatings
图1. 各涂层制备过程示意图
2.2.1. PTMC涂层的制备
用去离子水反复多次清洗直径为1 cm的316L SS圆片,后用氮气吹干,置于80℃烘箱中干燥备用。将PTMC(平均分子量10万)溶解于四氢呋喃溶剂中,配置浓度为2 mg/mL的PTMC溶液。采用美国凯美特公司型号为KW-4A的旋涂机,在316L SS圆片表面滴加20 μL的PTMC溶液开始旋涂,转速及时间为前转500 r/min、5 s,后转1500 r/min、25 s。旋涂后的样品置于真空干燥箱干燥48 h。
2.2.2. CuII-GA/SeCA涂层的制备
本涂层采用一步浸涂法制备,将GA (2 mg/mL),SeCA (3.2 mg/mL)溶解到Tris-Base (1.21 mg/mL)缓冲液中,待完全溶解后加入CuCl2 (32 μg/mL),用NaOH溶液将上述混合溶液的pH值调至8,将2.2.1中制备完成的样品全部浸没在混合溶液中,分别在25℃的孵箱中静置2 h、4 h、6 h、24 h后取出,超声清洗除去表面结合不牢靠的聚合物即可得到CuII-GA/SeCA涂层。图2为CuII-GA/SeCA涂层沉积不同时间后的颜色变化。随着沉积时间的增加,其表面颜色逐渐加深,沉积6 h和沉积24 h的CuII-GA/SeCA涂层的样品的颜色区别不明显。

Figure 2. Color change of 316L SS, PTMC coating and CuII-GA/SeCA coatings deposited on PTMC coating for different time
图2. 316L不锈钢、PTMC涂层及在PTMC涂层上沉积CuII-GA/SeCA涂层后的颜色变化
2.3. 材料学表征
2.3.1. 水接触角
采用德国Kruss公司的型号为DSAeco Plus的水接触角检测仪检测316L SS、PTMC涂层以及在PTMC基底上沉积不同时间的CuII-GA/SeCA涂层的亲疏水性。
2.3.2. X射线光电子能谱
采用美国Termo Fisher Scientific公司的型号为XSAM800的X射线光电子能谱仪测定样品表面的化学组成,激发光源为A1 Kα (1486.6 eV),荷电位移校正C1s = 284.5 eV。
2.4. NO催化释放速率及稳定性检测
采用美国GE analytical公司的型号为NOA 280i的NO分析仪检测在PTMC基底上沉积不同时间的CuII-GA/SeCA涂层的NO释放速率,并对沉积6 h CuII-GA/SeCA涂层的样品进行NO催化释放稳定性的研究。向反应室内加入5 mL的PBS溶液(含30 μmol/mL的GSH和SNAP),待基线跑平后放入样品,待曲线不再变化后终止实验,记录NO的催化释放速率。再将样品置于NO供体溶液中浸泡1、3、7、15、30天后再分别检测其NO释放速率。
2.5. 血液相容性评价
2.5.1. 血小板的粘附与激活
将人新鲜的静脉血液与柠檬酸钠抗凝剂按体积比9:1混合,1500 r/min的转速下离心15 min得到富板浆(PRP),将样品分为供体组(+Donor)和非供体组(-Donor),供体组表面滴加SNAP和GSH溶液(浓度均为30 μmol/mL),再在各样品表面滴加200 μL的新鲜PRP后放入37℃孵箱孵育30 min,再用生理盐水漂洗三次后用2.5%的戊二醛溶液固定24 h。脱水脱醇喷金后,采用在日本电子株式会社型号为JSM-7800F的扫描电子显微镜对样品表面的血小板形貌及数量进行观察。
2.5.2. cGMP
采用cGMP ELISA试剂盒定量检测血小板合成的cGMP的浓度。首先将样品分为供体组(+Donor)和非供体组(-Donor),供体组表面滴加SNAP和GSH溶液(浓度均为30 μmol/mL),在表面滴加PRP孵化,步骤与2.5.1相同,孵化30 min后,加入100 μL 10%的triton-X后超声破碎,然后将破碎后的PRP混合液在2500 r/min的转速下离心8 min,分离血小板碎片,吸取上清液用于检测cGMP,其中cGMP检测步骤参考试剂盒说明。
3. 结果分析
3.1. 水接触角结果
水接触角能将材料的亲疏水性直观的反应出来,材料的亲水性对生物相容性有着显著的影响 [10],材料表面所具有的官能团类型与亲疏水性有着紧密的关系,亲水性较强的官能团有羟基、氨基、醛基、羧基等,它们会产生低的水接触角。水接触角检测结果如图3所示,与316L SS相比,PTMC涂层的水接触角由73˚增加到82.7˚,而在PTMC涂层上沉积NO催化释放涂层后,各个工艺的涂层的水接触角依次为:CuII-GA/SeCA(2)为69.4˚;CuII-GA/SeCA(4)为66.2˚;CuII-GA/SeCA(6)为50.7˚;CuII-GA/SeCA(24)为49.2˚。可见涂层的亲水性依次增强,这可能是因为CuII-GA/SeCA涂层中的GA和SeCA含有大量的亲水官能团氨基和酚羟基,由此可以证明涂层的沉积是成功的,且沉积6 h和沉积24 h所得表面的亲水性没有太大差别。
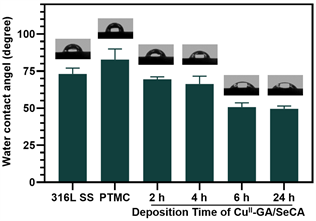
Figure 3. Change of water contact angle of 316L SS, PTMC coating and CuII-GA/SeCA coatings deposited on PTMC coating for different time
图3. 316L不锈钢、PTMC涂层及在PTMC涂层上沉积CuII-GA/SeCA涂层的水接触角变化情况
3.2. X射线光电子能谱
图4为沉积不同时间所制备的CuII-GA/SeCA涂层的XPS全谱;图5为不同沉积时间的CuII-GA/SeCA涂层表面的铜元素和硒元素的含量变化;表1为沉积不同时间所制备的CuII-GA/SeCA涂层表面各元素的比例。从XPS全谱中可以看出,在沉积了CuII-GA/SeCA涂层的样品表面均检测到了硒元素和铜元素,进一步说明了涂层制备的成功。从表1可以看出,随着沉积时间的增加,当沉积时间达到6 h以后,硒元素和铜元素的随沉积时间的增加并不明显。
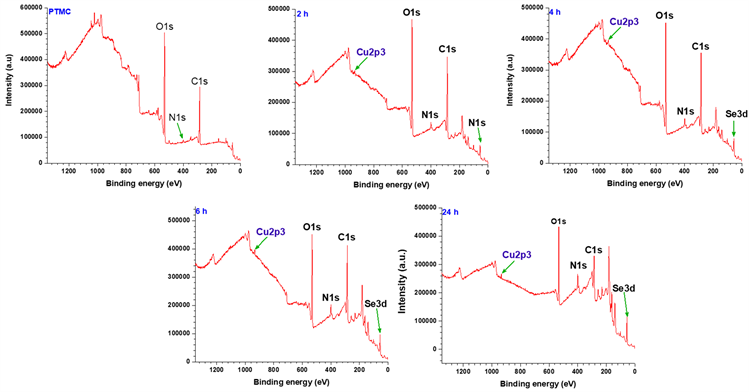
Figure 4. XPS full spectrum of CuII-GA/SeCA coatings deposited on PTMC coating for different time
图4. 在PTMC涂层上沉积不同时间的CuII-GA/SeCA涂层的XPS全谱图
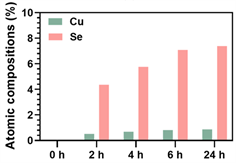
Figure 5. Evolution of the copper and selenium atomic composition of the CuII-GA/SeCA coatings for different time as measured by XPS
图5. 通过XPS测定各沉积时间的CuII-GA/SeCA涂层表面铜和硒元素含量变化

Table 1. Atomic composition of samples obtained using XPS
表1. 通过XPS得到的各样品的原子组成
3.3. NO催化释放速率及稳定性结果
采用NO分析仪检测不同沉积时间的CuII-GA/SeCA涂层NO催化释放能力,并将沉积6 h的CuII-GA/SeCA涂层的样品经供体溶液(30 μmol/mL的GSH和SNAP)浸泡30天后,对其催化释放NO的能力以及稳定性的进行检测。如图6所示,随着沉积时间的增加,NO的催化释放速率均有一定程度的增加。图7(a)是不同沉积时间的CuII-GA/SeCA涂层NO催化释放速率的散点图,其中CuII-GA/SeCA(2)、 CuII-GA/SeCA(4)、CuII-GA/SeCA(6)、CuII-GA/SeCA(24)四组实验样品所对应的NO催化释放速率分别为2.1、4.3、6.1和6.2 × 10−10 mol × cm−2 × min−1,可见随着沉积时间的增加,NO的催化释放速率有一定程度的增加,但沉积6 h和沉积24 h的CuII-GA/SeCA涂层的NO催化释放速率差别不大,推测其在6 h后涂层沉积速率并无明显变化,且NO释放速率也没有显著的差别,因此选择沉积6 h后的涂层进行稳定性测试实验。
沉积6 h CuII-GA/SeCA涂层的实验样品所对应的NO催化释放速率随浸泡时间变化的情况如图7(b)所示,从图中可以看出,浸泡时间分别为0、1、3、7、15、30天时所对应的NO催化释放速率分别为:6.1、5.5、4.8、3、2.3、2 × 10−10 mol × cm−2 × min−1,实验样品随着浸泡时间的增加,其NO的催化速率值逐渐降低,浸泡30天后,其NO的催化释放速率仍可以达到2 × 10−10 mol × cm−2 × min−1左右,这说明CuII-GA/SeCA涂层的稳定性良好,可以满足例如血管支架在治疗心血管疾病时的临床需要。
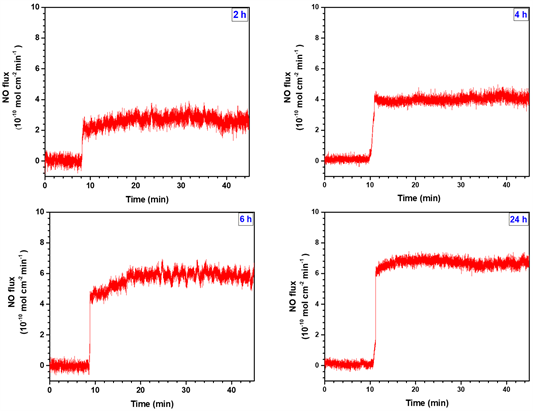
Figure 6. The curve of nitric oxide release before and after the addition of CuII-GA/SeCA samples in each group
图6. 各组CuII-GA/SeCA样品添加前后的一氧化氮释放变化曲线图
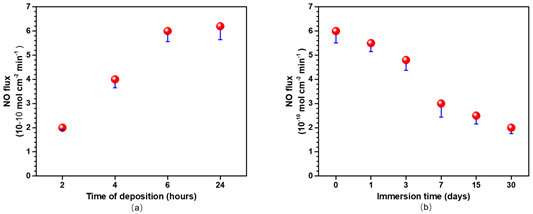
Figure 7. (a) Scatter plot of the catalytic release rate of nitric oxide in CuII-GA/SeCA coatings with different deposition times; (b) Stability of nitric oxide catalytic release rate of CuII-GA/SeCA Coatings Deposited for 6 Hours
图7. (a) 不同沉积时间的CuII-GA/SeCA涂层一氧化氮催化释放速率散点图;(b) 沉积6 h的CuII-GA/SeCA涂层一氧化氮催化释放速率的稳定性
3.4. 血小板的粘附与激活结果
图8(a)是血管中最重要的功能细胞血小板 [11] 在样品表面的粘附与激活的SEM结果图,未添加供体SNAP/GSH的316L SS、PTMC涂层以及CuII-GA/SeCA涂层的表面均粘附了大量的血小板,且血小板处于完全铺展的高度激活状态。而当引入供体SNAP/GSH后,CuII-GA/SeCA涂层表面的血小板粘附的数量有所减少,且粘附的血小板为未被激活的圆球形静息状态,说明CuII-GA/SeCA涂层通过催化释放NO成功的抑制了血小板的粘附与激活,而316L SS和PTMC涂层表面的血小板的粘附与激活的程度并未因NO供体的引入而出现明显的变化,说明NO供体微弱的自释放不会对血小板的生理状态产生较大的影响。
血小板统计结果如图8(b)所示,非供体组样品表面的血小板粘附的数量并无明显的区别,密度约为1 × 104个/平方毫米,而当加入供体后,316L SS和PTMC涂层表面的血小板数量无明显变化,但CuII-GA/SeCA涂层随着涂层沉积时间的增加,血小板粘附的数量逐渐减少,且沉积6 h和24 h的CuII-GA/SeCA涂层表面粘附的血小板的密度均约为3 × 103个/平方毫米,均可以有效的抑制血小板的粘附。血小板的激活率如图8(c)所示。以上结果表明了CuII-GA/SeCA涂层具有优异的抗血小板粘附与激活的性能。
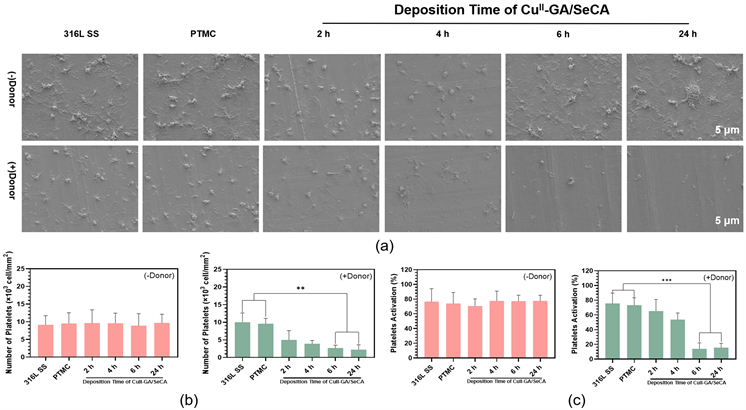
Figure 8. (a) The morphology of platelets on the surface of 316L SS, PTMC coating and CuII-GA/SeCA coatings deposited for different time; (b) Adhesive number of platelets on the surface of 316L SS, PTMC coating and CuII-GA/SeCA coatings with different deposition time; (c) Platelet activation rate of 316L SS, PTMC coating and CuII-GA/SeCA coatings surface at different deposition times
图8. (a) 316L SS、PTMC涂层和沉积不同时间的CuII-GA/SeCA涂层表面血小板的形貌;(b) 316L SS、PTMC涂层和沉积不同时间的CuII-GA/SeCA涂层表面血小板的粘附数量;(c) 316L SS、PTMC涂层和沉积不同时间的CuII-GA/SeCA涂层表面血小板激活率
3.5. cGMP检测结果
NO可以通过cGMP通路来调控血小板中的Ca2+浓度,从而来调节血小板的粘附与激活,为了验证CuII-GA/SeCA涂层对血小板的作用是通过NO对血小板cGMP通路的调控而引起的,本文对血小板的cGMP的含量进行了检测,结果如图9所示,在CuII-GA/SeCA涂层和供体SNAP/GSH的作用下,NO进入了血液并和血小板作用使其cGMP的含量上升,进而引起上述抑制作用。且沉积6 h和24 h的CuII-GA/SeCA涂层上的血小板的cGMP含量相差不大。由此得出结论,CuII-GA/SeCA涂层可以和供体SNAP/GSH作用释放NO,并通过cGMP通路来调节血小板的粘附与激活。

Figure 9. Platelet cGMP synthesis concentration on the surface of 316L SS, PTMC coating and CuII-GA/SeCA coatings for different times
图9. 血小板在316L SS、PTMC涂层和沉积不同时间的CuII-GA/SeCA涂层表面cGMP合成浓度
4. 结论
在316L SS上成功地制备了PTMC涂层后,又在PTMC涂层上成功地制备了CuII-GA/SeCA涂层,实现了在生理条件释放NO,进而提升了材料表面的血液相容性,具有优异的抗血小板粘附与激活的性能,从而显著地提高了材料表面的生物相容性,实现了基于PTMC基底的具有一氧化氮催化释放功能的类仿生涂层制备构建。沉积6 h和24 h的CuII-GA/SeCA涂层无论是在NO催化释放速率,还是抗血小板的粘附与激活的能力上都没有显著性差异,这为CuII-GA/SeCA涂层的快速沉积提供了数据的支持,在可降解血液接触类材料的表面改性上具有一定的应用前景。
致谢
本研究由国家自然科学基金项目(Project 82072072)支持。
NOTES
*通讯作者。