1. 引言
近年来,对微生物基因组序列的分析结果显示,对于任意给定真菌,目前已经得到的次级代谢物不管在数量还是种类上都远不及它基因序列所显示的可能编码次级代谢物的生物合成基因簇数(BGCs) [1] [2]。这也就意味着目前绝大部分已知微生物仍具有巨大的研究潜力,只要实验设计得当,仍能获得大量结构新颖的活性化合物。造成这种现象的最主要原因是许多生物合成基因簇在实验室条件下不表达,通常被认为是沉默或隐蔽的。诱导这些沉默基因的表达可以解锁它们所控制的化学多样性,从而发现在医学和生物技术上具有巨大潜力的活性新分子。为了刺激这些沉默生物合成基因簇的表达,目前已有较多的方法,包括了遗传手段及培养手段的综合运用 [3]。
OSMAC (one strain many compounds)策略是其中较为巧妙,也是应用最为广泛且成熟的方法。OSMAC方法不是针对特定的沉默基因簇的激活,而是针对易于获取的培养参数的系统改变,包括了对培养基成分(碳源、氮源及盐),pH值,培养通气和培养温度的改变 [4] [5] [6] [7] [8]。这使得OSMAC方法成为用于调节微生物代谢一种可用、通用、廉价且相对简单的研究方法。通过更改培养基或加入一些物质,尽可能的打破或在一定程度上打破基因沉默现象,利用多种培养条件获得尽可能多类型的次级代谢产物。
费希新萨托菌Neosartorya fischeri NRRL 181是一种生长迅速的曲霉属真菌,已完成全基因测序,目前只发现了有限类型的化合物 [9] - [15]。antiSMASH的生物信息学预测却显示N. fischeri的基因组含有39个生物合成基因簇,其中25个与以前报道的任何天然产物无关,非常值得进行深入研究。本课题尝试了利用不同的培养基对费希新萨托菌进行培养,根据液相结果和薄层显色的结果选择了大米作为培养基进行大规模发酵,再对发酵浸膏进行了次级代谢产物研究,从代谢产物中共分离得到8个次级代谢产物。
2. 实验材料与研究方法
2.1. 实验仪器与实验材料
2.1.1. 实验仪器
高效液相色谱(安捷伦1100)、恒温摇床(上海福玛QYC-2112)、生化培养箱(上海博讯)、旋转蒸发仪(上海亚荣)、高压灭菌锅(日本Hirayama)、双人单面净化工作台(苏州SW-CJ-2FD)、超声波清洗器(昆山市KQ3200E)、电热恒温鼓风干燥箱(上海森信DGG-9140A)。
2.1.2. 实验材料
N. fischeri NRRL 181 (购自德国菌种保藏中心DSMZ)、乙酸乙酯(江苏强盛,分析纯)、色谱甲醇(美国TEDIA)、葡萄糖(AR)、硝酸钠(AR)、磷酸氢二钾(AR)、氯化钾(AR)、七水合硫酸镁(AR)、硫酸亚铁(AR)、石油醚(分析纯)、无水甲醇(分析纯)、氯仿(分析纯)、丙酮(分析纯)、MCI (上海BOS-M0001)、YMC ODS C-18反相填料(日本YMC)等。
2.2. 实验方法
2.2.1. OSMAC策略筛选较优的培养基
主要采用了在液体培养基(以察氏培养基作为起始培养基)中分别加入金属元素(Mn2+、Fe3+、Ba2+、Al3+、Co2+、Na+、Mg2+等)、抗菌药物(酮康唑、氟康唑)、其它微生物(面包酵母),或采用低氮(氮源比例降至原来的1/10)及低碳(碳源比例降至原来的1/10)策略、用富含营养成分的天然培养基(大米、豆粕、小麦麸、土豆培养基等)进行培养等方法对费希新萨托菌进行培养。
2.2.2. 大规模发酵
根据2.2.1的实验结果,选取了大米作为培养基进行了大规模发酵。发酵温度28℃,发酵时间30 d,发酵结束后用95%乙醇浸泡,每次浸泡5天,浸泡3次,过滤并合并滤液。
2.2.3. 次级代谢产物分离、纯化与结构鉴定
对2.2.2的中得到的滤液浓缩获得浸膏,再用乙酸乙酯萃取,分层后将乙酸乙酯层浓缩,后面反复利用普通硅胶、MCI、YMC ODS C-18反相填料、HW-40C凝胶等进行柱层析分离,利用制备型HPLC等仪器,结合重结晶等手段对化合物进行纯化,得到目标单体化合物。然后,综合运用现代波谱学方法(NMR、MS、IR、UV等)确定化合物的结构。
3. 研究结果和讨论
3.1. OSMAC策略筛选较优的培养基
3.1.1. 加入重金属对N. fischeri代谢产物的影响
实验结果表明,在培养基中加入较大量的Mn2+、Fe3+、Al3+、Co2+、Na+等金属离子后,菌株无法很好的在这些环境中生长,因此代谢产物也无法产生,而在Mg2+、Ba2+下生长状况良好。对比液相图(如图1,箭头指示的为色谱图中新出现的色谱峰或者化合物量明显增大的色谱峰,1#培养基代表相同实验条件下在原察氏培养基中培养N. fischeri的代谢产物,下同)可知加入Ba2+、Mg2+后对N. fischeri代谢产物均有大幅度提高,甚至产生了一些原本不产生的化合物,对比普通察氏培养基,20分钟以后几乎为一条直线,因此,这些新的突出峰均为N. fischeri产生得到的新的代谢产物,特别是在加入Mg2+后产生了三个新的峰位。研究可以证明,加入不同金属离子,Mg2+、Ba2+可能会增加N. fischeri代谢产物量,而其他金属离子大多对N. fischeri产生抑制甚至致命的作用。
3.1.2. 加入抗菌药物对N. fischeri代谢产物的影响
实验结果表明酮康唑浓度对菌株生长的抑制作用成正比。观察液相图(如图2),加入氟康唑和酮康唑后,在20分钟的时候的代谢产物均有增加,而其中加入氟康唑后没有其他代谢产物产生,加入酮康唑后在28分钟处产生了一个新的峰位,对比普通察氏培养基28分钟处为一条直线,可以得出该化合物为N. fischeri新的代谢产物,而且产生量特别大。

Figure 1. The changes of N. fischeri metabolites after adding metal ions
图1. 加入金属离子对N. fischeri代谢产物的变化
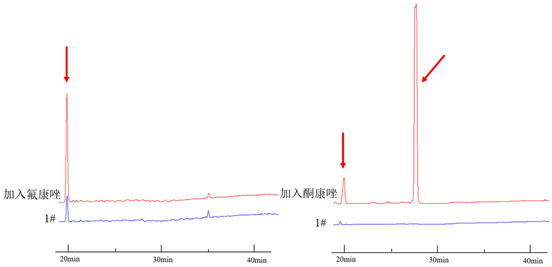
Figure 2. The changes of N. fischeri metabolites after adding ketoconazole or fluconazole
图2. 加入酮康唑和氟康唑对N. fischeri代谢产物的变化
3.1.3. 降低氮源比例对N. fischeri代谢产物的影响
氮源比例降低后的N. fischeri代谢产物明显比在正常的察氏培养基中培养得到的代谢产物要丰富的多,产生了很多原本不产生的化合物(图3)。
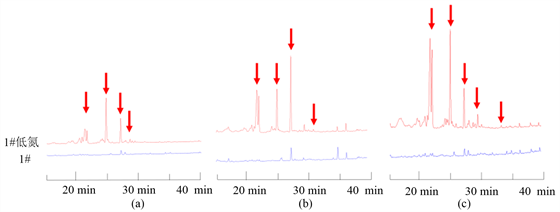
Figure 3. The differences of N. fischeri’s metabolites in low nitrogen source czapek’s medium and normal czapek’s medium. (a, b and c indicate the difference of the chromatograms detected at 225 nm, 254 nm, and 280 nm wavelengths respectively)
图3. N. fischeri在低氮察氏培养基和正常察氏培养基中代谢产物的差异。(a、b、c分别表示采用225 nm、254 nm、280 nm波长进行检测的色谱图差异)
3.1.4. 降低碳源比例对N. fischeri代谢产物的影响
碳源比例降低后的N. fischeri代谢产物种类与正常的察氏培养基中培养得到的代谢产物相近,但是其中某些化合物的代谢产物量得到了大幅度提高(图4)。
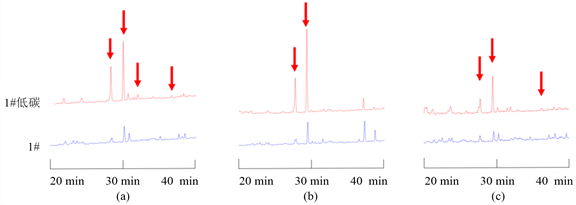
Figure 4. The differences of N. fischeri’s metabolites in low carbon source czapek’s medium and normal czapek’s medium. (a, b and c indicate the difference of the chromatograms detected at 225 nm, 254 nm, and 280 nm wavelengths respectively)
图4. N. fischeri在低碳察氏培养基和正常察氏培养基中代谢产物的差异。(a、b、c分别表示采用225 nm、254 nm、280 nm波长进行检测的色谱图差异)
3.1.5. 加入其它微生物对N. fischeri代谢产物的影响
发现加入面包酵母后,N. fischeri代谢产物中某些化合物的量得到了大幅度提高,甚至产生了一些原本不产生的化合物(结果见图5,如43.0 min的色谱峰)。从基因簇来分析可知面包酵母几乎没什么次级代谢产物,在相同条件下培养相同时间的面包酵母的代谢产物几乎为一条直线,这些都表明增加的化合物应该属于N. fischeri的代谢产物。
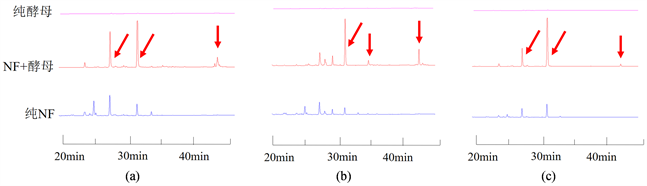
Figure 5. Effects on the secondary metabolites of N. fischeri after co-culture with yeast. (a, b and c indicate the difference of the chromatograms detected at 225 nm, 254 nm, and 280 nm wavelengths respectively)
图5. 与酵母共培养对N. fischeri次级代谢产物的影响(a、b、c分别表示采用225 nm、254 nm、280 nm波长进行检测的色谱图差异)
3.1.6. N. fischeri在天然培养基中的培养结果
实验结果表明大米培养基培养下N. fischeri代谢产物均较前文中涉及的液体培养的代谢产物更为丰富,且代谢产物量更大,为此选取了大米培养基这种天然培养基作为大规模发酵的培养基进行后续实验。
3.2. 大米培养基下获得的N. fischeri次级代谢产物
对在大米培养基中进行培养的N. fischeri代谢产物进行分离纯化后得到8个化合物,再通过核磁手段鉴定了它们的结构(如图6),分别为aszonalenin (1) [16]、acetylaszonalenin (2) [16]、麦角甾醇(3) [17]、(14α, 22E)-14-hydroxyergosta-7, 22-diene-3, 6-dione (4) [18]、β-胡萝卜苷(5) [19]、过氧麦角甾醇(6) [20]、(22E, 24R)-24-methyl-6b-methoxy-5a-cholesta-7,22-diene-3b,5-diol (7) [21]、cyathisterol (8) [22]。
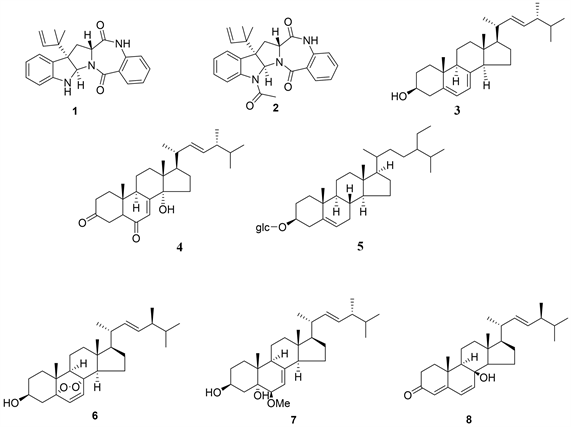
Figure 6. Secondary metabolites of N. fischeri grow on rice
图6. 大米培养基培养下的N. fischeri代谢产物
4. 结论
1) 通过OSMAC策略对费希新萨托菌的次级代谢产物进行研究,我们发现:
① 加入不同重金属元素对费希新萨托菌的次级代谢产物有不同的影响,尤其是Mg2+、Ba2+会增加N. fischeri次级代谢产物的量,而其他金属离子在达到一定浓度后大多对N. fischeri产生抑制甚至致死作用。
② 加入酮康唑和氟康唑均会对N. fischeri代谢产物量产生一定的影响,其中酮康唑的影响较为明显。
③ 降低氮源和碳源比例均会丰富N. fischeri代谢产物量。
④ 加入其它微生物后会刺激N. fischeri产生一些原来培养基中不产的化合物。
⑤ 富含营养的天然培养基培养下N. fischeri代谢产物较为丰富。
2) 对大米作为培养基培养N. fischeri结果的浸膏中的次级代谢产物进行研究,共分离并鉴定了其中8个化合物。
基金项目
国家级大学生创新创业训练计划项目(201911842009)、浙江省基础公益研究计划项目(LGF18B020001)、浙江树人大学省属高校基本科研业务费专项资金项目资助(2020XZ012)、浙江树人大学省属高校基本科研业务费专项资金项目资助(2020XZ007)。
NOTES
*通讯作者。