1. 绪论
亚硝酸钠化学式为NaNO2,白色粉末,有些也呈微黄色,易溶于水,是食品中一种很常用的添加剂。主要被用在腌菜和熟肉制品中,它可以抑制肉毒芽孢杆菌,对其他细菌也有一定的抑制作用;同时起防腐、着色、增强风味等的作用,鉴于亚硝酸盐对肉类、腌制品具有多种有益的功能,现在世界各地都允许使用。在一定的范围内食用不会对人体造成中毒,但一次食用太多会其人体具有致癌作用,3 g就会造成重度中毒;而一次性摄入0.2~0.5 g会造成轻度中毒,中毒的症状有头晕、头疼、身体无力、气短、恶心呕吐等 [1] [2],这给消费者的健康带来极大地危害,但目前还没有理想的代替物,因此用量需严加限制。如今,随着国内外的经济和科技的快速发展,测定亚硝酸盐的方法也越来越多,如离子色谱法、分光光度法、荧光光度法、催化光度法等 [3] - [9],虽然精确度比较高,但大多是采用了大型实验仪器、方法复杂不好操作,而碘量法简单易做,实验设备简单、试剂使用少、成本低、方法简单、快速,可以满足到相应邻域的准确分析要求,有一定的实际意义。
滴定法主要应用了酸性下亚硝酸钠的氧化性,通过硫代硫酸钠滴定碘单质来间接测定亚硝酸钠的含量。本文主要对碘量法测亚硝酸盐的方法进行研究,通过控制实验变量,来得出最佳的实验方案。
2. 材料与方法
2.1. 试剂与仪器
1) 乙酸溶液:(分析纯)天津市北辰方正试剂厂。
2) 盐酸溶液(1:1):(分析纯,石家庄市试剂厂)取250毫升的盐酸,稀释至500毫升。
3) 碘化钾溶液(0.01 g/ml):(分析纯,天津永晟精细化工厂有限公司)称取碘化钾2.5克,置于50毫升烧杯中加水溶解,然后洗入250毫升容量瓶中,定溶,摇匀,备用。
4) 淀粉溶液(0.5%):(分析纯,天津永大化学试剂有限公司)称取2.5克的淀粉,用水稀释至500毫升,加热溶解。
5) 硫代硫酸钠标准溶液(0.1 mol/L):(分析纯,天津市大茂化学试剂厂)称取16克硫代硫酸钠置于1000 ML新煮沸经冷却的蒸馏水中,待完全溶解后加入约0.2克的碳酸钠(Na2CO3),摇匀,置于棕色瓶中,放于暗处7天后标定。
6) 亚硝酸钠:天津市大茂化学试剂厂。
7) 分析天平:北京赛多利斯仪器系统有限公司(110 g, d = 0.1 mg)。
2.2. 实验原理和方法
2.2.1. 实验原理
采用碘量法滴定间接地测定亚硝酸盐含量,主要是利用了亚硝酸盐在酸性条件下具有一定的氧化性,可以把负一价的碘离子还原成为为碘单质。碘单质与淀粉溶液形成蓝色络合物,同时碘单质可以与硫代硫酸钠发生还原反应,使蓝色变成无色。根据这个特点,用硫代硫酸钠来滴定还原出来的碘单质,通过硫代硫酸钠的所用量,再间接计算出亚硝酸盐的含量。
2.2.2. 实验方法
取不同浓度的亚硝酸盐的标准溶液,用盐酸(1:1)调节其Ph值为4左右,加入浓度为0.01 mg/ml的碘化钾至过量,反应约4分钟后,用硫代硫酸钠滴加溶液至黄色变为浅色,再加入0.5%的淀粉4 ml,随后继续滴加硫代硫酸钠,直至蓝色变为无色,并且在半分钟内不变色。记录硫代硫酸钠的总量。并做空白实验对照。
3. 结果与分析
3.1. 确定最佳实验条件
3.1.1. PH值
由于亚硝酸盐在酸性条件下才与碘负离子反应,并生成碘单质,而且淀粉与碘单质的显色反应也需要酸性条件,故酸性化学试剂的选择与Ph值得控制极为重要。由于硝酸的氧化性太强不易使用,硫酸的酸性太强反应太快,也不易使用 [10],因此,我们主要研究盐酸和乙酸对回收率的影响。通过考察不同Ph下亚硝酸盐的回收率,来选择最佳的酸性物质和Ph。其他实验条件不变,改变酸性物质及调节PH值,测定其回收率。结果如图所示:
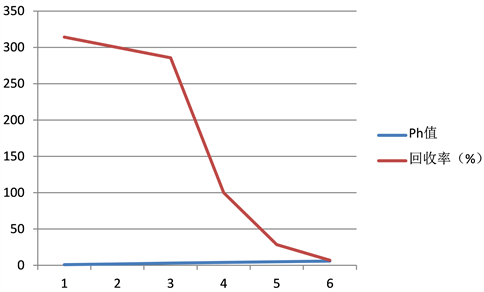
Figure 1. Effect of Ph value on recovery
图1. Ph对回收率的影响
由图1可知,在酸性太强时,会加速碘化钾的氧化,导致回收率偏大,而当酸性太弱,亚硝酸盐的氧化性不足以增强,导致回收率偏低,因此,应该选择适当的Ph值。如图在用10%的盐酸时,Ph值为4时,效果最好,回收率约为100%。而用乙酸时,因其Ph调动范围为2.4~4.8,在不要求很精确的条件下,乙酸酸度应调节为Ph = 3、Ph = 4,当Ph = 3时,效果最好,并且回收率接近100%。所以在常温常压情况下,两种都可以用,但严格上说,盐酸溶液中的Cl−有还原性 [10],所以最好用乙酸,但又由于乙酸的Ph范围太小,不容易调节,综合这两个试剂的利弊,本实验采用盐酸来调节Ph到4左右。
3.1.2. 反应时间
对于此实验时间的选择也是很重要的。如果反应时间过短,反应不彻底,则会导致回收率偏低;如果时间过长,过量的碘化钾会被氧化,导致测量偏差过大,导致回收率偏大。因此,时间的选择应该适当,才能确保测量结果准确。
同样的实验条件测不同时间下的亚硝酸钠的量。结果如图所示:
由图2可知,回收率随着时间的增加在逐渐的增大,随后趋于不变。这是由于时间过长,导致碘化钾的氧化,使回收率增加,最后趋于不变。如需准确的测得亚硝酸盐的含量,需将回收率控制在100%,如图在反应时间为4分钟时,回收率约为100%,因此,确定最佳反应时间为4分钟。
3.1.3. 淀粉的用量
由其他文献可知,过量的淀粉可以将碘包裹起来,在用硫代硫酸钠滴定碘时,由于碘被淀粉包裹了起来,而无法释放出来与其反应,从而使测定结果偏低;但是用量过少,则不容易显色或显色不彻底,而对反应有一定的误差,使回收率偏低 [11]。因此,在此实验中淀粉溶液的用量很重要。由其他文献可知,不同浓度的淀粉所用的量不同,此处我们选用0.5%的淀粉。
常温下取20 mg/kg的亚硝酸钠50 ml,加盐酸至Ph为4左右,再加入0.01 g/ml碘化钾过量,反应4 min后滴加标定后浓度为0.01035 mol/L的硫代硫酸钠至黄色变为浅色,滴加入不同量的0.5%的淀粉,继续滴加硫代硫酸钠至蓝色变为无色,记录所用硫代硫酸钠的总量。结果如下图所示。
由图3可知,起初回收率随着淀粉用量的增加而升高,当回收率达到100%后,又随着淀粉用量的增加而减少。0.5%的淀粉在用量为4 ml时回收率为100%,最接近亚硝酸盐的真实含量,因此,此处最佳的淀粉用量为4 ml。
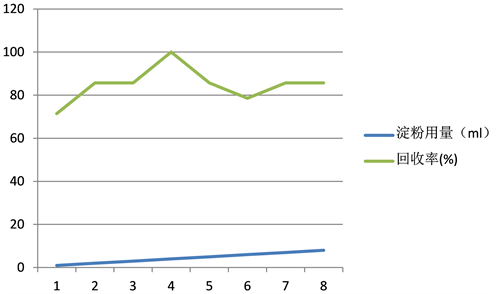
Figure 3. Effect of starch dosage on recovery
图3. 淀粉用量对回收率的影响
3.1.4. 反应温度
经其他文献可知,碘量法测亚硝酸盐温度一般控制在常温(25℃),现为查找最佳实验温度,通过做一系列不同温度下用碘量法测浓度为20 mg/kg亚硝酸钠的实验,来得出最佳实验温度。
取亚硝酸钠50 ml,保持溶液Ph值为4 (用盐酸控制溶液酸度为4),滴加浓度为0.01 g/ml的碘化钾过量,反应时间都为4分钟,然后滴加0.01035 mol/硫代硫酸钠至黄色变为浅色,再加0.5%的淀粉4 ml,继续滴加硫代硫酸钠至蓝色变为无色,记录所用硫代硫酸钠的总量。结果如图所示:
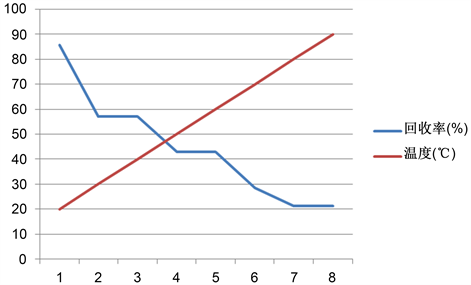
Figure 4. Effect of temperature change on recovery
图4. 回收率随温度的变化
如图4可知,亚硝酸盐的回收率随着温度的增加而逐渐的降低。那是因为温度过高,会导致酸的挥发和反应的加速,因此随着温度的升高,硫代硫酸钠的消耗量在逐渐的减少,从而导致回收率的下降。由其实验可知,保持温度在常温时,反应的效果最好,且常温温度波动不是很大,因此,反应温度控制在常温即可。
3.1.5. 灵敏度
通过以上实验条件的确定(酸性物质为盐酸,Ph值为4,反应时间为4 min,淀粉用量为4 ml,反应温度为常温),配置不同浓度的亚硝酸钠,测其回收率,以确定碘量法测亚硝酸盐的适用范围。结果如图所示:
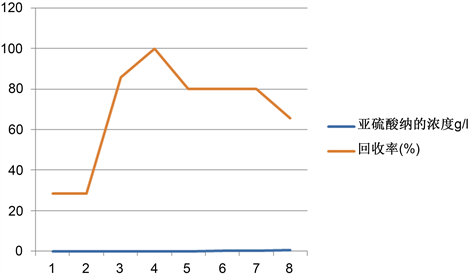
Figure 5. Effect of nitrite concentration on recovery
图5. 亚硝酸盐的浓度对回收率的影响
由图5可知,亚硝酸盐的浓度过高或者过低回收率都不高,碘量法测定亚硝酸盐的含量对亚硝酸盐的浓度有一定的要求,为了保持回收率在70%以上,由图5可知亚硝酸盐的浓度应控制在0.01 g/l至0.2 g/l内。因此,亚硝酸盐浓度的适用范围大约为0.01~0.2 g/l。
4. 结论
本文对碘量法测亚硝酸盐的全过程进行了研究,探讨了Ph值、碘化钾浓度、淀粉用量、温度、反应时间等主要实验条件,确定的最佳实验条件为用盐酸调节酸度,最佳Ph值为4,反应时间为4 min,淀粉用量为4 ml,反应温度为常温。碘量法测亚硝酸盐这种方法与其他方法相比较,使用仪器简单、快速、便捷,即便是小型的实验室也可以快速的测定食物中的亚硝酸盐的含量,准确度也很高,具有一定的实际意义。
NOTES
*通讯作者。