1. 引言
系统性红斑狼疮(systemic lupus erythematosus, SLE)是一种慢性炎症性系统性自身免疫疾病,其特征主要为对核抗原的耐受力下降以及IC (immune complex, IC)在组织中沉积导致炎症。SLE发病机制复杂,涉及免疫系统的多种细胞成分。近来研究发现IFN-α与SLE关系密切,一些用重组人IFN-α治疗病毒性肝炎和血液系统恶性肿瘤的患者发展为SLE,当IFN-α治疗停止时,SLE相关症状通常会改善 [1]。提示IFN-α可能在SLE发病过程中起重要作用。最近发现中性粒细胞通过形成中性粒细胞胞外诱捕网(neutrophil extracellular traps, NETs)的细胞外结构杀死细菌。该结构主要由组蛋白、DNA和众多蛋白酶组成,其中蛋白酶包括弹性蛋白酶(elastase, NE)和髓过氧化物酶(myeloperoxidase, MPO) [2]。既往研究表明,与健康对照组相比SLE患者组表现出NETs降解能力的下降。这提示NETs可能与SLE具有相关性,且这种相关性可能是由多种细胞因子介导。本次实验通过检测SLE患者体内IFN-α、MPO、NE水平,分析它们与各临床表现、血清学指标及疾病活动度的相关性等,明确SLE患者体内IFN-α、NETs意义。
2. 资料与方法
2.1. 一般资料
选自2019年6月至12月于青岛大学附属医院风湿免疫科住院SLE患者98例。入组患者均符合美国风湿病学会1997年修订的SLE诊断标准,所有纳入患者近期采血前未行大剂量免疫抑制药物及泼尼松等药物治疗。排除标准:其他自身免疫性疾病;冠心病、甲亢、抑郁症,严重感染。健康对照组选自2019年6月至12月于青岛大学附属医院健康查体中心查体者63例。纳入人群无自身免疫相关性疾病、原发性高血压、糖尿病、近期感染及相关遗传疾病家族史,除外妊娠及哺乳期患者。
收集SLE组与健康对照组的个人信息与临床资料,记录SLE患者的实验室指标,包括血常规、C反应蛋白(C-reactive protein, CRP)、红细胞沉降率(Erythro-cyte sedimentation rate, ESR)、24小时尿蛋白、补体C3、抗可溶性抗原(Extractable nuclear antigen, ENA)抗体谱、抗dsDNA抗体。同时收集明确患者此次入院后的皮肤、关节、神经精神、血液等各系统临床表现以及SLEDAI评分 [3]。
本研究方案经本院伦理委员会批准,且所有研究对象均知情同意。
2.2. 主要试剂与仪器
人中性粒细胞弹性蛋白酶酶联免疫吸附测定试剂盒、人干扰素α酶联免疫吸附测定试剂盒购于武汉伊莱瑞特生物公司,人髓过氧化物酶酶联免疫试剂盒购于武汉华美生物工程有限公司。Nano Drop分光光度计、酶标仪来自美国Thermo Fisher公司。
2.3. 研究方法
早5:00采集被研究者空腹静脉血3 ml,在实验室使用离心机以3000转/分离心标本10分钟,用移液器移取离心后的上层血清1 ml装于EP管中,随即编号,将标本保存于−80℃冰箱待用。所有血清避免反复冻融。血清IFN-α、NE、MPO检测均采用ELISA法,具体操作步骤按照试剂盒说明书进行,最后于酶标仪上检测A450 nm吸光值,计算结果。
2.4. 统计学方法
采用SPSS 23.0统计软件进行数据分析,计量资料满足正态分布以(X ± S)表示,偏态分布资料以中位数四分位间距[M(QR)]表示,正态分布的计量资料两组间差异性分析用独立样本T检验,不符合正态分布的计量资料差异性分析用秩和检验。两指标相关性分析服从正态分布的进行Pearson相关性分析,不服从正态分布的进行Spearman相关性分析,p < 0.05时差异有统计学意义。
3. 结果
3.1. 一般情况分析及临床特点
分别收集SLE患者组、健康对照组人群的临床及实验室资料,其中SLE患者98例,男性7例,女性91例,年龄(14~74)岁,平均年龄(36.34 ± 14.351)岁;健康对照组63例,男性9例,女性54例,年龄(16~67)岁,平均年龄(39.94 ± 11.00)岁。根据被纳入的2组人群结果分析显示他们在性别年龄方面无统计学差异(P > 0.05)。SLE患者临床表现多样,尤以泌尿系统损害为著(SLE患者及健康对照组一般情况见表1)。

Table 1. Comparison of general conditions between healthy control group and SLE group
表1. 健康对照组及SLE组一般情况比较1
3.2. SLE患者组、健康对照组血清中IFN-α、NE及MPO的水平
ELISA法检测血清中IFN-α、NE及MPO的水平。结果:SLE患者组血清IFN-α、NE、MPO的水平较健康对照组显著增高(p < 0.05),差异有统计学意义(见表2)。

Table 2. Levels of IFN-α, NE and MPO in serum of patients with SLE and healthy controls
表2. SLE患者组、健康对照组血清中IFN-α、NE、MPO的水平
*表示与健康对照组比较p < 0.05。
3.3. SLE患者组血清IFN-α、NE、MPO水平与疾病活动度的关系
在资料收集时根据SLEDAI评分对98例SLE患者进行评分,并分别分析IFN-α、NE、MPO与SLEDAI评分的相关性。结果表明:SLE患者组血清IFN-α、NE、MPO的水平与SLEDAI呈正相关(r = 0.461, p = 0.000; r = 0.268, p = 0.008; r = 0.203, p = 0.045) (见图1)。

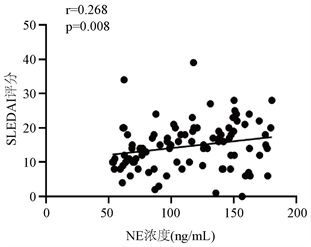

Figure 1. Correlation between serum IFN-α, NE, MPO and SLEDAI in patients with SLE
图1. SLE患者血清IFN-α、NE、MPO与SLEDAI的相关性
3.4. SLE患者组IFN-α、NE及MPO水平与血清学指标关系
3.4.1. SLE患者组IFN-α的水平与血清学指标的关联
SLE患者血清中IFN-α水平与补体C3、Hb呈现负相关关系(r = −0.204, p = 0.044; r = −0.213, p = 0.035);与ESR、24 h尿蛋白定量、抗dsDNA抗体水平呈正相关(r = 0.217, p = 0.032; r = 0.262, p = 0.009; r = 0.225, p = 0.026) (见图2)。与CRP、Plt、抗心磷脂抗体、抗核糖核蛋白(ribose nuclear protein, RNP)抗体、抗史密斯(Smith, sm)抗体、抗核糖体p蛋白(ribosomal P protein, rRNP)抗体无关(p > 0.05)。
3.4.2. SLE患者组NE的水平与血清学指标的关联
血清NE水平与Hb、24 h尿蛋白定量、抗dsDNA抗体、血清补体C3、ESR、CRP、plt、抗心磷脂抗体、抗RNP抗体、抗sm抗体、抗rRNP抗体无关(p > 0.05)。
3.4.3. SLE患者组MPO的水平与血清学指标的关联
血清MPO水平与抗dsDNA抗体呈正相关(r = 0.208, p = 0.04),与Hb、24 h尿蛋白定量、血清补体C3、ESR、CRP、plt、抗心磷脂抗体、抗RNP抗体、抗sm抗体、抗rRNP抗体无关(p > 0.05)。
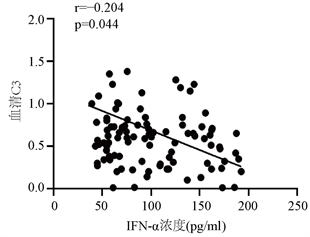
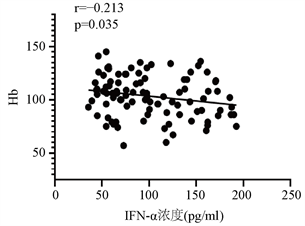

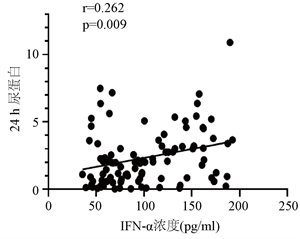
Figure 2. Analysis of the correlation between serum IFN-α level and serum C3, ESR, Hb and 24-hour urinary protein
图2. 血清IFN-α水平与血清C3、ESR、Hb、24 h尿蛋白定量相关性分析
3.5. SLE患者组血清IFN-α、NE、MPO水平与临床表现的关系
3.5.1. SLE患者组 IFN-α的水平与临床表现的关联
血清IFN-α水平与血液系统、泌尿系统、关节炎、皮疹、光过敏等临床表现呈正相关(p < 0.05),与精神神经系统无关(p > 0.05) (见表3)。

Table 3. Correlation between IFN-α levels and clinical manifestations in patients with SLE
表3. SLE患者IFN-α水平与临床表现的相关性
注:*p < 0.05,有统计学意义。
3.5.2. SLE患者组NE的水平与临床表现的关联
血清NE水平与皮疹临床表现呈正相关(p < 0.05),与血液系统、泌尿系统、关节炎、光过敏、精神神经系统无关(p > 0.05) (见表4)。

Table 4. Correlation between NE levels and clinical manifestations in patients with SLE
表4. SLE患者NE水平与临床表现的相关性
注:*p < 0.05,有统计学意义。
3.5.3. SLE患者组MPO的水平与临床表现的关联
血清MPO水平与血液系统、泌尿系统、关节炎、光过敏、精神神经系统、皮疹无关(p > 0.05)。
3.6. SLE患者组血清IFN-α、NE、MPO水平之间的关联
3.6.1. SLE患者组血清 NE、MPO水平之间的关联
SLE患者组血清NE、MPO均可反应NETs水平,统计学显示NE、MPO呈正相关(r = 0.234, p = 0.02) (见图3),说明两者检测结果反映NETs水平相符。
3.6.2. SLE患者组血清IFN-α、NE水平之间的关联
统计学显示SLE患者血清中IFN-α、NE呈正相关(r = 0.245, p = 0.015) (见图3)。
3.6.3. SLE患者组血清IFN-α、MPO水平之间的关联
统计学显示SLE患者血清IFN-α、MPO呈正相关(r = 0.273, p = 0.007) (见图3)。
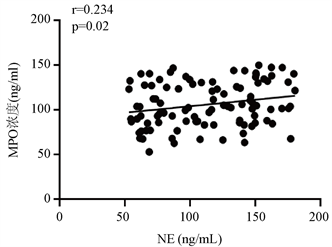
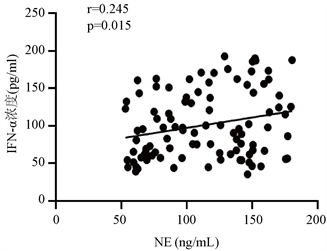
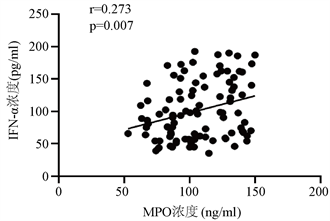
Figure 3. Relationship between serum MPO level, serum NE level and serum IFN-α level
图3. 血清MPO水平、血清NE水平、血清IFN-α水平关系图
4. 讨论
SLE是一种以体内产生多种自身抗体为血清学特征、以多组织及多脏器受累为临床特征的经典性自身免疫性疾病。SLE发病机制尚未完全明确,目前普遍认为免疫、遗传、感染、环境、性激素等因素参与其中,免疫因素可能起较大作用,诸多细胞因子也可能参与其中。IFN-α作为I-IFN的重要组分之一,主要具有抗病毒、抗增殖和免疫调节作用。IFN-α主要由pDC产生 [4]。目前研究发现IFN-α可能参与了多种自身免疫性疾病的发病,如SLE、类风湿关节炎、干燥综合征等。
本次研究结果显示SLE患者组血清IFN-α的水平较健康对照组显著增高,与既往凌磊 [5] 等人文献报道是相符合的。提示可能异常增多的IFN-α参与了SLE的发病。IFN-α异常增多的原因众多,推测主要包括I-IFN诱导物持续存在、众多涉及I-IFN产生的遗传因素以及产生I-IFN的多种细胞的异常激活 [6]。过度激活的I-IFN可能通过不同机制改变免疫功能来实现SLE发病 [7],调控T细胞及B细胞等各种免疫细胞的生存、激活及重要功能都被包含在内。本次研究表明SLE病人中IFN-α的血清水平与SLE患者的SLEDAI评分,血液系统、泌尿系统、关节炎、皮疹、光过敏等临床表现以及与抗dsDNA抗体、ESR、24 h尿蛋白定量呈正相关,而与血清补体C3、Hb呈负相关。以上结果均与文献报道相符合。说明IFN-α水平与SLE的疾病活动度及严重程度关系密切,提示血清IFN-α水平的增高可能可以作为一种SLE的临床诊断标准及病情严重程度的判断标准。
NETs的形成是一种细胞死亡途径,中性粒细胞以网状结构挤压出核物质(如组蛋白、去浓缩染色质和细胞质蛋白),NETs可以捕获入侵的病原体。NETs在SLE疾病发生、发展过程中发挥着重要作用。本次研究显示SLE患者组血清NE、MPO的水平较健康对照组显著增高,提示NETs在SLE发病过程中起重要作用,与既往蒋秋梅等人 [8] 研究结果一致。推测NETs在SLE中发病机制可能与体内NETs生成作用增强或与体内NETs降解减弱有关。本次实验显示SLE患者血清NE水平与SLEDAI评分、皮疹表现呈正相关,SLE患者组血清MPO水平与SLEDAI评分、抗dsDNA抗体呈正相关。这一定程度上说明NETs与SLE活动度相关。但此次实验显示NE、MPO与SLE众多器官累及临床表现及部分血清学指标无关,这与Rother [9] 等人的既往研究结果不符。分析原因不排除样本量太少等原因。
本次实验结果显示IFN-α与NE、MPO呈正相关,提示外周血NETs水平与血清中IFN-α水平相关。相关机制可能如下:1) SLE患者体内的自身抗体会刺激NETs生成 [10]。NETs通过产生IFN-α和激活补体系统经典途径和替代途径来促进自身免疫参与发病。2) SLE患者中,NETs的含量能够诱导pDC产生IFN-α [11]。进而参与SLE病理过程。
本研究明确与分析了血清IFN-α、MPO、NE水平及其与SLE血清学指标、临床表现以及SLEDAI评分之间的相关性。并且发现NETs与IFN-α之间可能存在某种关系。下一步要从细胞因子的转录表达,具体的信号转导通路等角度出发,进一步探究它们在SLE中的作用及关系。
NOTES
1注:满足正态分布的计量资料用(X ± S)表示,偏态分布计量资料以中位数四分位间距[M(QR)]表示。