1. 引言
近年来研究发现,慢性应激是很多精神疾病和躯体疾病的明显诱发因素,并且认为慢性、低强度以及长期的日常压力是引发抑郁的主要原因 [1]。抑郁症是一种常见、高发的心理性疾病,影响患者的生活质量,给家庭和社会带来一定的负面影响。目前,抑郁症的治疗主要是心理治疗和药物治疗为主。通过各种途径有效保护海马,促进神经细胞的再生,是抗抑郁症治疗和药物开发的主要方向之一。但是它们的效果并不理想,药物疗效持续性欠佳,复发率也高 [2]。本研究拟通过睡眠剥夺方法探讨其对抑郁模型大鼠海马盐皮质激素受体(Mineralocorticoid Receptor, MR)的影响及其可能的作用机制,以进一步研究和探讨抑郁发生和发展的机制,以及可改进的治疗方案,为临床抑郁症患者的治疗、转归,提供一些比较有参考价值的数据支持。
2. 材料与方法
2.1. 实验动物
实验选用雄性Sprague Dawley (SD)大鼠,8周龄,体重250 ± 10 g,50只,购于上海斯莱克实验动物有限责任公司,实验动物生产许可证号:SCXK(沪)2007-0005,质量合格证号:2007000525946,于福建省中医药科学院比较医学中心实验动物SPF级饲养室喂养。本研究所涉及动物实验经我院实验动物福利伦理委员会批准。
2.2. 主要试剂和药物
Anti-Mineralocorticoid Receptor antibody [H10E4C9F] (ab2774)购于Abcam公司。β-Actin (8H10D10) Mouse mAb (CST: #3700);Anti-mouse IgG, HRP-linked Antibody (CST: #7076S)购于CST公司。西药对照药盐酸氟西汀胶囊(百忧解)由福建省中医药科学院提供。
2.3. 实验大鼠慢性应激抑郁模型的建立
参考关于大鼠慢性应激抑郁模型文献 [3] [4],首先将50只雄性SD大鼠于正常饲养环境下饲养1周(本实验称为0周),在此期间,大鼠群养(每笼5只),可以自由饮食和饮水,同时给予1%糖水进行训练。在0周结束时,对所有大鼠禁水20 h,然后测定其在1 h内对1%糖水摄取量,从中筛选出糖水摄取量相近的大鼠40只,并将其分成以下4组:正常组、抑郁模型组、西药组、睡眠剥夺组。除了正常对照组外,其余3组大鼠均给予不可预测的慢性应激21天:包括强迫游泳(8 min)、禁水(20 h)、同笼饲养(16 h)、昼夜颠倒(12 h)、打湿垫料(20 h)、45度倾斜笼子(16 h)和放置异物(7 h)等等,每天随机安排上述1种以上的刺激方式。所有实验均在福建省中医药科学院动物实验室进行,湿度79%RH,室温22℃,自然昼夜光照。
2.4. 实验大鼠睡眠剥夺方法
采用改良多平台睡眠剥夺法(modified multiple platform method, MMPM)进行96 h睡眠剥夺 [5]。实验平台装置:水槽153 cm × 52 cm × 52 cm,水槽内放置有10个小平台,每个小平台直径6.5 cm,高15 cm,两平台间隔约15 cm,水槽内加水至平台面以下l cm,水温保持在22℃ ± 2℃,水槽顶部有水和食物可供实验大鼠摄取。大鼠可在平台间自由活动,当进入快动眼睡眠(rapid eyes movement, REM)期时,大鼠全身肌张力会下降,由于平台较小,大鼠的肢体就会失去平衡而触水惊醒,从而产生REM睡眠剥夺效应。
2.5. 大鼠空间学习记忆能力检测
采用Morris水迷宫实验对大鼠空间学习记忆能力进行测试 [6]。
2.5.1. 定位航行实验
在模型建立前,使用Morris水迷宫训练实验大鼠3天。每天将大鼠按照4个象限顺序,从各象限中点面壁式入水,间隔5 min,计算机自动跟踪记录大鼠入水后找到平台的游泳时间即逃避潜伏期、游泳路径等参数。大鼠在90 s内找到平台,找到后在平台上保持4 s。大鼠爬上平台或时间超过90 s,实验自行终止。如90 s仍未找到平台,由实验者将大鼠引上平台休息10 s并将潜伏期记为90 s。以四个象限逃避潜伏期的算术平均值作为该次大鼠的学习成绩。
2.5.2. 空间探索实验
在定位航行实验结束的第二天同一时间进行空间探索实验,撤去平台,将大鼠从第I象限入水点放入水池,记录90 s内大鼠为搜寻平台而穿过平台象限的次数、时间百分比等参数作为大鼠的记忆成绩。
2.6. 实验大鼠的分组、给药及取材
模型建立后,正常组和模型组不灌服任何药物,正常条件下饲养。西药组灌服氟西汀溶液2.2 mg/kg,1次/天,连续灌胃3周 [7]。睡眠剥夺组,在实验结束前,采用改良多平台水环境法进行96 h睡眠剥夺。
实验结束,将所有实验大鼠用戊巴比妥钠腹腔注射麻醉(40 mg/kg),腹主动脉取血5 mL装到抗凝管中,离心取上清,分装离心管中冻存备用。取血后,断头,剪开头皮,用血管钳揭去颅骨和硬脑膜,剪断双侧视神经后用眼科镊子迅速取出大鼠的整个脑组织。用0.9%氯化钠溶液冲洗干净,分离出海马组织,置于液氮或−80℃保存备用 [8]。
2.7. Western Blotting蛋白检测
将实验结束后取材的大鼠海马组织按10 mg/100μL加入Western细胞裂解液中,海马组织经超声粉碎后12,000 r/min低温离心5 min,取上清液;采用BCA法测定蛋白浓度,95℃变性处理,SDS-PAGE凝胶电泳,浓缩胶80 V,30 min和分离胶120 V,90 min;300 mA转移到PVDF膜上,5%脱脂奶粉封闭60 min;上一抗4℃过夜,HRP标记的二抗室温孵育2 h,ECL显色,图像分析。应用Image J分析软件分析上述结果 [8]。
2.8. 统计学方法
实验结果用数据和图表显示,实验数据以
表示,用SPSS16.0统计分析软件进行数据处理,多组间比较用单因素方差分析,组间两两比较用t检验。以P < 0.05为差异存在统计学意义,P < 0.01为差异显著。
3. 结果
3.1. 各实验组大鼠体重的变化情况
为了验证慢性应激刺激对实验大鼠的生长状态的影响,对大鼠每周的体重进行统计分析,结果如图1所示:各组实验大鼠在模型建立之前的体重没有统计学差异(P > 0.05)。模型建立以后,与正常对照组相比较,模型组大鼠的体重明显低于对照组(P < 0.01)。与模型组比较,西药氟西汀组大鼠的体重增加具有显著的统计学差异(P < 0.05, P < 0.01);而睡眠剥夺组大鼠在第3周结束时的体重也显著增加(P < 0.01)。西药氟西汀的作用优于睡眠剥夺组(P < 0.01)。以上的实验结果表明,慢性的应激刺激对实验大鼠的生长不利,大鼠的体重在显著下降。而给予慢性应激抑郁大鼠西药氟西汀和睡眠剥夺均可以改善大鼠的生长状态,体重显著提升。
3.2. 各实验组大鼠空间学习和记忆能力的差异变化
通过Morris水迷宫实验,我们观察了不同实验组大鼠空间学习和记忆能力的变化情况,结果如表1所示:在定位航行实验中,同正常对照组相比较,模型组大鼠的逃避潜伏期时间显著延长(P < 0.01)。同模型组比较,西药组大鼠的逃避潜伏期时间显著缩短(P < 0.01),睡眠剥夺组大鼠的逃避潜伏期时间同样缩短,具有统计学差异(P < 0.05)。在空间搜索实验里我们发现,同对照组相比较,模型组大鼠的跨越平台次数显著减少(P < 0.01)。同模型组比较,西药组大鼠的跨越平台次数显著增加(P < 0.01),睡眠剥夺组大鼠的跨越平台次数同样增加,具有统计学差异(P < 0.05)。睡眠剥夺组大鼠跨越平台次数同西药组相比,没有统计学差异(P > 0.05)。本实验结果表明慢性的应激刺激影响实验大鼠空间学习和记忆能力,使得大鼠的该能力变差。睡眠剥夺可以改善由慢性的应激刺激引起的大鼠空间学习和记忆能力下降。
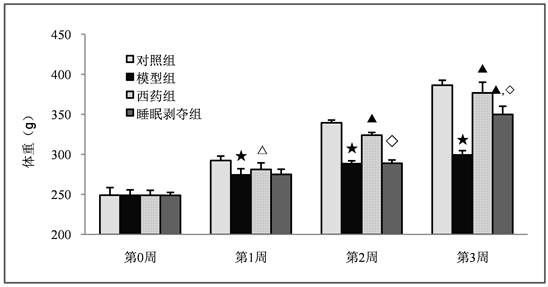 注:与对照组比较:★P < 0.01,△P < 0.05;与模型组比较:▲P < 0.01;与西药组比较:◇P < 0.01。
注:与对照组比较:★P < 0.01,△P < 0.05;与模型组比较:▲P < 0.01;与西药组比较:◇P < 0.01。
Figure 1. Weight changes of rats in each experimental group
图1. 各实验组大鼠体重变化

Table 1. Effects of sleep deprivation on learning and memory in depressed rats
表1. 睡眠剥夺对抑郁模型大鼠学习记忆能力的影响
注:与对照组比较:★P < 0.01;与模型组比较:▲P < 0.01,△P < 0.05;与西药组比较:◆P < 0.05。
3.3. 睡眠剥夺对抑郁模型大鼠海马盐皮质激素受体的影响
为了探索睡眠剥夺治疗抑郁大鼠的作用机理,我们以盐皮质激素受体为切入点,检测睡眠剥夺对慢性应激抑郁模型大鼠海马盐皮质激素受体的影响。Western Blotting实验检测各组大鼠的海马组织中盐皮质激素受体的表达变化,检测结果如图2,图3所示:同对照组相比较,模型组盐皮质激素受体的表达水平被显著的下调(P < 0.01)。同模型组相比较,西药组和睡眠剥夺组盐皮质激素受体的表达水平均被显著的上调(P < 0.01)。结果表明睡眠剥夺可以通过影响海马盐皮质激素受体发挥作用。
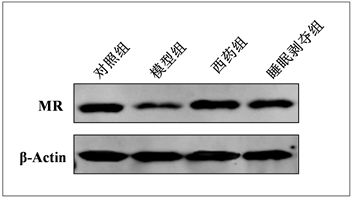
Figure 2. Expression of MR protein in hippocampal tissues of rats in each group
图2. 各组大鼠海马组织MR蛋白表达情况
 注:与对照组比较:★P < 0.01;与模型组比较:▲P < 0.01;与西药组比较:◇P < 0.05。
注:与对照组比较:★P < 0.01;与模型组比较:▲P < 0.01;与西药组比较:◇P < 0.05。
Figure 3. Semi-quantitative analysis of MR protein expression in hippocampal tissues of rats in each group
图3. 各组大鼠海马组织MR蛋白表达半定量分析
4. 讨论
随着经济全球化的快速发展,竞争日益激烈,人们的生活节奏加快,压力不断增加。这一系列负性应激增加,导致了抑郁症的触发和复发人数逐年上涨。抑郁症已被联合国卫生组织列为全球性社会问题,是负担最重的疾病之一 [9]。目前,抑郁症的病因并不十分清楚,其发病机制也不是很明确,现有的治疗措施效果不理想,有些药物还具有不良副反应。因此,寻找起效快速、安全无副作用的新治疗方法具有重要的临床意义。
文献研究报道睡眠剥夺可以在24 h内快速发挥抗抑郁的效果,这一效果比抗抑郁药物起效快,并且睡眠剥夺方法的安全性高于抗抑郁药物,没有毒副作用,是目前疗效最快、最安全的治疗抑郁的方法之一 [10]。睡眠剥夺疗法中,REM睡眠剥夺与全睡眠剥夺效果相近,起效快,不易复发 [11]。有文献研究报道,睡眠剥夺治疗抑郁症,其抑郁症状的有效缓解率可达40%~60% [12]。Boland EM等通过Meta分析发现睡眠剥夺对抑郁症的缓解率为45% [13]。赵颖琳等 [14] 研究发现,睡眠剥夺可以显著增加抑郁模型组大鼠的自发活动,使其抑郁行为得到改善。我们通过实验研究也发现,慢性应激可以引发大鼠抑郁样行为,睡眠剥夺能够改善慢性应激引起的抑郁症状,提高实验大鼠的生长状态。同模型组比较,睡眠剥夺能够使抑郁模型大鼠的体重显著增加(图1,P < 0.01)。
最早由Duman等 [15] 提出海马神经发生损伤与抑郁症的发病机制有关系。海马对情绪和学习记忆极为重要,多种细胞因子、激素等刺激因素均可使其损伤。研究发现,抑郁症患者的海马体积显著缩小,并与应激作用的时间呈正相关 [16]。我们通过Morris水迷宫实验也发现,与模型组比较,睡眠剥夺组大鼠的逃避潜伏期时间明显缩短(P < 0.05),大鼠的跨越平台次数显著增加(P < 0.05),同西药组相比,没有统计学差异(P > 0.05) (表1)。这一结果表明,睡眠剥夺可以改善由慢性的应激刺激引起的大鼠空间学习和记忆能力下降。
睡眠剥夺治疗抑郁症的机制大多与神经递质、激素、睡眠节律以及神经可塑性等因素相关 [17]。下丘脑–垂体–肾上腺素轴(hypothalamic-pituitary-adrenal axis, HPA轴)在应激过程中起到重要的调节作用,HPA轴的功能亢进使抑郁症重要的发病机制之一 [18]。慢性应激可以激活HPA轴,使得糖皮质激素分泌增多,当脑内的皮质酮或皮质醇升高时,高表达糖皮质激素受体的海马组织会受到攻击,导致认知和情感功能受到影响。同时海马通过糖皮质激素受体对HPA轴有负调控作用,海马的损伤又会加重HPA轴功能紊乱 [19]。既往实验研究,对于抑郁症可能机制的探讨包括其与血清皮质酮的相关性,海马神经元的损伤与抑郁症状变化的相关性。尚未有进一步研究揭示,与血清皮质酮密切相关的海马盐皮质激素受体通过海马边缘系统在抑郁发生发展中的影响。因此,为了探究慢性应激引起的抑郁症以及通过睡眠剥夺方式干预与海马盐皮质激素受体的相关性,我们通过实验检测了大鼠海马组织盐皮质激素受体的表达情况。研究结果发现了,慢性应激引起的抑郁症模型大鼠海马盐皮质激素受体表达被显著下调(P < 0.01),而睡眠剥夺可以显著上调抑郁模型大鼠海马盐皮质激素受体的表达(P < 0.05) (图2,图3)。
通过以上这些研究结果部分证实了,睡眠剥夺可以改善慢性应激抑郁模型大鼠的生长状态,提升抑郁模型大鼠空间学习和记忆能力,并且其作用机制可能与大鼠海马盐皮质激素受体途径有关。
5. 结论
综上所述,临床上常见的慢性应激引起的抑郁的机制可能与海马盐皮质激素受体途径相关,睡眠剥夺通过调节海马盐皮质激素受体,进而降低皮质酮的释放,达到治疗抑郁的目的。关于睡眠剥夺如何通过调控海马盐皮质激素受体途径防治抑郁的机制还需要进一步的深入研究。
基金项目
福建省科技厅公益类科研院所基本科研专项项目(2017R1035-3, 2017R1035-5)。
NOTES
*通讯作者。