1. 引言
桑树(Morus alba Linn.)广泛种植于东亚地区,是一种重要的经济作物。桑叶是桑树的树叶,也是一种重要的药食两用的植物资源。《中华人民共和国药典》中对桑叶的描述为性甘、苦、寒,归肺经和肝经 [1]。《本草纲目》等中医著作中记载桑叶可以清肝明目,可以带茶引用,去除水肿等疾病,有利于五脏六腑。现代研究也认为,桑叶中含有多种功效活性成分,包括蛋白质、黄酮、生物碱等物质。其中从桑叶中提取的1-脱氧野尻霉素(1-deoxynokirimycin, DNJ)是一种重要的天然降血糖活性成分,引起了研究人员的广泛关注 [2]。除此之外,桑叶中含有的不饱和脂肪酸、矿物质、甾醇类等活性成分对高血糖和高血脂均有一定的预防和治疗效果 [3]。
多糖是由一种或多种单糖以糖苷键相互连接构成的直链或含有支链的大分子聚合物。多种来源的多糖具有抗氧化、抗炎症、抗癌等生物活性。本课题组前期研究显示某些真菌来源的多糖可以显著降低血糖和血脂水平,同时还具有保护肝脏和抗衰老等生物活性 [4] [5] [6]。某些植物来源的多糖表现出显著的降血糖和降血脂活性。研究显示,山楂多糖可以抑制多种高血糖和高血脂症的关键酶活性 [7]。而前期研究中对于桑叶的活性物质主要局限在生物碱和黄酮类物质的研究,对于桑叶多糖的研究较为缺乏。韩爱芝等人优化了药桑叶多糖的提取条件,并检测了其对α-葡萄糖苷酶的抑制作用,结果表明药桑叶多糖具有一定的降血糖活性 [8]。魏文杰等人利用Box-Behnken-响应面法优化了桑叶多糖的提取工艺,确定了最佳提取条件,提取的粗多糖具有显著的抗氧化等活性 [9]。
本研究采用前期研究优化的桑叶多糖提取条件获得粗多糖,之后使用savage试剂脱蛋白,过氧化氢处理脱色,然后透析袋透析,对桑叶粗多糖进行精制,获得桑叶多糖(MLP)。通过多种体外实验检测MLP的降血糖和降血脂活性,为解释其作用机理和深入研究奠定了理论基础。
2. 材料与方法
2.1. 材料与试剂
霜桑叶购自合肥徽州中药堂,可溶性淀粉、3,5-二硝基水杨酸、四水合酒石酸钾钠、牛磺胆酸钠、甘氨胆酸钠、聚乙烯醇、橄榄油、胰脂肪酶、胃蛋白酶、α-淀粉酶、阿卡波糖购自国药集团化学试剂有限公司;α-葡萄糖苷酶、PNPG购自阿拉丁试剂公司;浓盐酸、浓硫酸、苯酚购自上海中成化学试剂有限公司;其他常规药品均为市售分析纯药品。
2.2. 仪器与设备
本研究中使用的主要设备如下,弗朗顿M350破壁机(广东佛山市尚艾斯电器有限公司),752型紫外可见分光光度计(上海菁华仪器有限公司),数显恒温水浴锅(金坛市江南仪器厂),TDL-50B型台式离心机(上海安亭科学仪器厂),RE-85旋转蒸发仪(上海青浦沪西仪器厂),冷冻干燥机FD-1B-50 (北京博医康实验仪器有限公司)。
2.3. 方法
2.3.1. 桑叶粗多糖的提取分离
参照报道的提取条件并做一定的改进对桑叶多糖进行提取 [8] [9]。桑叶经破壁机粉碎后,过100目筛,称取一定量桑叶粉,按照料液比1:30与蒸馏水进行混合。在60℃水浴槽中浸提5小时,过滤后重复浸提3次,然后合并浸提液,减压旋蒸浓缩至膏状,后与3倍体积的95%乙醇混合,4℃冰箱内静置过夜。在4000 g下离心10 min,除去上清液,获得桑叶粗多糖。
2.3.2. 桑叶多糖的纯化
采用Sevage法对粗多糖进行脱蛋白处理 [10]。桑叶粗多糖溶于蒸馏水,向多糖溶液中加入1/3体积的Sevage试剂(氯仿、正丁醇溶液体积比5:1),混合物剧烈振摇20 min,静止20 min,反复操作5~6次。之后用分液漏斗分液,去除水层与溶剂层交界处的变性蛋白。重复以上操作至水相与溶剂相的交界面无胶状变性蛋白质(即乳白色分界)时,即为脱蛋白结束。
利用过氧化氢的强氧化性能对多糖进行进一步脱色处理,向多糖溶解液中加入十分之一体积的浓度为30%的过氧化氢溶液,50℃保温脱色1天,期间每隔12小时补充一次过氧化氢溶液,脱色最终得到淡黄色的溶液。
透析处理以去除小分子物质,经脱蛋白和脱色处理后的多糖溶液放进透析袋(直径25 mm、截留分子量3500 Da)中,自来水透析48 h,后蒸馏水透析24 h。多糖溶液旋蒸浓缩,于−80℃冰箱中冷冻24 h后置于冻干机中处理24 h,最终得到桑叶多糖(MLP)。
2.3.3. MLP对α-葡萄糖苷酶和α-淀粉酶抑制活性
MLP对α-葡萄糖苷酶的抑制活性根据相关文献进行检测 [11]。首先,将50 μL的MLP溶液与100 μL的α-葡萄糖苷酶(0.5 U/mL)溶液混合,在37℃下孵育10分钟。后向样品溶液中加入100 μL的pPNG (5 mM),37℃下孵育20分钟。反应结束后,加入1 mL的碳酸钠溶液(1 M)终止反应。阿卡波糖作正对照,实验过程与上述过程一致。终止反应后,溶液在405 nm处测量吸光值,并计算α-葡萄糖苷酶的抑制率:
α-葡萄糖苷酶抑制率(%) = [1 − (Asample-Acontrol-1)/Acontrol-2] × 100 (1)
其中Acontrol-1是pPNG溶液和样品的混合物,不添加α-葡萄糖苷酶的溶液吸光值;Acontrol-2是pPNG和酶的混合物,不添加样品(MLP)的溶液吸光值。
参照文献检测MLP对α-淀粉酶抑制活性 [11]。0.4 mL的α-淀粉酶(2 U/mL)溶液与0.2 mL多糖溶液在37℃下预混合10分钟。然后,向混合液中加入0.3 mL的淀粉溶液(5%),反应10分钟后,加入2 mL的DNS试剂(10 mg/mL 3,5-二硝基水酸和120 mg/mL酒石酸钾钠溶于0.4 mol/L的氢氧化钠溶液),在100℃加热15分钟以终止反应。冷却到室温后,在540 nm处测量吸光度。α-淀粉酶抑制活性的计算如下:
a-淀粉酶抑制率(%) = [1 − (Asample-A’sample)/Acontrol)] × 100 (2)
其中Acontrol、A’sample和Acontrol分别定义为样品、对照和样品空白对照的吸光值。阿卡波糖作为正对照。
2.3.4. MLP对脂肪酶抑制活性
参照相关文献检测MLP对胰脂肪酶活性的抑制能力 [12]。首先,以聚乙烯醇作为乳化剂,PBS (pH = 7.4)作为分散相,橄榄油为油相,制备乳化液,橄榄油含量(0.229 g/mL),加入一定浓度的MLP多糖溶液进行混合,混合液37℃水浴孵育10 min,后加入1 mL胰脂肪酶液(2 mg/mL),反应15 min,然后加15 mL 95%乙醇终止反应。酚酞作为指示剂,NaOH标准溶液滴定至微红色。空白实验的酶液在反应终止后加入。脂肪酶抑制活性的计算如下:
脂肪酶活性抑制率(%) = (不加MLP酶活性 − 加入MLP酶活性)/不加MLP酶活性 × 100% (3)
2.3.5. MLP对胆酸盐结合能力实验(模拟肠道环境)
参照相关文献报道方法,检测MLP对胆酸盐结合能力,判断其潜在降血脂活性 [13]。首先绘制甘氨胆酸钠和牛磺胆酸钠标准曲线,然后在模拟肠道环境下检测MLP与胆酸盐结合能力,判断其体外降血脂活性。
制备不同浓度的标准溶液(甘氨胆酸钠0.03、0.06、0.12、0.18、0.24、0.30 mmol/L,牛磺胆酸钠0.05、0.10、0.15、0.20、0.25、0.30 mmol/L) 2 mL于试管中,加入6 mL 60%的H2SO4,70℃水浴20 min,后冰浴5 min,分光光度计在387 nm波长处测定吸光度。
以胆酸盐含量为横坐标,吸光度为纵坐标绘得胆酸盐含量标准曲线。
取3 mL MLP溶液加入到3 mL 10 mg/mL胃蛋白酶溶液(溶于pH 6.3的0.1 mol/L PBS),1 mL 0.01 mol/L的HCl溶液,在37℃下消化处理1 h,模拟胃消化过程;之后,用0.1 mol/L的NaOH溶液调节溶液pH值至6.3,后加入4 mL 10 mg/mL胰蛋白酶,在37℃条件下,恒温振荡消化1 h,模拟肠道环境进行消化。每个样品中加入4 mL 0.4 mmol/L甘氨胆酸钠、0.5 mmol/L牛磺胆酸钠,在37℃条件下恒温振荡l h后混合物转移至离心管中,4000 r/min离心20 min,取上清液,比色法测定甘氨胆酸钠和牛磺胆酸钠含量,每个样品平行3次。胆酸盐结合率计算方法如下:
胆酸盐结合率(%) = (胆酸盐加入量 − 胆酸盐剩余量)/胆酸盐加入量 × 100 (4)
2.4. 数据处理
所有试验最少重复三遍,数据为平均值 ± SD,利用Excel处理数据。
3. 结果与分析
3.1. 桑叶多糖(MLP)的提取分离
前期研究对于桑叶多糖的提取主要针对于提取条件的优化,包括料液比,提取温度,提取时间,提取次数以及辅助提取的使用等因素。本研究中根据前期研究的结果,采用最优的提取条件,结果显示粗多糖的提取率在11.7%左右,与前期研究结果较为接近 [8]。由于桑叶粗多糖中含有大量的蛋白质和黄酮类等小分子物质,需要进一步的分离纯化 [14]。因此,使用savage试剂进行脱蛋白,由于蛋白质含量较高,一共需要进行5~6次脱蛋白操作,才可以基本上把蛋白质除掉。针对色素和黄酮类小分子物质,采用过氧化氢氧化处理,后对多糖溶液进行透析冻干,获得MLP。经过一系列处理,MLP的产率接3%左右。
3.2. MLP对α-葡萄糖苷酶和α-淀粉酶抑制活性
在淀粉消化吸收过程中,α-葡萄糖苷酶可以水解葡萄糖苷键,释放葡萄糖,提高血糖浓度等。抑制α-葡萄糖苷酶的活性可以有效抑制饭后体内血糖上升,同时这也可是筛选降血糖药物的常规体外检测方法。MLP对α-葡萄糖苷酶抑制作用整理在图1中。由结果可知,阿卡波糖具有较强的α-葡萄糖苷酶抑制作用,而且呈现出剂量依赖关系。在5 mg/mL的浓度作用下,阿卡波糖可以抑制大约60%的α-葡萄糖苷酶活性,这和前期研究结果较为吻合 [15]。同时,MLP也表现出对α-葡萄糖苷酶活性显著的抑制作用,而且呈现剂量依赖关系。在5 mg/mL的浓度作用下MLP对α-葡萄糖苷酶活性的抑制作用达到40%以上。杨玲等人研究了药桑叶活性物质对于α-葡萄糖苷酶活性的抑制作用,结果显示桑叶中的生物碱和黄酮类物质对α-葡萄糖苷酶具有一定的抑制能力,在高浓度条件下抑制效率达到50%左右 [16]。他们在另一篇文章中检测了桑叶粗多糖对α-葡萄糖苷酶活性的抑制作用,结果显示在高浓度(5~7 mg/mL)条件下,桑叶粗多糖可以抑制α-葡萄糖苷酶70%以上的活性,比本研究获得的结果要高,说明粗多糖中含有的蛋白质类和黄酮类物质具有较强的α-葡萄糖苷酶抑制作用 [8]。
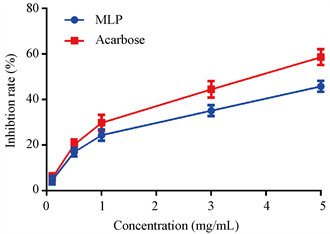
Figure 1. Inhibition rate of MLP to a-glucosidase, acarbose is control
图1. 桑叶多糖(MLP)对α-葡萄糖苷酶抑制率,阿卡波糖(acarbose)作为对照
α-淀粉酶可以水解食物中的淀粉类物质产生葡萄糖,之后被小肠吸收进入血液,提高血糖浓度。研究表明,抑制α-淀粉酶的活性也是抑制血糖升高和筛选降血糖药物的有效方法之一。由图2可知,阿卡波糖对α-淀粉酶有较强的抑制作用,而且呈现出剂量依赖关系。MLP对α-淀粉酶的抑制作用较弱,在高剂量(5 mg/mL)作用下,可以抑制α-淀粉酶大约40%的活性。寇秀颖等人研究了桑叶粗多糖和黄酮类物质对α-淀粉酶的抑制作用,结果表明多糖类物质对α-淀粉酶的活性抑制作用可以达到46%,这和我们的实验结果比较吻合 [17]。多种因素可以影响多糖对α-淀粉酶抑制活性,包括多糖自身的分子结构和空间构象,以及多糖中杂质的含量。尤玲玲等人报道了黄秋葵多糖对α-淀粉酶的抑制活性,研究结果表明相比于粗多糖,经过脱蛋白处理后的多糖其对α-淀粉酶的抑制活性显著降低 [18]。
3.3. MLP对胰脂肪酶抑制活性
MLP的降血脂活性主要通过对胰脂肪酶抑制以及胆酸盐结合来确定。胰脂肪酶抑制原理是脂肪酶水解油脂产生脂肪酸,游离脂肪酸再与NaOH结合,通过滴定来确定消耗NaOH的量间接确定脂肪酶的活性。多种活性多糖在脂肪酶水解甘油三酸酯反应中起抑制剂作用。由图3可知,MLP对胰脂肪酶具有较强的抑制作用,而且呈现剂量依赖关系,在浓度较高(5 mg/mL)的情况下,MLP可以抑制50%左右的胰脂肪酶活性。姚开等人研究了桑叶黄酮对于胰脂肪酶的抑制活性,结果显示桑叶黄酮物质对于胰脂肪酶具有非竞争性抑制作用 [19]。多种多糖对胰脂肪酶也具有显著的抑制作用,但是目前关于桑叶多糖对胰脂肪酶的抑制作用研究较少,本研究结果显示桑叶多糖具有一定的脂肪酶抑制活性,可以作为一种潜在的降血脂辅助药品或功能性食品。
3.4. MLP对胆酸盐的结合作用
胆酸盐是体内排泄胆固醇的主要途径,大部分胆酸盐经过肠道–肝脏进行回收。而通过结合胆酸盐可以有效排除体内胆汁酸含量,间接降低胆固醇含量,达到降低血脂的目标。牛磺胆酸钠和甘氨胆酸钠左右标准物质,在387 nm下测定其吸光值,制作标准曲线(图4)。得到牛黄胆酸钠含量的标准曲线为y = 0.123x + 0.0804,R2 = 0.9431。其中x为牛黄胆酸钠的含量,y为吸光值;甘氨胆酸钠的含量标准曲线为
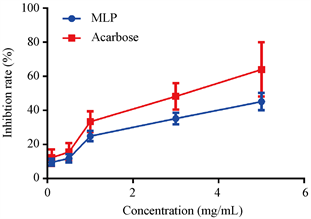
Figure 2. Inhibition rate of MLP to α-amylase, acarbose is control
图2. 桑叶多糖(MLP)对α-淀粉酶抑制率,阿卡波糖(acarbose)作为对照
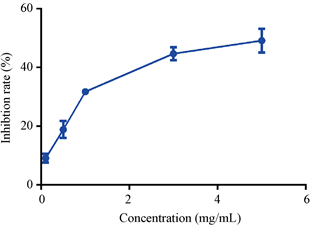
Figure 3. Inhibition rate of MLP tolipase
图3. 桑叶多糖(MLP)对脂肪酶抑制率
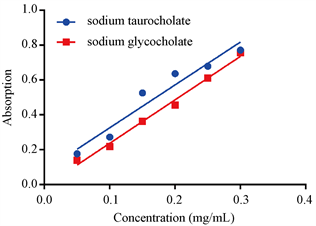
Figure 4. Standard curve of sodium taurocholate (ST) and sodium glycocholate (SG)
图4. 牛磺胆酸钠和甘氨胆酸钠标准曲线
y = 0.1231x − 0.0034,R2 = 0.9927。其中x为甘氨胆酸钠的含量,y为吸光值。
分别制备1.6 μM和2.0 μM的甘氨胆酸钠和牛磺胆酸钠溶液作为检测MLP对胆酸盐结合率的标准溶液。MLP对胆酸盐的结合作用如图5所示,结果显示MLP对牛磺胆酸钠具有较强的结合能力,优于对甘氨胆酸钠的结合作用。而且胆酸盐的结合率呈剂量依赖关系,在较高MLP浓度下,可以结合50%左右的胆酸盐。

Figure 5. Binding rate of MLP with sodium taurocholate (ST) and sodium glycocholate (SG)
图5. 桑叶多糖(MLP)与牛磺胆酸钠和甘氨胆酸钠的结合率
4. 结论
本研究通过水提法从桑叶中提取多糖,经过脱蛋白、脱色以及透析处理,获得精制桑叶多糖(MLP)。MLP对α-葡萄糖苷酶和α-淀粉酶具有剂量依赖的抑制作用,在高浓度条件下,抑制率可以达到40%,表现出较强的潜在降血糖活性。同时,MLP对胰脂肪酶具有较强的活性抑制能力,对胆酸盐也具有较强的结合作用,表现出较强的潜在降血脂活性。本研究结果表明,MLP可以作为一种重要的降血糖和降血脂活性多糖,应用于医药和食品领域,但是对于其具体的降血糖和降血脂机理,需要进一步的研究。
基金项目
国家自然科学基金青年项目(31700015);安徽省自然科学基金青年项目(1808085QC66);中央高校基础科研基金(JZ2018HGTB0244)。
NOTES
*通讯作者。