摘要:
目的:通过分析高原地区肝脏局灶病变超声造影的影像学特点,为临床提供更多的诊断价值。方法:剔除了有肝硬化背景的患者,对68例常规超声检出的局灶性病变进行超声造影,分析各病灶的增强模式,并进行相关文献复习。结果:经超声造影、肿瘤标志物检测、血清学检测、CECT/CEMRI扫描及手术病理联合确诊,肝泡型包虫病23例,肝血管瘤21例,局灶性坏死结节3例,局灶性脂肪浸润13例,FNH (局灶性结节性增生) 2例,血管平滑肌脂肪瘤1例,HCC (肝细胞肝癌) 3例,ICC (胆管细胞性肝癌) 2例。结论:超声造影可以即时、实时连续观察病灶的增强模式,对肝脏绝大多数局灶性病变特别是高原地区泡型包虫病等特发病能做出明确的诊断与鉴别诊断,为临床提供更多有用的信息。
Abstract:
Aim: To analyze the CEUS imaging features of hepatic focal lesions in the plateau area, and try to provide more evidence for clinical diagnosis. Method: 68 cases of focal lesions were included and detected by CEUS except for other patients with liver cirrhosis, the enhancement patterns of the lesions were analyzed and the related literatures were reviewed. Results: Totally 68 lesions with final pathologic results after surgery, all these patients had received CEUS, CECT or CEMRI, tumor markers and serological tests. There were 23 hepatic alveolar echinococcosis, 21 hepatic hemangioma, 13 focal fatty infiltration, 3 HCC, 2 ICC, 2 FNH and 1 angioleiomyolipoma. Conclusion: CEUS can provide instant, real-time continuous observation of the lesion enhancement patterns, which can help us to do right diagnosis of most liver focal lesions especially some special disease in hydatid areas such as hepatic alveolar echinococcosis, and provide more information in clinical practice.
1. 引言
随着人民健康意识的增强和体检的普及,超声检查发现的无症状肝脏局灶性病变越来越多。对小的局灶性稍强回声病变,以往的超声诊断多提示为肝脏血管瘤,对较大的局灶性病变,往往不能明确诊断,易导致误诊,延误治疗。微泡超声造影剂在临床的运用克服了二维超声和“多普勒”技术在肝脏局灶性病变诊断中的局限性,可以显示实质组织的微血管结构 [1],进行病变增强模式的实时评估,观察病变与周围组织的血流发布变化,提高肝脏局灶性病变的早期诊断水平。
2. 材料与方法
2.1. 临床资料
从我科开展超声造影新技术以来,选取纳入2018年2月至2019年7月在阿坝藏族羌族自治州人民医院超声科检出的肝脏局灶性病变共68例进行回顾性分析,排除了肝硬化背景患者。男37例,女31例,平均年龄35岁。其中体检发现19例,门诊患者23例,住院患者26例。所有患者均经临床表现、肿瘤标志物检测、血清学检测、CECT/CEMRI扫描及手术病理联合确诊。本组研究剔除了有肝硬化背景的患者。
2.2. 仪器与方法
使用西门子ACUSON S2000和百盛Saote Mylab彩色多普勒超声诊断仪,探头频率为1~8 MHz。
患者仰卧位或左侧卧位,首先进行常规二维和彩色多普勒超声扫描。观察病变的边界、形态、内部回声、血流信号,测量其大小并存图。确认目标病灶后,探头静置,超声仪切换到低机械指数对比增强模式。两幅灰度图像和对比图像显示机械指数低,肘静脉推注2.4 ml SonoVue,随后立即快速推注5 ml生理盐水,即时录像,同时动态观察病变部位在动脉期、门脉期和延迟期的强化模式。观察3分钟及以上。
3. 结果
68例局灶性病变中,肝血管瘤21例,超声造影模式绝大部分表现为动脉期周边“环状”增强,逐渐呈“结节状”或“棉絮样”向病灶中央不断填充,门脉期部分或完全向心性填充,延迟期持续呈高增强或等增强,体积较大者中央三期均可见较大范围无增强区。局灶性坏死结节3例,超声造影模式表现为三期均无增强。局灶性脂肪浸润13例,超声造影模式表现为与周围肝实质各时相等增强。FNH (局灶性结节性增生) 2例,超声造影模式为各时相呈均匀性高增强,动脉期伴有从中心向外的快速填充(图1),并可见轮辐状供血动脉,中央可见无增强疤痕区。血管平滑肌脂肪瘤1例,超声造影动脉期呈高增强,门脉期稍高至等增强,延迟期稍低增强。HCC (肝细胞肝癌) 3例,超声造影呈“快进快出”典型模式。ICC (胆管细胞性肝癌) 2例,动脉期呈环状样高增强,中央低增强,门脉期及延迟期明显廓清呈低增强。泡型包虫病23例,多数病灶内部无血流存在,表现为无增强模式,少数病灶内部靠边缘处散在少许星点状、短线状血流信号。
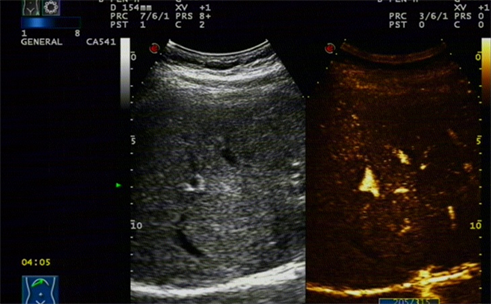 动脉期从中心向外快速填充,并可见轮辐状供血动脉 Lesion showed spoke-like pattern centrifugal enhancement in arterial phase.
动脉期从中心向外快速填充,并可见轮辐状供血动脉 Lesion showed spoke-like pattern centrifugal enhancement in arterial phase.
Figure 1. Contrast-enhanced image of FNH
图1. FNH超声造影图像
4. 讨论
目前用于临床超声诊断肝脏的超声造影剂是微泡造影剂。它由微气泡和起稳定作用的外包外壳组成 [1]。本组病例均使用在中国获得批准并上市的SonoVue微泡造影剂。
21例肝血管瘤中。本组病例有17例中心见较大范围无增强区,出现几率较高,究其原因,一是与血管瘤病理有关,二可能与高原地区缺氧更易引起血栓有关,尚待进一步研究。其中一例因三期均无增强被误诊为肝泡型包虫病多发,上级医院诊断为肝血管瘤,调阅回放该病例造影录像进行分析,动脉期病灶周围出现的薄层状环状强化,当时考虑为泡型包虫病周围肝实质的炎性反应,如果能观察更长延迟期血流状况,可能会发现“小结节状”或“棉絮样”向内填充的典型肝血管瘤血供,减少误诊。对比增强超声检查可以显着提高肝血管瘤诊断的准确性,约95%的病例可以明确诊断 [2]。
3例局灶性坏死结节,常规超声表现为无包膜、边界较清晰的不规则局灶性低回声病变。目前病因尚不明确,据报道 [3] [4],可能与血管疾病、创伤、感染和免疫反应有关。该组3个病例,有两个是肺结核患者,抗结核治疗3月后常规超声随访,病灶变小。另一个病例体检发现,加做了CECT检查予以证实。病理特征为结节性凝固性坏死,在病灶周围观察到完整的纤维包膜,病变部位没有血管组织 [5]。与文献报道及病理特点一致。
13例局灶性脂肪浸润,常规超声与小的强回声型肝血管瘤图像区别不大,均表现为局灶性稍强回声,多普勒无特殊。超声造影模式表现为与周围肝实质各时相等增强,很容易进行鉴别诊断。
彩超体检发现两例FNH (局灶性结节性增生),二维呈稍低结节样回声,边界清晰。一例病灶中央可见点状强回声,多普勒可探及穿行血流信号,后方回声轻微衰减。超声造影模式表现为动脉期伴有从中心向外的快速填充(图1),并可见轮辐状供血动脉,中央可见无增强疤痕区。其中一个病例位于第二肝门附近,挤压中肝静脉及右肝静脉,使其内径变窄约0.3 cm,局部血流加速,PSV 2.0 m/s左右。常规超声考虑为泡型包虫病浸润钙化型,部分血管未被破坏。超声造影推翻了常规超声的诊断。
肝血管平滑肌脂肪瘤是一种罕见的良性间充质肿瘤。这种类型的病变的成分是不同比例的血管,脂肪和平滑肌。常规超声可以显示不同类型的回声。此例患者为一青年男性,二维超声表现为稍强回声结节,周边可见薄声晕环绕,与肝泡型包虫病及肝癌声像图有重叠之处,对比增强表现为动脉期高增强,门脉期略高增强,延迟期呈稍低增强,与王健和张万广的报道一致 [6]。该病例做了CEMRI,CEMRI可以通过脂肪抑制技术有效识别脂肪组织。可获得更高的敏感性 [7] [8]。
3例肝细胞性肝癌背景肝回声均匀,病灶的微血管构成和血流灌注特点 [9] 决定了其造影模式表现为动脉期高增强,门脉期和延迟期表现为低增强。超声造影技术能实时连续动态观察肝脏肿瘤组织不同时相中表现出的特征性和特异性的血管模式,显著提高病变内部新生血管的检出,使肝癌的检出率大大提高 [10]。
胆管细胞性肝癌2例,动脉期呈环状样高增强,中央低增强,门脉期及延迟期明显廓清呈低增强,这与CECT/CEMRI延迟期高增强正好相反。与CT造影剂不同,超声造影剂是真正的血池显像剂,不会扩散到细胞间隙。这就是为什么超声造影不同于CT增强的原因 [11]。超声造影能更好的显示恶性肿瘤的增强模式 [12]。有报道称早期廓清(^60秒)常见为周围型胆管细胞性肝癌 [13] (图2),肝细胞肝癌的廓清一般较晚,通常发生在注射造影剂60秒后。
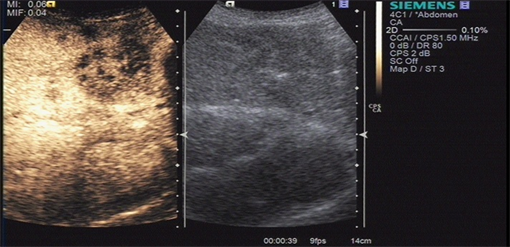 胆管细胞性肝癌门脉期(39秒)造影剂消退 The contrast agent washed out in ICC During portal venous phases (39 s).
胆管细胞性肝癌门脉期(39秒)造影剂消退 The contrast agent washed out in ICC During portal venous phases (39 s).
Figure 2. Image of ICC contrast-enhanced ultrasound
图2. ICC超声造影图像
肝泡型包虫病早期如同肿瘤样呈浸润性、外生性生长 [14],常规超声大部分表现为肝内稍强回声病灶,周边有厚薄不均声晕,个别病灶内部可见散在斑点状稍强回声,后方回声无明显改变,二维图像与肝细胞癌和胆管细胞肝癌鉴别困难,有一例病灶仅仅表现为局灶性肝实质回声偏强、粗糙。随着病情进展,肝包虫病内部会出现液化坏死。我们对23例进行了超声造影的泡型包虫病进行了分析汇总,其中14例表现为各时相内部及周边均无增强。5例病灶内部靠边缘处可见星点状、短线状等增强血流信号,内部各时相无增强。1例表现为造影后实性部分动脉期呈慢进低增强(图3),门脉期和延迟期持续低增强,内部坏死液化灶始终无增强,周围淋巴结转移灶增强模式与肝内病灶一致,该例被上级医院误诊为肝细胞性肝癌,经我院手术后康复出院。有3例位于第二肝门区附近的病灶,超声造影后可以清晰观察到肝静脉在病灶中穿行,其内径明显变窄,有利于早期诊断疾病导致的布加氏综合征。个别病灶周边的薄声晕动脉期呈不规则高增强(图4),分析认为,与病变生长过程中,病变周围的增生和肉芽肿、纤维组织的增生、嗜酸性粒细胞的浸润、淋巴细胞和浆细胞的浸润以及新生血管的形成有关,超声造影表现为稍高强化 [15]。在马淑梅等人的研究中有类似报道 [16]。
 肝泡型包虫病实性部分呈慢进低增强,液化坏死区无增强 The alveolar echinococcosis showed slow-in and hypo-enhancement in solid part of hepatic, while no enhancement in necrotic area.
肝泡型包虫病实性部分呈慢进低增强,液化坏死区无增强 The alveolar echinococcosis showed slow-in and hypo-enhancement in solid part of hepatic, while no enhancement in necrotic area.
Figure 3. Contrast-enhanced ultrasound image of echinococcosis
图3. 肝泡型包虫病超声造影图像
 肝泡型包虫病动脉期周边薄声晕呈环状高增强,内部无增强 In the arterial phase, Peripheral thin halo of hepatic alveolar showed circular hyper-enhancement, but no enhancement in the inside.
肝泡型包虫病动脉期周边薄声晕呈环状高增强,内部无增强 In the arterial phase, Peripheral thin halo of hepatic alveolar showed circular hyper-enhancement, but no enhancement in the inside.
Figure 4. Contrast-enhanced ultrasound image of hepatic alveolar echinococcosis
图4. 肝泡型包虫病超声造影图像
5. 结论
目前,超声造影在肝脏占位性病变中的应用已经比较成熟,对良恶性肿瘤的诊断和鉴别诊断具有重要价值 [17]。肝脏由于肝动脉和门静脉的双重血供,导致超声造影检查中出现相互重叠的三个血管期。动脉期显示肝动脉供血的范围和方式,门脉期通常会持续到注射造影剂后2分钟,延迟时间持续到造影剂从循环系统中移除,一般不超过4~6分钟。延迟增强为病变提供了重要信息,因为这一时期的大多数恶性病变为低增强,而大多数良性病变为等增强或高增强 [18]。目前,临床使用的超声造影剂是安全的,不良反应率很低。只停留与血管内,无心、肝或肾毒性,可以在通过常规超声发现的结节上立即进行超声成像,作定性诊断。