1. 引言
植物病害是制约农业生产的主要因素之一,主要阻碍农作物生长发育,降低产量和质量,给农户造成巨大经济损失。农业生产上,化学农药是防治植物病害的首选方式,但其长期的不合理使用导致负面问题层出不穷,如病原菌抗药性增强、环境污染严重、破坏生物多样性以及高毒高残留等 [1] [2] [3] [4] 。随着人们环保意识以及农产品安全意识的不断增强,生物防治受到了国内外植物保护工作者的重视。在植物病害生物防治中生防菌是一类重要的防治资源,其在多种微生物源植物病害防治中起到重要的作用。
细菌、真菌和放线菌均可作为生防菌应用于植物病害的生物防治中 [5] - [10] 。但细菌具有的存在广泛、群体庞大、繁殖迅速、代谢活动复杂、对病原菌作用方式多样等特点,使其成为生防菌开发的热点。目前研究者已从不同来源分离并鉴定出多种具有抗植物病原菌活性的生防细菌,主要包括芽孢杆菌属(Bacillus)、土壤杆菌属(Agrobacterium)、假单胞菌属(Pseudomonas)、沙雷氏菌属(Serratiabizio)、伯克氏菌属(Burkholderia)和类芽孢杆菌属(Paenibacillus)等,其中以芽孢杆菌属(Bacillus)和假单胞菌属(Pseudomonas)的生防细菌研究应用最多 [11] [12] [13] [14] 。
生防细菌可来源自自然保护区原始土壤、极端环境、植物病害的根际土壤以及健康植物组织内部(内生细菌)等多个区域 [15] 。内生细菌在植物体内定殖、传导,可系统地分布于植物细胞间隙或细胞内;与寄主植物具有良好的亲合能力,有足够的营养物质,并受到植物组织的保护,可避免外部恶劣环境的影响。这些特性使内生细菌成为植物病害生物防治上一类极具应用潜能的资源细菌。
桑树是我国最早栽培的经济林木,除了饲养家蚕外还具有重要的药用、食用、观赏和环保价值。然而包括桑疫病和桑青枯病在内的多种桑树细菌性病害造成的损失逐年增加,已成为阻碍桑资源利用的主要障碍之一 [16] 。目前桑树病害的防治除选育抗性品种外,主要依赖化学农药,其带来的环境污染和农药残留对养蚕业的负面影响已经逐渐凸显,寻求“绿色防控”已成为必然。
本研究以从健康桑树叶片中分离出的内生细菌为材料,以桑疫病和桑青枯病病原菌为指示菌,从微生物的培养、形态及生理生化指标、分子生物学鉴定和抑菌性入手,探讨桑叶内生细菌对桑细菌性病原菌的抗菌作用。利用桑树内生细菌控制桑树病害,为新型微生物农药的开发提供一定的理论依据,既可减轻化学农药造成的环境污染,又有利于家蚕的健康饲养。
2. 材料与方法
2.1. 实验材料
2.1.1. 供试桑树病原菌
桑青枯病病原菌青枯菌5号小种(Ralstonia solanacearum race 5)和桑疫病病原菌丁香假单胞杆菌桑致病变种(Pseudomonas syringae pv. Mori),均由中国农业科学院蚕业研究所桑病研究室提供。
2.1.2. 供试样品桑叶
采自中国农业科学院蚕业研究所国家种质镇江桑树圃的桑树(Morus alba L.)上(品种:9703、湖桑2号和野生桑)。样品采集后用自封袋密封马上回实验室进行内生细菌分离。
2.1.3. 培养基
KB培养基,PDA培养基,GYP培养基,NB培养基。休和利夫森二氏培养基(蛋白胨2.0 g,NaCl 5.0 g,KH2PO4 0.2 g,葡萄糖10.0 g,琼脂6.0 g,溴百里酚蓝1.0%水溶液3 mL,蒸馏水1000 mL,pH 7.0~7.2),甲基红试验培养基(蛋白胨5.0 g,葡萄糖5.0 g,K2HPO4 5.0 g,蒸馏水1000 mL,pH 7.0~7.2),亚硝酸盐还原试验培养基(牛肉膏10.0 g,蛋白胨5.0 g,亚硝酸钠1.0 g,蒸馏水1000 mL,pH 7.3~7.4),明胶培养基(蛋白胨5.0 g,明胶100.0~150.0 g,蒸馏水1000 mL,pH 7.2~7.4),产有机酸培养基(葡萄糖6.0 g,酵母浸膏1.0 g,蛋白胨1.0 g,MgSO4·7H2O 0.2 g,CaCO3 1.0 g,溴甲酚紫微量,琼脂15.0 g,蒸馏水1000 mL,pH值7.2~7.4)。
2.2. 桑叶内生细菌的分离和纯化
将采摘的桑树、湖桑和野生桑三个品种健康成熟桑叶,用蒸馏水洗净,晾干。将桑叶剪成大约5 cm × 2 cm的叶段,1.5%次氯酸钠和75%乙醇依次表面消毒5 min,取出后无菌水冲洗干净。待水分自然晾干,叶段剪成1 cm2左右的小块,贴附在PDA培养基平板上,28℃恒温条件下培养3~7天。将从叶片切口边缘处长出的内生细菌逐个接至新的PDA培养基平板上,多次划线分离纯化。根据菌落大小、形态、颜色等进行初步筛选,纯化后菌株编号冷藏保存。将最后一次清洗的无菌水涂板于PDA培养基,培养后无菌生长,确保分离菌株为内生菌。
2.3. 桑树病原菌的拮抗菌株筛选
将桑树病原菌和内生细菌分别在KB和PDA培养基上活化12 h。无菌水冲洗病原菌平板,获得菌悬液,取50 μL菌悬液涂布于KB培养基中。将内生细菌点接在涂布好的病原菌平板上,37℃倒置培养24 h观察实验结果,并计算相对抑菌圈直径 [17] 。相对抑菌圈直径 = 抑菌圈直径 − 测试菌直径。
2.4. 内生拮抗菌的鉴定
2.4.1. 内生拮抗菌的形态和生理生化特征
参照《微生物实验》 [18] 对筛选的内生拮抗菌在PDA培养基上培养(37℃,24 h),记录菌落的形态、颜色、透明度等,光学显微镜下观察菌细胞革兰氏染色和芽孢染色反应。经固定、脱水、干燥、镀金后GeminiSEM 300场发射扫描电子显微镜观察菌细胞形态。参照《常见细菌系统鉴定手册》 [19] 对筛选的内生拮抗菌进行生理生化反应测定。
2.4.2. 内生拮抗菌16S rRNA分子生物学鉴定
将目的菌株接种在NB培养基振荡培养24 h,采用上海生工(Sangon Biotech)离心柱型细菌基因组DNA提取试剂盒提取基因组DNA。以提取的细菌基因组DNA为模板,使用通用引物 [20] (上游引物:5’-AGAGTTTGATCCTGGCTCAG-3’;下游引物:5’-GGTTACCTTGTTACGACTT-3’。)扩增细菌16S rRNA基因。50 μL的反应体系:DNA模板4 μL,10 μM引物各2 μL,Premix Taq 25 μL,ddH2O 17 μL。PCR反应条件:95℃预变性4 min,94℃变性30 s,50℃退火45 s,72℃延伸1 min,30个循环后,72℃延伸10 min。取5.0 μL PCR产物于1.0%琼脂糖凝胶电泳检测扩增效果。PCR扩增产物委托浙江尚雅生物技术有限公司进行测序。所得的16S rRNA基因序列在NCBI数据库中进行比对,下载同源性较高序列,利用MEGA (version 6.06)软件,使用N-J法进行1000次步长计算 [20] ,构建系统发育树。
2.5. 内生拮抗菌抑制桑树病原菌活性产物初步分析
2.5.1. 拮抗菌的特性分析
拮抗菌可通过产生纤维素酶、蛋白酶、有机酸等一系列物质来破坏菌细胞结构,从而达到抑菌的效果。
产有机酸分析:将拮抗菌点接在产有机酸培养基平板上,37℃静止培养4 d,观察是否有黄色的降解圈。
产纤维素酶分析:将拮抗菌点接在含有0.5%羧甲基纤维素的1000 mL的GYP培养基平板上,37℃静止培养4 d。培养皿中加入0.2%刚果红染液浸没菌落,40 min后倒掉染色液,再加入1 mol/L NaCl脱色15 min,观察是否有黄色降解圈 [21] 。
产蛋白酶分析:将拮抗菌点接在培养基平板上,37℃静止培养3 d。培养皿中加入饱和硫酸铵溶液浸没菌落,30 min后倒掉溶液,观察是否有透明圈。培养基:1000 mL的GYP培养基(pH 6.0)中加入8%的50 mL的明胶溶液 [21] 。
2.5.2. 拮抗菌抑制桑树病原菌产物分析
1) 拮抗菌产物的分段有机萃取和抑菌分析
将拮抗菌接种于PDA液体培养基中,37℃、120 r/min振荡培养48 h。5000 r/min常温离心15 min,收集发酵液。发酵液依次用石油醚、二氯甲烷、乙酸乙酯、正丁醇四种有机溶剂分段萃取,收集有机相。将所得的各有机相和水相经旋转蒸发仪50℃下减压浓缩至干。固体提取物用二甲亚砜溶解成一定浓度,经0.22 μm微孔滤膜除菌后备用。采用滤纸片法分析各萃取段提取物对桑树病原菌的抑菌效果,最终确定活性物质所在萃取段。
2) 活性萃取段提取物定性检测
生物碱:向提取物溶液中加入饱和苦味酸溶液,有黄色沉淀,则有生物碱。
二萜:提取物溶液加水,再加入3~4滴0.2 mol/L醋酸铜溶液,若变绿色则存在二萜。
三萜:提取物溶液中加入几滴浓硫酸,摇匀后静置,若下层变黄则含有三萜。
黄酮:提取物溶液中加入几滴0.25 mol/L醋酸铅溶液,有黄色沉淀表明有黄酮的存在。
3. 结果与分析
3.1. 桑树叶片内生细菌的分离纯化
通过微生物传统分离纯化方法从三种健康桑树叶片中分离筛选出7株内生细菌,其中桑树品种9703分离出3株(分别命名为371、381和391);野生桑中分离出3株(分别命名为B1、B2和B3);湖桑2号中分离出1株(命名为CP1)。
3.2. 桑树病原菌的拮抗菌株筛选
以桑树病原菌为靶标菌,对分离到的7株内生细菌进行拮抗作用测定。结果表明7株内生细菌中有3株(381、391和B3)具有拮抗桑树病原菌的作用,而编号为381的抑菌效果最好(图1)。381对桑青枯病病原菌的抑制效果较强,相对抑菌圈直径达到8.51 ± 0.75 mm;对桑疫病病原菌的抑制效果相对较弱,相对抑菌圈直径为5.74 ± 0.26 mm。

Figure 1. Antimicrobial effects of strain 381 on two pathogens caused mulberry bacterial wilt (a) and mulberry bacterial blight (b)
图1. 内生拮抗菌381对桑青枯病(a)和桑疫病(b)病原菌的抑制效果
3.3. 筛选内生拮抗菌381的鉴定
3.3.1. 内生拮抗菌381的形态和生理生化特征
菌株381在PDA培养基上生长良好,37℃下培养20 h即可形成明显的菌落(图2)。单个菌落初期呈透明水滴状,后为乳白色粘质圆形,表面湿润光滑,中心凸起,边缘整齐,菌细胞不易挑取。10 × 100倍光学显微镜下,菌体杆状,革兰氏染色呈可变性,未发现芽孢(图3)。扫描电子显微镜下菌细胞表面布满褶皱,呈杆状,两端呈圆弧形,未观察到明显的鞭毛和芽孢,大小约0.8~2.3 × 0.2~0.3 μm (图4)。
生理生化特性鉴定结果表明(表1),菌株381能利用蔗糖、甘露醇、麦芽糖、鼠李糖和乳糖等作为碳源和能源。甲基红实验结果呈阴性,结合糖发酵实验可推断,菌株381可将糖发酵产的有机酸转化为非酸性末端产物。V-P试验为阳性,亚硝酸还原反应为阴性。初步鉴定菌株381为一种芽孢杆菌。
3.3.2. 内生拮抗菌381的系统进化分析
以菌株381的基因组DNA为模板,用细菌16S rRNA通用引物进行PCR扩增,得到单一条带,产物大小约为1500 bp,条带清晰。PCR扩增产物经浙江尚雅生物有限公司序列测定,测得菌株381的16S rRNA基因序列总长为1431 bp。序列上传至NCBI基因序列分析网站进行同源性分析,并选取与其相近

Figure 2. The colony morphology of strain 381
图2. 内生拮抗菌381的菌落形态
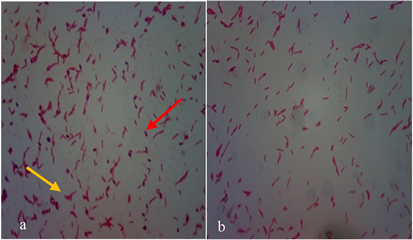
Figure 3. Gram staining (a) and spore staining (b) of strain 381. (Red arrow: Gram positive; Yellow arrow: Gram negative; Magnification: 10 × 100)
图3. 内生拮抗菌381的革兰氏染色(a)和芽孢染色(b)。(红色箭头:革兰氏阳性;黄色箭头:革兰氏阴性;放大倍数:10 × 100)

Figure 4. Scanning electron microscope photograph of strain 381
图4. 内生拮抗菌381的扫描电子显微镜照片(×10,000)

Table 1. Main physiological and biochemical characteristics of strain 381
表1. 内生拮抗菌381的主要生理生化特征
注:“+”为阳性反应,“−”为阴性反应;Note: “+”,positive; “−”,negative.
序列的菌株,采用N-J法构建系统发育树。根据菌株381在NCBI数据库上BLAST结果,它与类芽孢杆菌属Paenibacillus具有较高的同源性。由图5可以看出,菌株381与登录号为NR 117729.2的Paenibacillus polymyxa strain DSM 36菌株位于同一个最小的分支,且同源性为99.65%,亲缘关系最近。
根据菌株381的16S rRNA同源性分析结果,并结合其形态和生理生化特征,可鉴定菌株381为多粘类芽孢杆菌(Paenibacillus polymyxa)。

Figure 5. Phylogenetic tree of strain 381 based on 16S rRNA gene sequence
图5. 依据内生拮抗菌381的16S rRNA基因序列构建的系统发育树
3.4. 内生拮抗菌381抑制桑树病原菌产物初步分析
3.4.1. 内生拮抗菌381的特性分析
菌株381可产生有机酸、蛋白酶和纤维素酶等物质,直接或间接抑制细菌和真菌(菌株381对多种真菌性病原菌也有很好的抑制效果,另文叙述)生长(图6)。

Figure 6. Identification of organic acid (a), protease (b) and cellulase (c) produced by strain 381
图6. 内生拮抗菌381产有机酸(a),蛋白酶(b)和纤维素酶(c)分析
3.4.2. 内生拮抗菌381抑制桑树病原菌产物分析
1) 内生拮抗菌381不同有机萃取段产物的抑菌效果
菌株381发酵液依次经石油醚、二氯甲烷、乙酸乙酯、正丁醇四种有机溶剂分段萃取,旋转蒸发后得到各个萃取段的产物粗提物。40 mg/mL粗提物抑菌活性测定结果显示(表2),乙酸乙酯相粗提物与水相粗提物对桑树病原菌显示出抑菌活性,可以初步确定菌株381产生抑菌作用的物质存在于乙酸乙酯相和水相中。

Table 2. Antimicrobial effects of crude extracts in each organic extraction on pathogens
表2. 各有机萃取段粗提物对病原菌的抑菌效果
注:“+”有抑菌效果,“−”无抑菌效果。Note: “+”,antibacterial activity; “−”,no antibacterial activity.
为进一步验证实验结果,再次测定浓缩干燥得到的乙酸乙酯相和水相菌株381产物粗提物的抑菌活性。乙酸乙酯相粗提物在浓度为40 mg/mL时对桑青枯病和桑疫病病原菌的抑菌圈直径分别为3.27 ± 0.51 mm和2.54 ± 0.29 mm;水相粗提物在同浓度时对桑青枯病和桑疫病病原菌的抑菌圈直径分别为5.02 ± 0.40 mm和3.47 ± 0.51 mm (图7)。
2) 乙酸乙酯相和水相抑菌物质定性检测
乙酸乙酯相和水相抑菌物质初步定性检测结果表明乙酸乙酯相中起抑菌作用的物质可能为生物碱、黄酮或二萜类物质(表3和图8(a));水相中起到抑菌作用的物质可能为三萜类物质(表3和图8(b))。具体的物质种类和结构需要后续实验进一步明确。
4. 讨论
多粘类芽孢杆菌(Paenibacillus polymyxa)原为多粘芽孢杆菌(Bacillus polymyxa),是类芽孢杆菌属的模式种,也是一种相对较新的实验菌 [22] 。多粘类芽孢杆菌可通过产生抗生素、酶类、黄酮类等多种活性物质直接抑制微生物病原菌生长繁殖;也可产生植物激素、铁载体等促进植物生长,引起植物体一系列的

Figure 7. Antimicrobial effects of crude extracts in ethyl acetate phase and aqueous phase of 381 strain on pathogens. (a) and (b): Antimicrobial effects of crude extracts in ethyl acetate phase on pathogens of mulberry bacterial wilt and mulberry bacterial blight, respectively; (c) and (d): Antimicrobial effects of crude extracts in aqueous phase on pathogens of mulberry bacterial wilt and mulberry bacterial blight, respectively
图7. 乙酸乙酯相和水相粗提物对桑树病原菌的抑菌效果。(a)和(b):乙酸乙酯相对桑青枯病和桑疫病病原菌;(c)和(d):水相对桑青枯病和桑疫病病原菌

Figure 8. Qualitative tests of bacteriostatic substances produced by strain 381 in ethyl acetate phase (a) and aqueous phase (b)
图8. 乙酸乙酯相(a)和水相(b)抑菌物质的定性检测

Table 3. Qualitative test results of bacteriostatic substances of strain 381
表3. 内生拮抗菌381抑菌物质定性检测结果
注:“+”表示含有该物质,“−”表示不含此物质。Note: “+”,substance; “−”,no substance.
生理生化变化,间接提高植物抗病性 [22] [23] [24] [25] [26] 。同时,由于其在植物体上的定殖能力和对环境的适应性极强,对人畜安全和无污染等优点,已被广泛应用于植物病害生物防治。美国环保署(EPA)将其列为可在商业上应用的微生物之一 [22] ,也被我国农业部列为免做安全鉴定的一级菌种。但是多粘类芽孢杆菌作为桑树内生菌用于桑树微生物病害的生物防治的相关研究未见报道。
本研究从三个品种健康桑树叶片中分离获得一株对桑青枯病和桑疫病病原菌具有明显拮抗作用的内生细菌381菌株。结合381菌株形态特征、生理生化特征以及基于16S rRNA的系统发育分析结果,将381菌株鉴定为多粘类芽孢杆菌。实验从三种健康桑树叶片中仅分离得到7种内生细菌,数量有限,这可能与样本来源地单一有关。以最后一次表面冲洗的无菌水作为阴性对照,从中未发现可培养的任何细菌,表明筛选的内生细菌并不是从空气、土壤或其他环境因素带入的污染微生物。菌株381除了对桑青枯病和桑疫病病原菌有一定的抑菌效果外,对辣椒疫病、核盘菌、串珠链胞菌等也有较好的抑制作用(另文叙述)。本研究取得的结果为利用多粘类芽孢杆菌进行桑树细菌源微生物病害的生物防治奠定了实验基础。
抗菌活性物质作为生防菌发挥生防作用的物质基础,其结构、性质、结构与功能的关系、产量等都影响着菌株的实际应用效果。菌株381产生的活性抑菌物质存在于发酵液中,可用乙酸乙酯有效萃取,但仍有部分数量或者种类存在于水相中。初步定性分析产生的物质可能是生物碱、黄酮、二萜或三萜。同时平板定性分析显示381菌株可产生有机酸、纤维素酶和蛋白酶。生物碱、黄酮、二萜和三萜对微生物均有一定的抑制作用 [27] [28] [29] [30] 。有机酸是一类具有酸性的有机化合物,可通过能量竞争、透化细菌外膜、提高胞内渗透压、抑制生物大分子合成、诱导宿主产生抗菌肽等多个方面抑制细菌的生长 [31] 。蛋白酶可水解蛋白质肽链,从而破坏细胞膜结构。纤维素酶可有效降解纤维素,达到破坏细胞壁目的。这些结果表明菌株381产生的抑菌活性物质具有多样性,彼此间协同作用对多种病原菌起着抑制作用。
本实验仅在实验室中获得对桑树病原菌具有拮抗作用的内生菌株,并对其抑菌活性物质初步鉴定。381菌株对病原菌的抑制机制、在桑树内的定殖繁殖规律、大田中对桑树病害的防控效果及防控机制、与其他生物间的作用关系、活性物质的种类等尚需进一步实验明确。
NOTES
*通讯作者。