1. 引言
聚合物电致发光材料因其具有良好的光化学性能、电化学性能和物理性能 [1] [2] ,而广泛的应用于有机电致发光器件,有机太阳能电池等 [3] [4] [5] [6] 。其中,以对苯撑乙炔具有良好的电子流动性,芴是一种典型的高性能电致发光聚合而设计合成的电子给体,咔唑作为电子给体单元的聚合物相比于芴具有更高载流子传输能力,同时还保持芴类聚合物的带隙和能级位置,因此这三类给体受到许多科学研究工作者的关注 [7] [8] 。噻吩及其衍生由于其电化学性质和电子结构特征受到了广泛的关注。特别是近几年来,噻吩单元的聚合物往往具有高的电荷载流子迁移率以噻吩作为电子给体在D-A系统的研究有大量的文献报道。嘧啶是一种典型缺电子含N芳杂环化合物,其共轭六元环结构中含有两个C=N,吸电子能力强,是一种常见的电子受体化合物。嘧啶单元的缺电子特性使得其常常作为电子受体单元与富电子单元进行组合,嘧啶单元的缺电子特性表明其具有较低的低未占轨道(LUMO)能级,在富电子单元进行组合时,由于电子可以分子的共轭系统中自由运动,从而使得整体的LUMO能级下降,与HOMO能级的差值减小即聚合物的能带隙宽度降低 [9] [10] 。因此,本文中首先合成了2,5-二溴-3-(5’-嘧啶基)噻吩单元的电子受体(Donor)单体(M1),然后分别与苯撑乙炔、芴和咔唑类电子给体(Acceptor)单体共聚制备了三种交替聚合物并对所得聚合物的光学性能和电化学性能进行测试。所得聚苯撑乙炔类(P1)、聚芴类(P2)和聚咔唑类(P3)三类聚合物溶液状态下发射荧光分别为绿色、蓝色、和黄绿色;在薄膜状态下发射荧光分别为橙色、绿色和黄色,并且其两种状态下的荧光强度较强,有望在聚合物电致发光器件方面应用,这将有一定的理论和实际意义。
2. 实验部分
2.1. 主要试剂与测试设备
5-溴嘧啶:98%百灵威科技有限公司;3-噻吩硼酸98%百灵威科技有限公司;N-溴代琥珀酰亚胺百灵威科技有限公司;2,5-二辛氧基-1,4-二乙炔基苯(M4)、2,7-二(4,4,5,5-四甲基硼烷基)-9,9-二辛基芴(M5)、3,6-二(4,4,5,5-四甲基-1,3-二氧-2-硼烷基)-N-正辛基咔唑(M6)、四(三苯基膦)钯Pd(PPh3)4根据文献 [11] 提供的方法合成;CuI:分析纯,天津市化学试剂研究所;醋酸钯[Pd(OAc)2]、三环己基膦、Aliquat336:分析纯,阿拉丁化学有限公司;三氟乙酸:分析纯,阿拉丁化学有限公司;甲苯、四氢呋喃(THF)和二氯甲烷(DCM):分析纯,使用前经除水、除氧精制处理;N,N-二甲基甲酰胺(DMF):分析纯;
1H-NMR核磁共振测试:采用美国Varian公司Inova-400 MHz型核磁共振波谱仪(内标为Me4Si,溶剂为CDCl3);红外光谱分析:采用KBr压片,使用德国BRUKER公司EQUINOX-55型红外光谱仪,扫描波数范围为
400 cm
−
1~
4000 cm
−
1;紫外-可见吸收光谱分析:日本岛津,UV-1800分光光度计;荧光发射光谱分析:珀金埃尔默仪器有限公司,Perkinelmer LS-55型荧光分光光度计;循环伏安分析:上海辰华公司CHI
660C
电化学工作站,0.1 mol/L Bu4NPF6的乙腈溶液作为电解质,铂片为工作电极,甘汞电极(SCE)为参比电极,铂电极为辅助电极,氮气保护,扫描范围为0~2.5 V,扫描速度为50 mV/s;X-射线粉末衍射(XRD):德国BRUKER公司,D8 advance型X-射线衍射仪,Cu-K为辐射源,波长为λ = 1.5406 Å,扫描角度为10˚ ≤ 2 ≤ 80˚;热重差热分析:NETZSCH STA
449C
综合热分析仪,升温速率为10℃/min,氮气保护;旋涂仪:CHEMAT TECHNOLOGY的KW
-4A
型号旋涂仪。聚合物分子量分析:美国Waters公司,Alliance GPCV-2000凝胶渗透色谱仪,以单分散聚苯乙烯作为标定,流动相为色谱纯THF。
2.1.1. 3-(5’-嘧啶基)-噻吩的合成
室温、磁力搅拌和N2保护条件下依次将12 g (94 mmol) 3-硼酸噻吩、10 g (63 mmol)5-溴嘧啶、13 g (94 mmol) K2CO3、150 mL四氢呋喃加入250 ml三口瓶中,加入1.8 g (1.5 mmol) Pd (PPh3)4,升高温度到80℃左右反应24 h。反应一段时间后薄层色谱点板跟踪记录反应程度,当薄色谱点板分析原料点消失后停止加热,待反应体系冷却到室温后将反应液倒入碎冰中,碎冰完全融化后将反应液转移到分液漏斗中用CH2Cl2萃取3次,萃取后得到的有机相用冰水清洗3次,然后将无水MgSO4加到有机相静置4 h,然后过滤掉无水MgSO4将有机相旋转蒸法浓缩后过硅胶柱分离得到灰紫色固体,产率97%。FT-IR (KBr, cm−1) 3103, 3068, 3036, 1611, 1561, 1523, 1425, 867, 804, 719, 698, 636. 1H NMR (400 MHz, DMSO): δ: 7.72 - 7.79 (m 2H), 8.19~8.23 (q 1H), 9.09~9.12 (s 1H), 9.19~9.22 (s 2H).HRMS: C8H6N2S for [M + H]+, calculated 163.03245, found 163.03198。
2.1.2. 2,5-二溴-3-(5’-嘧啶基)噻吩(M1)
磁力搅拌、冰浴条件下将8.1 g (50 mmol) 3-(5’-嘧啶基)-噻吩和100 ml N,N-二甲基甲酰胺加入150 ml双口瓶中,待原料全部溶解后加入19.5 g (110 mmol) N-溴代琥珀酰亚胺,保持避光条件在黑暗中反应24 h。反应过一段时间后薄层色谱点板跟踪记录反应进行程度,薄层色谱点板分析原料点消失后停止反应。然后将反应液倒入200 ml冰水中静置,当冰全部融化后将反应液转移到分液漏斗中用CH2Cl2萃取多次,然后向有机相中加入大量的冰块,待冰融化后用分液漏斗分出有机相,重复多次洗掉有机相中的N,N-二甲基甲酰胺,然后向有机相中加入无水MgSO4干燥4 h,过滤除掉无水MgSO4旋蒸浓缩有机相后过硅胶柱分离杂质得到淡黄色固9.98 g,产率63%。FT-IR (KBr, cm−1) 3098, 3069, 3044, 1553, 1433, 1326, 1187, 991, 848, 724, 627. 1H NMR (400 MHz, DMSO): δ: 7.6~7.62 (s 1H), 9.03~9.05 (s 2H), 9.22~9.24 (s 1H). HRMS: C8H4Br2N2S for [M +H]+, calculated 318.85347, 320.85142, found 318.85291, 320.85077 (见图1)。
2.2. 聚合物的合成
2.2.1. 聚[3-(5’-嘧啶基)噻吩-2,5-二(辛烷氧基)-1,4-二乙炔基苯] (P1)
100 mL聚合瓶中加入2,5-二溴-3-(5’-嘧啶基)噻吩(87.72 mg,0.275 mmol),单体M4 (115.92 mg, 0.275 mmol),然后加入40 mL已除水的四氢呋喃,磁力搅拌条件下用油泵抽真空5 min,然后向反应体系中通N2 ,在N2氛围条件下加入二三苯基膦二氯化钯(14.8 mg, 0.0211 mmol)、碘化亚铜(14.8 mg, 0.0779 mmol),然后室温下将4.5 mL蒸馏过的二异丙胺缓慢滴加到聚合瓶,然后遮光反应2 h后,在55℃左右保持在黑暗条件下反应24 h。反应结束后待反应体系冷却至室温后,将反应液倒入大量甲醇使聚合物析出,并保持在甲醇中搅拌12 h使使其析出完全同时的洗掉聚合物中的低聚物,过滤,将所得聚合物固体在丙酮(100 mL)里清洗搅拌12 h,过滤,真空干燥得到橙色聚合物(P1),产率:82%。FT-IR (KBr, cm−1) 3040, 2921, 2850, 2193, 1462, 1214, 1024, 1H-NMR (400 MHz, CDCl3, ppm): 9.3~9.22 (s, 2H), 9.21~9.17 (s, 1H), 7.41~7.38 (s, 1H), 7.05~6.94 (s, 2H), 4.08~3.96 (t, 4H), 1.88~1.78 (t, 4H), 1.6~1.2 (m, 20H), 0.9~0.83 (m, 6H) (见图1)。
2.2.2. 聚[3-(5’-嘧啶基)噻吩-9,9-二辛烷基芴] (P2)
100 mL的聚合瓶中加入2,5-二溴-3-(5’-嘧啶基)噻吩(116.75 mg, 0.366 mmol),单体M5 (230 mg, 0.366 mmol)和三环己基磷(6 mg, 0.021 mmol),然后加入10 mL已除水的甲苯、2 mol/L碳酸钾溶液2 ml、两滴三辛基甲基氯化铵,然后在磁力搅拌条件下真空5 min后通N2,在N2氛围条件下加入醋酸钯(3 mg, 0.0134 mmol)催化剂,室温黑暗条件下反应2 h后,升高温度到90℃~100℃继续反应3 d,反应到时间结束反应后冷却至室温,将反应液缓慢滴加到大量的甲醇中使聚合物沉淀析出,并保持搅拌12 h使其析出完全同时的洗掉聚合物中的低聚物,过滤后依次用蒸馏水和丙酮分别搅拌洗涤12 h,过滤,真空干燥后得到绿色聚合物(P2),产率:35%。FT-IR (KBr, cm−1) 3036, 2925, 2852, 1552, 1462, 1214, 1152, 817, 1H-NMR (400 MHz, CDCl3, ppm): 9.13~9.08 (s, 1H), 8.80~8.72 (s, 2H), 7.76~7.69 (m, 1H), 7.55~7.49 (m, 1H), 7.31~7.29 (s, 1H), 7.22~7.18 (d, 1H), 7.16~7.14 (d, 1H), 7.00~6.95 (s, 1H), 1.75~1.65 (t, 4H), 1.60 - 1.24 (m, 24H), 0.84~0.77 (m, 6H) (见图1)。
2.2.3. 聚[3-(5’-嘧啶基)噻吩-N-正辛基咔唑] (P3)
100 mL的聚合瓶中加入2,5-二溴-3-(5’-嘧啶基)噻吩(116.75 mg, 0.366 mmol),单体M6 (195 mg, 0.366 mmol)和6 mg三环己基磷,然后加入10 mL已除水的甲苯、2 mol/L碳酸钾溶液2 ml、两滴三辛基甲基氯化铵,然后在磁力搅拌条件下真空5 min后通N2,在N2氛围条件下加入醋酸钯(3 mg, 0.0134 mmol)催化剂,室温黑暗条件下反应2 h后,升高温度到90℃~100℃继续反应3 d,反应到时间结束反应后冷却至室温,将反应液缓慢滴加到大量的甲醇中使聚合物沉淀析出,并保持搅拌12 h使其析出完全同时的洗掉聚合物中的低聚物,过滤后依次用蒸馏水和丙酮分别搅拌洗涤12h,过滤,真空干燥后得到棕色聚合物(P2),真产率:62%。FT-IR (KBr, cm−1) 3034, 2920, 2849, 1599, 1474, 1225, 1039, 798, 1H-NMR (400 MHz, CDCl3, ppm): 9.15~8.85 (s, 2H), 8.80~8.70 (s, 1H), 8.50~8.32 (d, 2H), 7.80~7.72 (d, 2H), 7.55~7.52 (d, 1H), 7.35~7.31 (d, 1H), 7.22~7.18 (s, 1H), 4.40~4.23 (m, 2H), 2.0~1.75 (m, 2H), 1.6~1.2 (m, 10H), 0.9~0.8 m, 3H) (见图1)。
3. 结果分析与讨论
3.1. 红外光谱与核磁共振氢谱分析
图2为单体M1, M4~M6和聚合物P1~P3的红外光谱图。由图可见,M1在3044 cm−1的峰为噻吩环
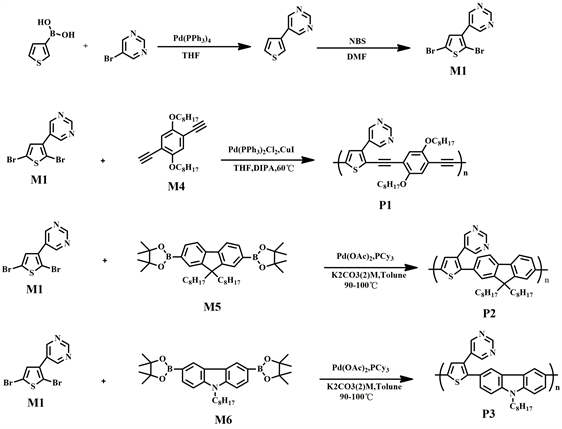
Figure 1. Synthesis routes of monomers and polymers
图1. 单体和聚合的合成路线

Figure 2. FT-IR spectra of monomers and polymers
图2. 单体和聚合物的红外光谱图
和嘧啶环上的-CH-峰,1692 cm−1, 1553 cm−1处的峰是C=C伸缩振动峰,1433 cm−1处是-C=N-的伸缩振动峰,991 cm−1处是C-Br伸缩振动峰。1635 cm−1, 1595 cm−1,处的吸收峰为咔唑环的吸收峰;B-O的吸收振动峰位于1144 cm−1;从P1、P2、P3的红外光谱图可知,M4上C≡C在2113处的特征峰在P1中红移至2193 cm−1,可能是由于P1中吸电子的嘧啶基团与给电子的苯撑乙炔相互作用,发生电子转移所引起的。M4中在3293 cm−1处的C≡C-H吸收峰在P1中消失;M5、M6中位于1144 cm−1的B-O的特征吸收峰在P2、P3红外图中消失;M1中位于991 cm−1的C-Br伸缩振动峰,在P1、P2、P3中消失。因此可以判断单体和聚合物合成正确。
图3为聚合物P1、P2和P3在氘代氯仿(CDCl3)中的1H-NMR谱。对P1谱图中分析可知化学位移在9.30~9.22 (broad s, 2H), 9.21~9.17 (broad s, 1H)对应于嘧啶环上芳香氢的峰;7.41~7.38 (broad s, 1H), 7.05~6.94 (broad s, 2H)处的核磁共振信号峰分别对应于噻吩环上、苯环上的芳香氢的信号峰;4.08~3.96 (broad t, 4H)处的信号峰为炔基上-OCH2-中氢的信号峰;在1.88~1.78 (broad t, 4H), 1.6~1.2 (broad m, 20H), 0.9~0.83 (broad m, 6H)处的信号峰为烷基链上的氢;对P2谱图中分析可以看出化学位移在9.14~9.09 (broad s, 1H), 8.78~8.72 (broad s, 2H)处的核磁共振信号峰对应于嘧啶环上的芳香氢的信号峰;7.31~7.30 (broad s, 1H)核磁共振信号峰对应于噻吩环上的芳香氢的信号峰在,1.75~1.65 (broad t,4H), 1.60~1.24 (broad m, 24H), 0.84~0.77 (broad m, 6H)处的核磁共振信号峰分别对应芴环上烷基链的氢;对P3谱图中分析可以看出化学位移在9.15~8.85 (broad s, 2H), 8.80~8.70 (broad s, 1H)处的核磁共振信号峰对应于嘧啶环上的芳香氢的信号峰, 7.22~7.14 (broad s, 1H)处的核磁共振信号峰对应于噻吩环上的芳香氢的信号峰;4.36~4.16 (broad m, 2H)处的信号峰为咔唑环上的-NCH2-上氢的信号峰;2.0~1.75 (broad m, 2H), 1.6~1.2 (broad m, 10H) 0.9~0.8 (broad m, 3H)处的核磁共振信号峰分别对应于聚合物烷基链的脂肪氢。综合红外光谱图和核磁共振氢谱图结果分子可以看出,目标聚合物已成功的合成。

Figure 3. 1H-NMR spectrum of polymers
图3. 聚合物的核磁共振氢谱图
3.2. 聚合物的紫外–可见和荧光光谱分析
图4、图5分别为聚合物P1、P2和P3在溶液状态下和薄膜状态的紫外-可见吸收光谱图,由其紫外吸收所得相关光谱数据见表1中。从图可知在溶液状态下,三种共轭聚合物P1、P2、P3主链π-π*跃迁产生相关的最大吸收峰 [11] 在440 nm、390 nm、355 nm出现,P1的π-π*跃迁的吸收峰的波长分别大于P2和P3的π-π*跃迁的吸收峰的波长50 nm和35 nm,是由于P1分子结构中对苯撑乙炔结构存在使得聚合物分子链上的共轭程度大于P2、P3,结果导致其π-π*跃迁的吸收峰的波长最大。从聚合物薄膜状态下的π-π*跃迁吸收峰分别在464 nm、400 nm和347 nm处出峰,且P3在347 nm处的峰特别弱,可能原因是由于P3中咔唑结构,其共轭程度低。从薄膜紫外-可见光谱中根据德布罗意方程计算出的聚合物的光学能隙分别为2.37 eV、2.66 eV和2.79 eV。聚合物P1和P2在薄膜状态下分子堆积作用更强使得π-π*跃迁产生的吸收峰相比于溶液状态下的吸收峰长分别红移了24 nm、10 nm,分子堆积作用越强红移的程度越高 [12] [13] [14] [15] 。三种聚合物在薄膜状态下在可见光范围内有较宽范围吸收,有应用光伏材料的价值。

Figure 4. UV-vis spectra of polymers in CHCl3
图4. 聚合物溶液状态下的的紫外–可见光谱图
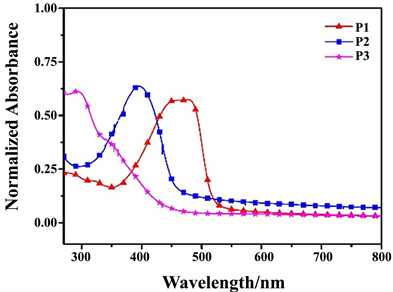
Figure 5. UV-vis spectra of polymers in film
图5. 聚合物薄膜状态下的紫外–可见光谱图
图6、图7分别为聚合物P1、P2和P3在溶液状态下和薄膜状态的荧光光谱图,通过观察聚合物溶液在紫外灯下发光颜色和用荧光光谱仪对聚合物P1、P2和P3溶液状态下发光情况进行测试,三种聚合物的荧光发射峰分别出现在500 nm、466 nm、532 nm,P1溶液显示出显示出绿色;P2溶液显示出蓝色;P3溶液显示出黄绿色荧光。P3因其聚合物结构中非辐射能大于P1、P2,所以P3荧光发射峰的波长高于P1、P2。从聚合物薄膜状态的荧光发射图可以看出,P1、P2、P3的发射峰分别位于576 nm、507 nm、533 nm,分别显示橙色、绿色和黄色荧光,P1的荧光发射峰的波长分别大于P2和P3荧光发射峰的波长69 nm和43 nm,原因是P1的非辐射能大于P2和P3。相比于溶液状态下,薄膜状态下由于聚合物链之间的堆积缠绕作用引起非辐射能增强 [16] P1、P2的发生光谱发生明显红移,分别红移76 nm、43 nm,P3红移不明显,可能原因是因为在此状态下由于聚合物分子结构使得聚合物链的堆积现不明显 [16] ,聚合物非辐射能量变化不大。聚合物P1和P3在CHCl3溶液中的相对荧光量子效率以硫酸奎宁(0.1 M H2SO4溶液)作为参比,根据Davey等人提供的方法 [17] [18] 进行测试。聚合物的相对荧光量子效率分别为52.3%和4.5%。聚合物P2在CHCl3溶液中的相对荧光量子效率以9,10-二苯蒽为参比荧光标准物(环己烷),测得其荧光量子效率为31.2%。
Figure 6. PL spectra of polymers in CHCl3
图6.聚合物溶液状态下的荧光光谱图

Figure 7. PL spectra of polymers in film
图7. 聚合物薄膜状态下的荧光光谱图
3.3. 聚合物的酸致变色分析
图8~10分别为聚合物P1、P2和P3在CHCl3-CF3COOH中的酸致变色紫外-可见光谱图。从图中可以看出,随着三氟乙酸浓度的增大,聚合物P1、P2和P3分别在464 nm、400 nm和347 nm处的吸收峰强度不断降低,而且聚合物P2在76 nm处出现新的吸收峰并且该吸收峰的强度随着三氟乙酸浓度的增大而增强。与P1和P3相比,P2对酸的敏感度较好,这可能是因为P1中苯撑乙炔的刚性平面环结构上的两个烷基侧链位置对称,导致酸分子与聚合物分子结合的难度提高;P3中氮原子上的烷基链不易旋转,聚合物分子刚性较大,导致酸分子不易于聚合物分子结合。总体来看,三种聚合物的酸致变色敏感度都较差,原因是聚合物的酸致变色可能是共聚单元中氮原子上的孤对电子与质子结合,导致聚合物主链上共聚单元之间的p-π电子离域范围扩大所致 [19] [20] [21] [22] ,但是侧链的嘧啶基团可能被聚合物主链在相互缠绕过程中被包裹,导致其结合酸分子的能力下降。三种的酸致变色行为均没有呈现出线性关系。

Figure 8. The concentration of polymer P1 (1.5 × 10−5 mol/L) in CHCl3- CF3COOH was (10−2 mol/L): (1) 0, (2) 0.5384 (3) 5.384, (4) 53.84, (5) 538.4, respectively in the UV-vis spectra
图8. 聚合物P1 (1.5 × 10−5 mol/L)在三氟乙酸浓度分别为(10−2 mol/L): (1) 0, (2) 0.5384 (3) 5.384, (4) 53.84, (5) 538.4的紫外吸收图

Figure 9. The concentration of polymer P2 (1.5 × 10−5 mol/L) in CHCl3- CF3COOH was (10−2 mol/L): (1) 0, (2) 0.5384 (3) 5.384, (4) 53.84, (5) 134.6, (6) 403.8, (7) 538.4, respectively in the UV-vis spectra
图9. 聚合物P2 (1.5 × 10−5 mol/L)在三氟乙酸的浓度分别为(10−2 mol/L) (1) 0, (2), 0.5384 (3) 5.384, (4) 53.84, (5) 134.6, (6) 403.8, (7) 538.4的紫外吸收图
3.4. 聚合物的电化学行为
图11(a)和图11(b)分别为三种聚合物在0.1 mol/L Bu4NPF6的乙腈溶液中的负电压(n-掺杂)和正电压(p-掺杂)范围的循环伏安曲线,其相关电化学数据给出在表1中。从图11(b)图中可知,聚合物P1、P2和P3均具有明显的氧化掺杂峰,其位于1.75 V、1.52 V和1.45 V。从图11(a)图中可知,三种聚合物的n-掺杂行为均很弱,除了P1之外,其他聚合物几乎没有n-掺杂峰(还原掺杂峰)。聚合物P1的还原掺杂峰

Figure 10. The concentration of polymer P3 (1.5 × 10−5 mol/L) in CHCl3- CF3COOH was/(10−3 mol/L) (1) 0, (2) 5.384, (3) 53.84, (4) 538.4, (5) 5384, respectively in the UV-vis spectra
图10. 聚合物P3 (1.5 × 10−5 mol/L)在三氟乙酸浓度分别为(10−3 mol/L) (1) 0, (2) 5.384, (3) 53.84, (4) 538.4, (5) 5384

Figure 11. Cyclic voltammogram curves of polymers in CH3CN of 0.1 mol/L Bu4NPF6
图11. 聚合物CH3CN在0.1 mol/L Bu4NPF6 的乙腈溶液中的循环伏安图

Table 1. Electrochemical data of polymers
表1. 聚合的电化学数据
aEox and Ered were onset potential of reduction and oxidation, respectively. bHOMO and LUMO were calculated from the empirical formula HOMO = −(Eox + 4.4), LUMO = −(Ered + 4.4). cElectrochemical band gap (Egel) were estimated using Egel = Eox - Ered. dOptical band gap energies (Egopt) were calculated from the onset edge absorption wavelength in film state. (based on the empirical formula Egopt =1240/λ).
位于−2.28 V,其电化学能带隙为2.86 ev。与聚合物P2和P3相比,聚苯撑乙炔类聚合物P1具有一定电活性。三种聚合物均体现出较好的电化学氧化掺杂和空穴传输行为,可作为P-型半导体材料。
3.5. 聚合物XRD射线粉末衍射和热稳定性
图12、图13是分别为聚合物P1、P2和P3的X射线粉末衍射图和热重(TG)图。从图10中可知,聚合物P1在2θ为23.27˚处出现一个强的衍射峰,其对应于聚合物的层间距,P2在2θ为18.15˚处出现一个强度较大且尖锐的衍射峰,其对应于聚合物的主链分子间距,与P1和P2相比,聚合物P3的衍射峰不明显,说明其结晶程度小于P1和P2。从聚合物XRD衍射峰可知,聚合物结晶性比较差。从图11可以看出,聚合物P1、P2和P3在氮气条件下质量损失率为5%的热分解温度分别为362℃、428℃、438℃,当温度达到800℃时P1、P2和P3质量损失分别为66%、71%、36%。由此可见,聚合物P1、P2和P3具有较好的热稳定性。

Figure 12. XRD patterns of polymers in the powder state
图12. 聚合物的X射线衍射图
3.6. 聚合物的分子量
表2给出了3种聚合物在THF中的数均分子量(Mn),重均分子量(Mw)和多分散指数(PDI)。侧链烷基或烷氧基的引入提高单体在有机溶剂中的溶解性,从而有更多的单元聚合,聚合物的分子量即增加。由于M1单元上的嘧啶基增大其空间位阻,导致P1、P2、P3三种聚合物的分子量均不是特别高;含9,9-二辛基芴和2,5-二辛氧-1,4-二乙炔基苯单元聚合物的分子量远大于与含N-正辛基咔唑单元的聚合物。

Table 2. Molecular weight and distribution of polymers
表2. 聚合物的相对分子量及其分布
4. 结论
本文中以二价钯配合物作为催化剂,分别用Sonogashira或Suzuki碳碳偶联反应合成了含3-(5’-嘧啶基)噻吩单元的聚对苯撑乙炔类、聚芴类和聚咔唑类3种具有良好溶解性的π-共轭荧光聚合物;热重测试表明聚合物的热稳定性能达到光学器件制作条件。在聚合物主链中引入2,5-二辛烷氧基-1,4-二乙炔基苯、9,9-二辛烷基芴和N-正辛烷基咔唑等不同空穴传输共聚单元,可有效调整聚合物的光学和电化学性能。从酸致变色测试可知,三种聚合物均具有酸致变色行为,但是对于酸的响应较差。从电化学测试可知,聚合物均具有一定的电化学氧化掺杂和空穴传输行为。从荧光光谱测试可知,所得聚苯撑乙炔类(P1)、聚芴类(P2)和聚咔唑类(P3)聚合物在溶液状态下发分别发射绿色、蓝色和黄绿色荧光,在薄膜状态下发射橙色、绿色和黄色荧光,并且发光强度较强,有望在聚合物电致发光器件方面应用。
基金项目
感谢国家自然科学基金(Nos. 21164011),新疆大学博士启动基金(Nos. BS150233)对本工作的支持。
NOTES
*通讯作者。