1. 引言
子宫肌瘤在育龄妇女很常见。对于有生育要求或拒绝子宫切除的患者,子宫肌瘤剔除成为代表性手术。现在已知外科手术应激反应会干扰免疫系统功能,总的来说是术后免疫功能受到抑制造成的免疫缺陷。免疫抑制的程度与外科手术应激的严重程度密切相关。免疫抑制状态持续的时间越长,手术后并发感染或脓毒血症等所致死亡率越高。随着腹腔镜手术的开展,证实了腹腔镜外科手术与传统开腹手术相比具有切口小,尤其是对于育龄期女性而言,对腹腔脏器的干扰小、患者痛苦少、恢复快等优点 [1] 。近10年来腹腔镜下肌瘤剔除技术发展迅速,对于大肌瘤患者腹腔镜手术得以广泛应用。本研究通过观察腹腔镜与开腹手术后,大肌瘤患者间T细胞亚群以及相关细胞因子的变化及各项恢复时间的差异,探讨不同手术方式对于大肌瘤患者机体免疫反应的影响,进而对于临床选择大肌瘤患者手术方式作为临床参考依据。
2. 资料及方法
2.1. 临床资料
2009年1月至2014年1月46例,在贵阳市妇幼保健院手术患者需行子宫肌瘤剔除的病例,单发肌瘤直径5 cm~8 cm,手术由有10年以上开腹子宫肌瘤剔除手术经验及3年以上腹腔镜经验医师完成,术前由一名医生根据检查及B超决定可行腹腔镜手术,并与患者谈话后术前决定手术方式,术前发现内膜息肉及黏膜下肌瘤需行宫腹腔镜联合手术者不纳入,术中发现合并内膜异位症、卵巢囊肿、子宫腺肌瘤或肌瘤多发者不纳入本研究,其中腹腔镜手术25例,开腹手术21例,术前行盆腔超声和常规检查。经本院伦理委员会同意并经患者知情同意,抽取患者术前、术后24 h和术后72 h的静脉血标本(肝素抗凝) 5 mL。
2.2. 主要仪器与试剂
FACS-Canto II型流式细胞仪购自美国BD公司。流式Treg 细胞检测试剂盒(鼠抗人CD4-FITC、CD25-APC,FOXP3-PE单克隆抗体)及同型IgG荧光对照均为eBioscience (United Kingdom)产品。
2.3. 标本的采集和检测方法
1) 两组术后情况比较记录两组术后住院时间、下床时间及恢复工作时间,了解腹腔镜组与开腹组的术后恢复情况。
2) 荧光激活细胞分拣术(流式细胞术)测定T细胞亚群
a) CD4+/CD8 + T淋巴细胞计数
所有受试对象抽取清晨空腹时静脉血5 ml,EDTA抗凝,立即送实验室进行后续检测,将20 μL CD4/CD8单抗加入绝对计数管中,加入50 μL EDTA-K2抗凝全血,室温避光15 min,加入免洗溶血素450 μL,室温避光15 min,采用美国BD公司生产的FACS Calibur型流式细胞仪检测CD4+/CD8 + T淋巴细胞计数。MULTISET软件自动分析计算CD4+、CD8+淋巴细胞绝对计数及相应比值。
b) CD4 + CD25 + FOXP3 + Treg细胞群
Ficoll密度样度分离外周血单个核细胞,分别取1 × 106个细胞加入测定管,小鼠血清封闭,并依次标记anti-CD4-FITC及anti-CD25-AAPC单抗,室温避光温育,加穿孔素破膜,血清二次封闭后加入anti-FOXP3单抗,室温避光孵育完成染色,最后于流式细胞仪检测。调整前、侧向角散射光(FSC、SSC),选定淋巴细胞群并设门,以CD25为纵坐标,CD4为横坐标确定CD4 + CD25 + Treg细胞群;进一步将CD4 + T细胞设门,以FOXP3为纵坐标,CD25为横坐标圈出CD4 + CD25 + FOXP3 + Treg细胞群。分析软件为BD公司的Diva软件分析。
2.4. 统计学分析
各项统计使用软件SPSS16.0进行。数据以x ± s表示,采用成组设计的t检验进行统计分析。同一组不同时间点的比较采用配对t检验,不同组间的比较采用独立样本t检验。P < 0.05为差异有统计学意义。
3. 结果
3.1. 两组纳入研究对象情况
两组患者年龄、体重指数(Body Mass Index, BMI)及术前子宫肌瘤体积、子宫体积相比较均无明显差异(P > 0.05),具有可比性(表1)。


Table 1. Comparison of characteristic between two groups
表1. 腹腔镜组与开腹组患者一般情况比较
3.2. 机体恢复情况
随访两组患者治疗后的恢复情况(表2),腹腔镜组与开腹组的下床时间分别为11.16 ± 0.34小时,48.29 ± 9.51小时,差异有显著统计学意义(P < 0.01)。腹腔镜组的住院时间明显短于开腹组(P < 0.01)。腹腔镜组恢复工作时间为8.91 ± 5.41天,明显短于开腹组的恢复工作时间23.29 ± 10.73天,差异有显著统计学意义(P < 0.01)。

Table 2. Comparison of postoperative recovery between two groups
表2. 两组患者术后恢复情况比较
*与开腹组比较,t = −17.488,P = 0.000;** t = −42.659,P = 0.000;*** t = −13.136,P = 0.000。
3.3. 两组外周血T淋巴细胞亚群比较
两组外周血T淋巴细胞亚群比较:腹腔镜组术后24小时、72小时与术前比较,CD4+、CD8+及CD4+/CD8+比例差异无统计学意义。开腹组术后24小时CD4+、CD8+及CD4+/CD8+比例较术前明显下降,差异有统计学意义(P < 0.05),术后72小时CD4+、CD8+及CD4+/CD8+比例有所增高,但与术前比较,差异有统计学意义(P < 0.05)。腹腔镜组及开腹组术前CD4+、CD8+及CD4+/CD8+比较,差异无统计学意义。开腹组术后24小时、72小时CD4+、CD8+与腹腔镜组比较差异有显著性统计学意义(P < 0.01)。开腹组术后24小时CD4+/CD8+比例术后24小时与腹腔镜组比较差异有统计学意义(P < 0.05),术后72小时与腹腔镜组比较差异有显著性统计学意义(P < 0.01) (表3~5)。

Table 3. Changes of peripheral blood CD4+ ratio in two groups at different time
表3. 两组患者在不同时间点的外周血CD4+比例变化
#与术前相比较,P < 0.05;*与腹腔镜组比较,t = −1.259,P = 0.213;** t = 8.349,P = 0.000;*** t = 10.708,P = 0.000。

Table 4. Changes of peripheral blood CD8+ ratio in two groups at different time
表4. 两组患者在不同时间点的外周血CD8+比例变化
#与术前相比较,P < 0.05;*与腹腔镜组比较,t = −0.542,P = 0.59;** t = 22.045,P = 0.000;*** t = 10.572,P = 0.000。

Table 5. Changes of peripheral blood CD4+/CD8+ ratio in two groups at different time
表5. 两组患者手术前后不同时点外周血CD4+/CD8+的变化
#与术前相比较,P < 0.05;*与腹腔镜组比较,t = 0.028,P = 0.978;** t = 2.044,P = 0.048;*** t = 2.818,P = 0.006。
3.4. 两组外周血Treg细胞在不同时期的表达频率
两组间及组内不同时间点外周血Treg细胞所占CD4 + T细胞比例见表6及图1、图2。术前两组比较无明显差异。术后24小时,两组患者分别较手术前有显著增加(P < 0.05),开腹组术后72小时,虽有所下降,但想比较与术也具有统计学意义(P < 0.05),但腹腔镜组术后72小时已明显下降,与术前比较差异无统计学意义(P > 0.05)。术后24小时及72小时两组外周血Treg细胞比例比较,腹腔镜组较开腹组均出现显著性降低(P < 0.05)。

Table 6. Changes of peripheral blood FOXP3 + Treg/CD4 + T (%) before and after operation in two groups
表6. 两组患者手术前后不同时点外周血FOXP3 + Treg/CD4 + T (%)的变化
#与术前相比较,P < 0.05;*与腹腔镜组比较,P = 0.978;** P= 0.068;*** P = 0.026。
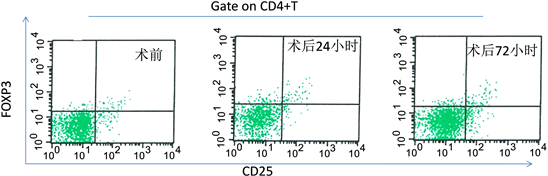
Figure 1. FOXP3 + Treg cells of peripheral blood in laparoscopic group (flow cytometry)
图1. 流式细胞术检测腹腔镜组外周血FOXP3 + Treg细胞
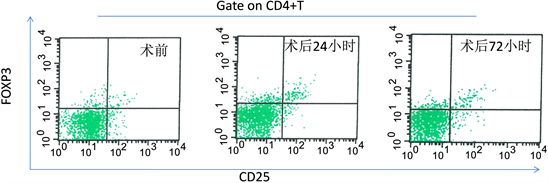
Figure 2. FOXP3 + Treg cells of peripheral blood in abdominal group (flow cytometry)
图2. 流式细胞术检测开腹组外周血FOXP3 + Treg细胞
4. 讨论
4.1. 腹腔镜肌瘤剔除的特点
子宫肌瘤是妇科常见的良性肿瘤,当出血多引起贫血或生长快有压迫症状时需手术治疗。切除子宫从源头上阻止了肌瘤生长,但相对于肌瘤产生的危害而言,失去子宫这一女性特有器官同时给患者带来生理和心理的创伤。文献报道保留子宫剔除肌瘤手术出血多、粘连重、有肌瘤复发的可能,但出血多与剔除肌瘤大小及肌瘤数目有关,肌瘤直径 > 6 cm或数目 ≥ 4个手术时间明显延长,意味着出血量增加,手术并发症及风险增加,对于较大肌瘤腹腔镜下剔除时出血多,缝合时间长等困扰着手术医生,使其手术方式受到限制。对于较大子宫肌瘤而言,手术难度明显增加,且阻断血管靠近输尿管,手术并发症风险相应增加。因此有作者建议以开腹为宜 [2] 。有报道腹腔镜下肌瘤剔除肌壁间肌瘤直 ≥ 5 cm在出血量与手术时间均高于<5 cm组。但随着腹腔镜下各种手术方式的改进及缝合技术的提高,腹腔镜下子宫肌瘤剔除术选择肌瘤大小的适应症也在改变。腹腔镜下肌瘤剔除手术过程主要包括从子宫剔除肌瘤、子宫肌层修复、腹腔粉碎肌瘤取出等,腹腔镜肌瘤剔除比开腹肌瘤剔除手术时间长,但术中出血少、并发症少、疼痛轻且恢复快 [3] 。本研究腹腔镜肌瘤剔除大肌瘤患者术后恢复时间、下床时间及恢复工作时间均明显较开腹组短。提示对于大肌瘤患者而言,腹腔镜下子宫肌瘤剔除术式已经成为希望保留子宫的子宫肌瘤患者的首选手术方式 [4] 。
4.2. 手术对免疫系统影响
4.2.1. 对T细胞亚群影响
免疫系统是机体进行自我保护的防御性结构。其中CD4+和CD8 + T细胞是重要的细胞亚群,调控免疫反应,CD4与CD8的比例对于维持免疫自稳具有重要作用,亚群的数目、比例异常反映细胞免疫功能紊乱和免疫失调 [5] 。手术创伤能出现不同程度的免疫功能抑制,包括CD4/CD8比值失调,是术后感染性增大的重要原因 [6] ,为预后提供参考。本研究表明,盆腔手术创伤会不同程度地抑制机体免疫功能。本研究发现腹腔镜组T淋巴细胞亚群手术前后差异无统计学意义,而开腹组术后均较术前明显降低,提示大肌瘤患者通过腹腔镜下剔除手术对细胞免疫功能的抑制程度明显低于开腹手术,更有利于保护机体的免疫功能,有利于术后恢复。
4.2.2. 对Treg细胞影响
调节性T细胞可以维持机体免疫内环境稳定,其中CD4 + CD25 + Treg是重要的一个亚群 [7] 。目前研究表明,CD4 + CD25 + Treg亚群与炎症反应、炎症相关疾病密切相关 [8] 。FOXP3是Treg细胞生长发育和发挥抑制功能的关键因子,可调控Treg的功能。与传统手术相比,腹腔镜手术具有手术创伤小、术后恢复快、并发症少优点 [9] 。研究表明,手术、麻醉均会导致患者免疫功能受损,这可能与应激反应致使应激激素水平升高,影响内环境,从而影响患者免疫功能有关。本研究结果显示,Treg + Foxp3/CD4+在大肌瘤患者开腹手术后的表达显著增加,提示开腹手术后患者更倾向出现免疫功能失衡,相对比与开腹组,腹腔镜肌瘤剔除术后免疫功能的受影响更小。
5. 结论
本研究比较了CO2气腹腹腔镜与开腹手术治疗体积大的子宫肌瘤,两种手术方式对患者的T细胞影响。结果显示气腹腹腔镜对机体的影响不大,提示CO2气腹不是术后免疫功能受影响的主要原因。可能手术创伤是导致术后细胞免疫功能差异的主要原因。为腹腔镜手术适应症扩大提供了依据。
参考文献
NOTES
*并列第一作者。
#通讯作者。