1. 引言
人体内尿酸(UA)的生成和排泄不平衡时,会引起血液中UA含量异常,诱发多种疾病,例如痛风、高尿酸血症、白血病、莱纳综合征等 [1] [2] 。因此,无论是在临床诊断、还是在药物控制方面,发展简单有效的方法检测人体体液中的UA含量都有十分重要的意义 [3] 。UA具有电化学活性,可以用电化学方法检测,但在实际生物样品中常存在干扰物,如抗坏血酸(AA)等 [4] [5] [6] 。在常规电极(如玻碳电极)上,UA和AA的氧化峰电位相近,电化学信号会发生重叠 [7] [8] ;且生物样品中,AA的浓度较高,因此AA的电化学信号往往较强,会覆盖UA的信号,严重影响UA的测定 [9] 。所以,发展在高浓度AA条件下,选择性测定UA的电化学方法,更具实际意义。
β-环糊精(β-CD)是由若干D-吡喃葡萄糖基以α-1,4-糖苷键连接而成的环状低聚糖,其分子具有“内疏水、外亲水”的特殊结构 [10] 。β-CD有很强的分子识别和富集能力,其疏水内腔可嵌入多种无机、有机分子或无机离子等,从而形成主–客体包合物 [11] [12] [13] 。
基于此,本文采用简单的电化学聚合法,制备聚β-CD修饰玻碳电极(pβ-CD/GCE),作为传感平台。基于β-CD对UA的主客体识别作用,pβ-CD/GCE可以富集UA。相比于裸玻碳电极,该修饰电极检测到的UA的SWV氧化峰电流明显增加。此外,该电极还能有效地分离UA和AA的SWV氧化峰电位,从而实现在高浓度AA条件下,对UA的高灵敏、高选择性测定。
2. 实验部分
2.1. 仪器与试剂
CHI 650A电化学工作站(上海辰华仪器公司);BSA-224电子天平(赛多利斯科学仪器有限公司);KQ-5200超声波清洗仪(宁波新芝生物科技股份有限公司)。电化学研究过程采用三电极体系:工作电极为玻碳电极(GCE,直径3 mm),参比电极为Ag/AgCl电极,辅助电极为铂丝电极。pβ-CD/GC电极的形貌由Hitachi S-4800扫描电子显微分析仪(SEM)进行分析。
β-环糊精(β-CD)购自上海展云化工有限公司;高氯酸(HClO4)、尿酸(UA)购自国药集团化学试剂有限公司;抗坏血酸(AA)购自上海晶纯试剂有限公司;多巴胺盐酸盐(DA)购自南京奥多福尼生物科技有限公司;无水氯化钙(CaCl2)购自天津市北方天医化学试剂厂;水杨酸购自天津市光复精细化工研究所;L-谷氨酸购自上海麦克林生化科技有限公司;葡萄糖购自上海山浦化工有限公司;柠檬酸购自宜兴市第二化学试剂厂;蔗糖购自北京化学试剂二厂;尿素购自宜兴市第二化学试剂厂。其它试剂均为分析纯,实验用水均为二次水。
2.2. pβ-CD/GC电极的制备
玻碳电极先用二次水超声约10 s,然后将电极在麂皮上用0.05 μm Al2O3粉末打磨抛光至呈镜面,再用二次水超声约10 s,洗净后保存在二次水中备用。
通过电聚合的方法,制备pβ-CD/GCE。具体操作如下 [14] :将干净的GC电极置于0.04 M β-环糊精溶液(溶于1 M HClO4)中,在−0.8 V~1.3 V (vs. Ag/AgCl)的电位范围内进行40圈循环伏安(CV)扫描,扫速为100 mV/s。扫描完毕,取出电极,用二次水小心淋洗电极,然后置于二次水中保存备用。
2.3. 检测方法
将GC或pβ-CD/GC电极分别置于0.1 M磷酸缓冲溶液(PBS, pH 7.4)中,利用方波伏安法(SWV),测得空白信号。再将GC或pβ-CD/GC电极分别置于含有一定浓度UA (或AA与UA混合)的PBS溶液中,测得SWV曲线,扣除空白信号,即得到响应信号。
SWV参数设置:扫描范围−0.3 V~0.6 V (vs. Ag/AgCl),振幅25 mV,频率15 Hz,电位增量4 mV。
2.4. 修饰电极的选择性
在最佳实验条件下,固定UA的浓度为50 μM,然后向UA溶液中分别加入一定浓度的干扰物(如10倍浓度的多巴胺,20倍浓度的Ca2+、水杨酸、L-谷氨酸、葡萄糖、柠檬酸,30倍浓度的蔗糖,50倍浓度的尿素),对比加入干扰物前后UA的SWV信号。
2.5. 实际尿样分析
将适量的人体尿液静置一夜,取上清液,并用PBS将其稀释3000倍。在尿液样品中加入不同量的UA,利用pβ-CD/GC电极进行回收实验。
3. 实验结果及讨论
3.1. pβ-CD/GC电极的表征
图1显示了在裸GC电极表面电聚合β-CD的CV曲线。由图可知,随着扫描圈数的增加,CV曲线上的氧化、还原峰均不断增强,说明β-CD被成功电聚合到了电极表面 [15] 。图2是pβ-CD/GC电极的SEM图,可以明显地观察到电极表面有大量纳米颗粒,直观地证明了pβ-CD/GC电极已成功制备。
3.2. UA和AA在修饰电极上的电化学行为
图3显示了GC电极和pβ-CD/GC电极在混合溶液(10 μM UA + 100 μM AA)中的SWV曲线。由图可知,GC电极上,AA的氧化峰电位约为0.13 V,峰电流约为0.89 μA;UA的氧化峰电位约为0.32 V,峰电流约为0.74 μA;二者的峰电位差约0.19 V。与裸GC电极相比,在pβ-CD/GC电极上,AA的氧化峰电位明显负移,峰电流约增加2倍;而UA的氧化峰电流约增加1倍;二者的峰电位差扩大至0.27 V。这是因为环糊精具有主客体识别作用,pβ-CD/GC电极能将溶液中的UA和AA富集在电极表面,从而使UA和AA的氧化峰电流明显增加 [16] 。同时,pβ-CD/GC电极还能有效地分离UA和AA的氧化峰电位。基于此,该修饰电极有望实现在高浓度AA条件下,对UA的灵敏测定。
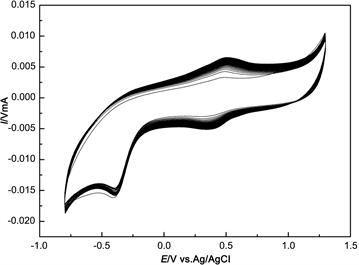
Figure 1. Cyclic voltammograms of the electro-polymerization of β-CD on GCE
图1. 在玻碳电极上电聚合β-环糊精的CV曲线

Figure 2. SEM image of pβ-CD/GC
图2. pβ-CD/GC电极的SEM图

Figure 3. SWV responses at GCE and pβ-CD/GCE in the mixture of 10 μM UA and 100 μM AA
图3. GC和pβ-CD/GC电极在混合溶液(10 μM UA + 100 μM AA)中的SWV曲线
3.3. 高浓度AA对UA测定的影响
之前的实验结果表明,GC和pβ-CD/GC电极在混合溶液(10 μM UA + 100 μM AA)中均能检测到分离的UA和AA的氧化信号。但是,在生物体内,AA的浓度一般远高于UA,为了研究高浓度AA对UA测定的影响,我们考察了在不同浓度AA条件下,GC和pβ-CD/GC电极对UA的测定。
图4显示了GC电极在不同混合溶液中的SWV曲线。其中,UA的浓度固定为10 μΜ;而AA的浓度分别为10 μM、50 μM、100 μM、150 μM、200 μM、250 μM、300 μM。由图可知,在GC电极上,UA和AA的氧化峰电位相隔较小(约0.19 V)。当AA的浓度较小时(10 μΜ~100 μΜ),UA的氧化峰信号相差不大。但当AA的浓度逐渐增加到150 μM以上时,UA的氧化峰电流明显增加,且峰形变化。这是因为AA的浓度过高,AA的SWV氧化信号比较强,使得AA和UA的信号重叠,UA的峰形受到影响,最终导致UA的氧化峰逐渐消失(曲线g)。这些结果表明,虽然GC电极上可以测得分离的UA与AA的氧化信号,但当AA的浓度过高时,AA的氧化峰会对UA的信号造成较大影响 [17] 。因此,裸GC电极无法实现在高浓度AA条件下,对UA的选择性测定。
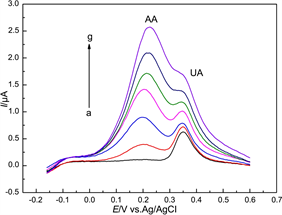
Figure 4. SWV responses at GCE in the mixtures of 10 μM UA and AA with different concentrations (a → g: 10 μM, 50 μM, 100 μM, 150 μM, 200 μM, 250 μM, 300 μM)
图4. GC电极在10 μM UA和不同浓度AA混合溶液中的SWV图。AA的浓度(a → g: 10 μM, 50 μM, 100 μM, 150 μM, 200 μM, 250 μM, 300 μM)
图5显示了pβ-CD/GC电极在不同混合溶液中的SWV曲线。其中,UA的浓度固定为10 μΜ;AA的浓度分别为100 μM (曲线a)和500 μM (曲线b)。由图可知,在pβ-CD/GC电极上,UA和AA的氧化峰电位相隔较大(约0.27 V)。当混合溶液中AA的浓度达到500 μM时,虽然AA的氧化峰信号很强,但对UA信号的影响较小。这些结果表明,pβ-CD/GC电极可以实现在高浓度AA条件下,对UA的选择性测定。
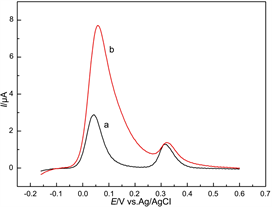
Figure 5. SWV responses at pβ-CD/GCE in the mixtures of 10 μM UA and AA with different concentrations (a: 100 μM, b: 500 μM)
图5. pβ-CD/GC电极在10 μM UA和不同浓度AA混合溶液中的SWV图。AA的浓度(a: 100 μM, b: 500 μM)
3.4. β-CD聚合圈数对检测的影响
图6(A)显示了不同聚合圈数的pβ-CD/GC电极在100 μM UA + 500 μM AA混合溶液中的SWV曲线。图6(B)直观地显示了UA的氧化峰电流随β-CD聚合圈数的变化。由图可知,随着聚合圈数的增加,UA的氧化峰电流先逐渐增大,在聚合圈数为40圈时,达到最大。这是因为电极表面修饰了更多的环糊精,能富集更多的UA。但当β-CD的聚合圈数达到50圈时,UA峰电流开始减小。这可能是因为过多的β-CD覆盖在电极表面,导致彼此的空腔被遮挡,对UA的富集效率降低。因此,实验中选择40圈为最佳的β-CD聚合圈数。

Figure 6. A: SWV responses in the mixture of 100 μM UA and 500μM AA at pβ-CD/GCE with different electro-polymerization cycle numbers (β-CD: a → e: 10, 20, 30, 50, 40). B: The effect of the electro-polymerization cycle number of β-CD on the oxidation peak current of UA
图6. A:不同聚合圈数的pβ-CD/GC电极在100 μM UA + 500 μM AA混合溶液中的SWV曲线(β-CD的聚合圈数:a → e:10,20,30,50,40)。B:UA氧化峰电流随β-CD聚合圈数的变化曲线
3.5. pβ-CD/GC电极对UA的检测
在最优的实验条件下,固定AA的浓度为500 μM,采用SWV法对不同浓度的UA进行检测。由图7(A)可知,随着UA浓度的增大,其峰电流逐渐增加。响应电流值与UA的浓度在10~500 μM范围内呈现良好的线性关系(图7(B)),其线性方程为:I (μA) = 0.07292 c (μM) + 0.6384 (R2 = 0.9990);对UA的检测下限为0.54 μM (S/N = 3)。AA与UA的氧化峰相隔较远,对UA的测定无影响。以上结果表明,该传感器可以实现在高浓度AA条件下,对UA的选择性检测。

Figure 7. A: SWV responses at pβ-CD/GCE for different concentrations of UA in the presence of 500 μM AA (a → h: 0 μM, 10 μM, 100 μM, 200 μM, 300 μM, 400 μM, 500 μM, 600 μM). B: Calibration curve of the oxidation peak current of UA to its concentration
图7. A:pβ-CD/GC电极在500 μM AA和不同浓度UA的混合溶液中的SWV曲线(a → h: 0 μM, 10 μM, 100 μM, 200 μM, 300 μM, 400 μM, 500 μM, 600 μM);B:UA的氧化峰电流与浓度之间的校正曲线
3.6. 修饰电极的重复性
在最优的实验条件下,制备5根pβ-CD/GC电极,分别测定100 μM UA + 500 μM AA的混合溶液,测得UA的氧化峰电流值分别为7.94 μA、8.15 μA、8.28 μA、7.55 μA、7.71 μA,五次检测结果的相对标准偏差(RSD)为3.8%,表明该修饰电极具有良好的重复性。
3.7. 修饰电极的选择性
之前的实验表明,该传感器能够有效地排除高浓度AA的干扰。在最优的实验条件下,固定UA的浓度为50 μM,加入其他可能共存的干扰物,进一步考察传感器的选择性。实验结果表明,10倍浓度的多巴胺,20倍浓度的Ca2+、水杨酸、L-谷氨酸、葡萄糖、柠檬酸,30倍浓度的蔗糖和50倍浓度的尿素对UA的检测均无明显干扰。以上结果表明该修饰电极具有良好的选择性。
3.8. 实际尿样分析
为了评估pβ-CD/GC电极对实际样品检测的性能,以人体尿液样品为例,考察了该修饰电极对UA的回收情况。将适量的人体尿液静置一夜,取上清液,并用PBS将其稀释3000倍。在最优的实验条件下,在尿样中分别加入10 μM UA、200 μM UA、400 μM UA,并进行SWV检测。实验结果如表1所示,回收率在94.32%~100.2%之间。该传感器表现出了令人满意的回收结果,有望进一步用于UA的实际检测中。

Table 1. Recovery assays of UA in real urine samples
表1. 实际尿液样品中UA的回收实验
4. 结论
本文利用电化学聚合法,成功制备了聚β-环糊精修饰玻碳电极(pβ-CD/GCE),作为传感平台。基于β-CD对UA的主客体识别作用,pβ-CD/GC电极可以有效地将UA分子富集于电极表面。相比于裸玻碳电极,该修饰电极检测到的UA的SWV氧化峰电流明显增加。此外,该电极还能有效地分离UA和干扰物AA的SWV氧化峰电位,从而实现在高浓度AA条件下,对UA的选择性测定。在优化的实验条件下,该传感器对UA的检测表现出了令人满意的结果,如宽的线性范围(10 μM~500 μM)、低的检测下限(0.54 μM, S/N = 3)、良好的重复性和选择性,其可用于实际尿样的检测中。
NOTES
*通讯作者。