1. 引言
脑出血是目前临床常见的疾病之一,因其高死亡率及高致残率而严重危害人类健康,目前发病有年轻化趋势,且中国人的发病率较白人高 [1] ,如何降低脑出血患者病死率、病残率,提高好转、治愈率,是当前脑血管疾病防治的重要研究课题之一。脑出血的病理机制较为复杂,且缺乏有效的药物治疗方法。既往研究表明,细胞凋亡机制参与了出血后脑组织的损伤过程。细胞凋亡作为一种基因控制的程序化细胞死亡方式参与了脑出血后脑组织损伤的病理过程,周边脑组织细胞凋亡是引起脑出血患者病死和病残的重要因素。PI3K/AKT信号通路是重要的细胞存活信号通路,通过不同机制激活PI3K/AKT信号传导通路可以有效抑制细胞凋亡过程,从而发挥脑保护作用 [2] 。碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)对多种原因造成的脑损伤具有保护作用 [3] [4] ,是一种很有临床应用价值的神经营养因子。然而,目前国内尚缺乏其起效的足够的机理研究,一定程度上限制了其临床的应用,近年研究发现,bFGF对脑出血后神经损伤有保护作用,本研究通过观察bFGF对脑出血后周边脑组织p-AKT表达及凋亡细胞的影响,探讨bFGF对脑出血的保护机制,为bFGF的临床应用提供实验室依据。
2. 材料与方法
2.1. 实验动物与分组
健康雄性SD大鼠18只,周龄约8周,体重250~280 g左右,试验动物已获得伦理许可,应用随机抽样方法分为3组:假手术组(6只)、出血模型组(6只)、bFGF组(6只),各用于检测凋亡细胞及p-AKT (Ser473)检测。
2.2. 动物模型的制备
实验大鼠以戊巴比妥钠(40 mg/kg)腹腔麻醉,固定于脑立体定向仪上,按照大鼠脑立体定位图谱进行左侧内囊定位,采用脑内注射Ⅶ型胶原酶法建立大鼠脑出血模型。出血模型动物于苏醒后按Bederson法进行神经病学评分,评分 > 3分者说明动物脑出血模型建立成功。
2.3. 给药方法
bFGF由北京博奥森公司提供,用注射用水稀释,bFGF组腹腔注射8 vg/kg [4] ,缺血后即刻给药,其余各组同时腹腔注射等量生理盐水。
2.4. 神经功能评分
参照Zea Longa 5分制进行,分别于出血后24 h对实验大鼠进行评分。相关分数标准:0分:没有相关缺失症状;1分:有轻度神经功能缺失表现(病灶对侧前肢收缩);2分:有中度局灶性神经功能缺失症状(表现为行走时向对侧转圈);3分:有严重神经功能缺失症状(站立及行走时向对侧倾倒);4分:无法自行站立及行走,伴有意识水平减退表现;5分:死亡。
2.5. 应用
HE染色法观测出血脑组织病理学改变,实验大鼠进行灌注取脑,并进一步行固定、脱水、透明、包埋等处理。然后将包埋的组织块进行病理切片,再行HE染色,后在显微镜下进行形态学观察。
2.6. 凋亡细胞数量检测
使用TUNEL方法进行凋亡细胞数目监测,相关过程均按照细胞凋亡检测试剂盒(南京凯基公司产品)的使用说明书施行。在出血周边组织取5个高倍视野,计数凋亡细胞数目(凋亡细胞核染色后呈棕黄色),计数每单位视野中的凋亡细胞均数值。
2.7. 免疫组化法检测AKT表达
使用SABC方法,将做好的病理切片脱蜡至水,用过氧化氢进行封闭处理,抗原热修复(95℃) 20分钟,后使用血清进行封闭,再使用稀释液按照1:50比例稀释p-AKT (Ser473)抗体。将稀释后的抗体滴加至玻片,4℃条件下孵育一夜,次日在室温条件下复温30分钟,移走抗体,PBS液洗三次,然后滴加生物素化的羊抗兔IgG,37℃条件下孵育1小时,再行PBS洗,然后滴加ABC复合物,37℃孵育1小时,PBS液洗,DAB法显色,最后脱水透明,封片,显微镜观察,阳性细胞在视野中呈棕黄色,在每张切片出血周边区随机取不重复的5个视野,使用相机拍照,使用MiVnT图像分析系统对相关图象进行分析,条件为统一光饱和度、亮度及色调,取平均灰度级算术均数用于各组间比较。
2.8. 统计学方法
所有实验数据使用方差分析法进行统计学处理。
3. 结果
3.1. 神经缺损评分
假手术组动物没有观察到神经功能缺损表现,其余两组手术大鼠苏醒后表现出相关神经功能缺损症状。出血模型组和假手术组相比,神经功能缺损情况明显加重(P < 0.05);bFGF组与出血模型组相比,神经功能缺损评分降低(P < 0.05) (见表1)。
 注:模型组与其它两组比较,P < 0.05。
注:模型组与其它两组比较,P < 0.05。
Table 1. The Neurological score and the apoptosis cells surrounding and the phosphorylation level of AKT were compared
表1. 神经功能评分、凋亡细胞数及p-AKT表达比较
3.2. HE染色
假手术组各神经细胞形态正常,胞膜、核膜、核仁存在完整;出血模型组见病出血周边区域细胞脱失较多,细胞核固缩深染,核仁消失。存活细胞数目减少,且伴有不同程度的肿胀,分布不均匀,细胞周围及间隙增宽。bFGF组出血中心神经细胞脱失亦较明显,较模型组无明显差别,出血周边区域细胞形态较模型组规则,脑组织损害程度有所减轻(见图1)。


 A BC注:A:(×200)为假手术组,神经元形态结构正常,排列紧密,神经元内胞核清晰,胞浆丰富;B:(×200)为出血模型组,神经元数量减少,体积缩小,排列紊乱疏松,核固缩,染色质边集;C:(×200)为bFGF干预组存活神经细胞数目增多,和凋亡细胞交错存在。
A BC注:A:(×200)为假手术组,神经元形态结构正常,排列紧密,神经元内胞核清晰,胞浆丰富;B:(×200)为出血模型组,神经元数量减少,体积缩小,排列紊乱疏松,核固缩,染色质边集;C:(×200)为bFGF干预组存活神经细胞数目增多,和凋亡细胞交错存在。
Figure 1. HE staining of rat brain tissue
图1. 大鼠脑组织HE染色
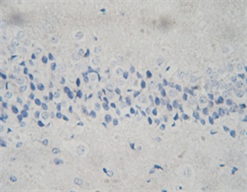

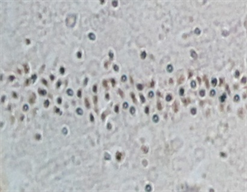 A B C注:在高倍镜下(×200)观察的位置检测凋亡细胞的数量。A:假手术组可见深染的凋亡神经元;B:模型组组神经元数量明显减少,凋亡细胞数目增多;C:可见bFGF干预组凋亡细胞计数较模型组减少。
A B C注:在高倍镜下(×200)观察的位置检测凋亡细胞的数量。A:假手术组可见深染的凋亡神经元;B:模型组组神经元数量明显减少,凋亡细胞数目增多;C:可见bFGF干预组凋亡细胞计数较模型组减少。
Figure 2. TUNEL staining of rat brain tissue
图2. 大鼠脑组织的TUNEL染色
3.3. 出血灶周边区TUNEL染色及光镜下凋亡细胞计数
光镜下假手术组可见少量形态固缩、被染成棕黄色的凋亡细胞,出血模型组于病灶周边皮质区可见有较多凋亡细胞,与假手术组相比明显增多(P < 0.05);bFGF组凋亡细胞计数与出血模型组照组比较明显减少(P < 0.05) (见表1、图2)。
3.4. 出血灶周边区域p-AKT (Ser473)免疫组织化学染色
假手术组少数细胞胞浆被染成棕黄色,胞核呈蓝色,细胞结构较为完整;出血模型组棕黄色细胞数目增多;bFGF组棕黄色细胞数目较模型组明显增多,颜色变深。假手术组可见有p-AKT (Ser473)表达,出血模型组与假手术组比较p-AKT (Ser473)表达减少(P < 0.05),bFGF组与出血模型组比较p-AKT (Ser473)表达明显增多(P < 0.05),细胞染色加深(见表1、图3)。


 A B C注:(×200) AKT主要在神经元胞浆表达,病变后期可表达在细胞核。A:假手术组表达较少,B:出血模型组表达较假手术组明显增多,C:bFGF干预组p-Akt表达较出血模型组增多,P < 0.05。
A B C注:(×200) AKT主要在神经元胞浆表达,病变后期可表达在细胞核。A:假手术组表达较少,B:出血模型组表达较假手术组明显增多,C:bFGF干预组p-Akt表达较出血模型组增多,P < 0.05。
Figure 3. The phosphorylation level of p-AKT
图3. 脑组织p-AKT表达
4. 讨论
脑出血后脑损伤的机制涉及多方面,其中多种原因导致的神经细胞凋亡参与了这一过程 [5] [6] 。细胞凋亡也称为细胞程序性死亡,其过程是一个复杂、精密的调节过程,研究表明,信号传导通路的激活是启动细胞凋亡程序的前提。丝氨酸/苏氨酸(Ser/Thr)激酶蛋白激酶B (PKB/AKT)处于多种信号传导途径的交叉口 [7] ,是一条重要的信号传导通路,AKT是PI3K途径的关键效应成分,可通过PI3K的作用而被磷酸化激活,p-AKT (Ser473)即其活化后的形式之一。活化后的AKT通过介导胰岛素、多种生长因子、凝血酶等,多途径地促进细胞成活,发挥广泛的抗凋亡和细胞保护作用。本试验中出血模型组p-AKT (Ser473)阳性细胞数较假手术组明显减少,细胞凋亡数目增加,进一步表明p-AKT (Ser473)参与了脑出血后细胞凋亡的病理过程。
碱性成纤维细胞生长因子是一种作用广泛的神经营养因子,在中枢神经系统内,bFGF在减少神经细胞对各种损伤因素的损害方面发挥着重要作用,而其受体分布于神经细胞的细胞膜表面,正常生理条件下,bFGF与其受体结合后,引发受体的二聚化反应,从而引发相关的信号传导和生理效应 [8] 。已有研究表明,脑组织受到各种损伤时,外源性bFGF可通过血脑屏障而发挥其神经保护作用。本实验发现,与出血模型组相比,bFGF组P-Akt (Ser473)表达明显增多,细胞凋亡数目减少,这表明p-AKT (Ser473)具有明显的抗细胞凋亡,增强脑组织对出血性损伤的耐受作用;bFGF能有效减少出血后周边皮质区的神经细胞凋亡,从而促进神经细胞存活,减少出血后神经功能缺损症状,实现其神经保护作用,其具体机制可能通过上调p-AKT (Ser473)表达来实现。
基金项目
山东省淄博市科学技术发展计划(政策引导类项目) (2013GG01265)。
参考文献