1. 引言
里默氏杆菌(Riemerella anatipestifer, RA)在我国广泛存在,且有多达21种血清型 [1]。里默氏菌没有鞭毛和纤毛等附属结构,有报道包括外膜蛋白和外毒素等具有毒力贡献 [2] [3] [4]。胡青海等 [5] 在2013年揭示了RA生物膜形成的规律,且证明它也是里默氏菌的毒力因子,这引起了很多研究者的兴趣 [6]。细菌生物膜的主要成份是多糖物质 [7],含水量高达90%以上,与染料的亲和力弱,塌陷或者皱缩产生形变 [8],通常将菌体和背景分别着色,把不透明的生物膜衬托出来以便于观察,但普通显微镜观察生物膜效果不理想 [9]。另一种方法是负染法再行电子显微镜观察,由于细菌带负电荷 [7],需要采用较强电子散射能力和易被生物吸附的试剂诸如钼酸铵、四氧化锇、磷钨酸等进行染色,经电子显微镜可以看到普通显微镜下无法看清楚的结构,但该方法需要制片、高锰酸钾氧化、水洗、草酸漂白、水洗、95%酒精分化、烘干、二甲苯固封等步骤,程序复杂,操作繁琐。本研究是在基底表面(玻璃或者硅片基底)进行化学改性处理,可以直接在基底表面固定RA,经适当条件优化可行SEM/TEM观察,具有耗时少、操作简单等优点。
2. 试剂和方法
2.1. 试剂
3-氨丙基三乙氧基硅烷(APTES)购买自上海远幕生物公司;戊二醛购买自山西益鑫泰生物科技有限公司;其它试剂均属分析纯,购买自重庆川东化工有限公司;里默氏杆菌(RA)为本实验室分离保存;磷钨酸染色SEM观察在陆军军医大学电镜中心完成;醛基化表面固定SEM观察在重庆科技学院大型仪器共享中心完成。
2.2. 方法
2.2.1. 细菌的分离和纯化参照文献 [10] 的方法执行。
“在无菌条件下将病死鸭脑组织接种于巧克力营养琼脂平板,置蜡烛缸中37℃培养24 h,可疑菌落用巧克力琼脂平板纯化及扩大培养 [3]。”
2.2.2. 常规染色光学显微镜观察
细菌的生物膜观察经常性使用干墨水负染法染色,其程序为①加一滴60 g/l葡萄糖液于洁净载玻片的一端,然后挑取少量菌体与其混合,再加一环墨水,充分混匀;②另取一端边缘光滑的载玻片作推片,将一端边缘置于混合液前方,然后稍向后拉,当片与混合液接触后,轻轻左右移动,使之沿片接触的后缘散开,尔后以大约30˚角迅速将混合液推向玻片另一端,使混合液铺成薄层;③空气中自然干燥;④用甲醇浸没涂片固定1 min,弃去甲醇;⑤在酒精灯上方用文火干燥;⑥用甲基紫染1~2 min;⑦用自来水轻轻冲洗,自然干燥;⑧高倍镜或油镜检查。
2.2.3. 磷钨酸染色电子显微镜观察
样品制作程序为:①收集/离心菌体。②清洗菌体。③固定菌体。按常规方法脱水。2.5%戊二醛溶液固定2~4 h → 磷酸缓冲液清洗3次 → 1%锇酸4~6 h → 缓冲液清洗3次 → 乙醇梯度脱;④临界点干燥。⑤离子溅射金。⑥SEM观察。
2.2.4. 醛基化玻片固定电子显微镜观察
硅片在H2SO4/H2O2 (V/V = 3:1)中氧化30分钟,去离子水清洗3次,得到氧化硅片。在APTES/H2SO4 (V/V = 1:15)混合溶液中反应2小时,先用乙醇清洗3次,再用PBS清洗3次。硅片在戊二醛/PBS溶液中反应1.5小时后,先用PBS清洗,再用去离子水清洗3次,制成的玻片。然后稀释菌液,调整到1 × 105 CUF含量,滴加在玻片基底表面,自然阴干,放干燥箱烘干若干时间,制备好的样品经喷金处理直接观察。
3. 结果
3.1. 光学显微镜观察
从图1可见,常规染色RA图像只能呈现黑色的模糊背影,菌体呈现较好的形态,但细菌产生生物膜的时间和厚度很不一样,还要视具体的染色操作技术的熟练程度而论。因此,此种方法的效果并不能很好地观察到RA的生物膜结构。
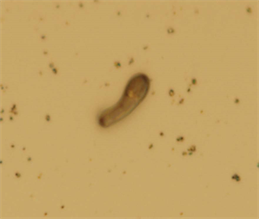
Figure 1. Optical observation of RA dyed by conventional method. 1000× amplification
图1. RA常规染色光镜图1000×
3.2. 磷钨酸染色SEM观察
实验中我们将细菌严格按照既定操作程序处理。如图2所示,RA在SEM图像中显示无菌毛和鞭毛等附属结构,菌体经放大15,000倍,大小2~3 × 3~5 um。从图中我们可以看到图像的背景,而RA轮廓清晰可见,这是由于染液中某些电子密度高的物质包埋低电子密度的样品,但仍然不能很好地呈现生物膜结构。利用扫描电镜可以对细菌的附属结构,例如菌毛、鞭毛等清晰观察,但电子显微重依赖电子的穿透作用,而生物样品一般导电性能差,因此成像效果较差。

Figure 2. SEM observation of RA dyed by phosphato-tungstic acid.15000× amplification
图2. RA的常规染色SEM图像15000×
3.3. 醛基化硅片SEM观察
RA在戊二醛表面直接固定,在SEM图像中呈现清晰的图像(图3)。为了获得更清晰的图像,我们对RA进行了喷金处理,如图3a为常规染色法获得的SEM图像,而图3b为经过优化后获得的SEM图像,可以看出,在菌体外围出现一层明显的透明圈,应该归于RA生物膜结构由于干燥或者喷金发生与菌体龟裂的结果。喷金可以明显提高样品的导电性,增强图像对比度和清晰度。研究发现,喷金时间对成像结果很重要。金膜太厚会掩盖样品的表面细节,太薄样品的导电性差,都会影响观察结果。研究证明结果表明,喷金5~20秒可以得到满意的效果。细菌表面有蛋白质和糖基等结构固定,可以通过不同的连接方法进行固定。不同修饰方法对于蛋白质的固定能力也不同。
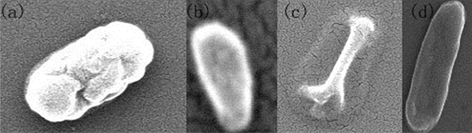
Figure 3. SEM observation of RA directly treated by gold-spray and tethered on silicon substrate 20,000× amplification
图3. 对RA喷金处理得到的SEM图像20,000×
经过优化,我们发现以60℃加热30分钟,喷金5秒会获得满意的效果。值得注意的是,喷金过渡会使RA菌体龟裂,产生质壁分裂。SEM观察时,高对比度使图像富有立体感,但是对比度太高也会损失一些细微的结构。我们还意外地捕捉到RA赘生物在菌体侧壁和顶端分别出芽生长的情况,这为揭开RA分裂方式提供了有益的佐证。如图4所示,在RA的侧面和顶部分别捕捉到附着的赘生物。
4. 讨论
由于细菌菌体本身的生物属性及蛋白质、脂肪、糖等化学本质,以及荚膜并不依赖微生物的严格养分,即使添加更多的糖分对RA大罐发酵得到的菌体也是如此,细胞壁与细胞内容物之间并不能很好地进行区分,更不能把荚膜结构与细胞膜严格区分开来 [11]。荚膜主要与细菌的毒力与黏附性能等有关,胡青海等认为生物膜可能跟基因有关 [12]。因此,即使采用常规的经典的染色处理RA再行高分辨的SEM观察,也不能很好地观察到RA的荚膜结构。用磷钨酸染色,由于染色液的溶剂、离子组成、亲水性、
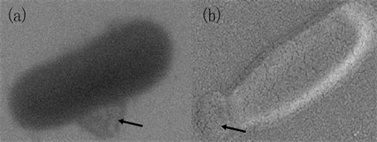
Figure 4. SEM of RA’s neoplasm tethered (a) on the side and (b) on the top (arrow noted)
图4. RA赘生物的SEM图像(a)侧面附着,(b)顶端附着
PH值等变化都有可能引起有缺陷的SEM图像。样品的亲水性也是容易引起负染色缺陷重要原因,当亲水性好的时候,负染色结果经常显示背景差,且样品浓度得不到真实显示。我们采用直接在醛基化硅片表面固定RA,经适当的加热和喷金处理,可以获得较清晰的RA菌体及其荚膜等附属结构的SEM图像。韦强等 [13] 2005年提取了RAⅡ赘生物,并得到有关RA赘生物的SEM图像。研究还获得了RA赘生物从不同的菌体部位释放SEM图像,这为揭开RA赘生物的毒力贡献具有方法学价值。
5. 结论
硅片表面经醛基化处理可以共价固定里默氏杆菌,在60℃烘干30分钟喷金5秒,可以直接用SEM观察到表面的生物膜结构,与常规染色与磷钨酸染色比较具有图像更清晰,耗时短,容易操作等特点,可以为RA研究提供新的方法学。
基金项目
研究得到重庆市科委民生项目(cstc2016shmszx0600)和工业发酵微生物重庆市重点实验室开放基金资助(LIFM201712),以及重庆市教委科技项目KJZD-K201806401和KJ1605701与KJ1505901资助。