1. 前言
预制肉分为调理肉制品和腌腊肉制品。它是以畜禽肉为主要原料,通过添加适量的调味料或者辅料,经过适当的加工工艺如滚揉、搅拌、成型等过程或者腌制、腊制等过程,以包装或者散装等形式在冷冻、冷藏或者常温条件下贮存、运输、销售,需要经过烹饪后食用的非即食类肉质品 [1]。近年来,预制肉的兴起符合现代人快节奏的生活方式。我国调理肉制品行业目前处于初级发展阶段,大多数企业包括在该行业略为领先的企业也是在2000年后开始起步,国内不同种类的调理肉制品价格差异很大,福成黑牛背A级牛排标价916元/公斤,一般品牌的羊肉卷价格在45元/公斤左右,某些不法商贩为牟取暴利以次充好或者为提高肉制品的感官特征、延长肉制品货架期超量超范围使用添加剂等行为严重扰乱了食品市场秩序。腌腊肉制品作为我国传统肉制品之一,是原料肉经过预处理、腌制、酱制、晾晒或者烘烤等工艺加工制成的生肉类制品 [2],如咸肉、腊肉、板鸭、中式火腿、腊肠普遍有着悠久的文化历史和地域历史,其腌制过程中使用的调味料和添加剂以及腌腊肉在使用前进行高温烹饪处理产生的杂胺类化合物以及氮二甲基亚硝胺类物质是此类食品安全的重点关注方面 [3]。
目前中国国内预制肉商超销售比率达不到10%,90%以上的预制肉制品消费集中在家庭消费,预制肉制品大部分流向农批、餐饮小终端,预制肉的食品安全问题情况比较复杂 [4]。预制调理肉在加工过程中为具备良好的嚼感、质构和特有的美味可以在其混合、滚揉时加入复配形成的天然粘接剂(辅料浆包括海藻酸钠、黄原胶、瓜尔豆胶及其混合物)并结合后续的固型工艺可使制得的预制调理肉制品呈现良好的肥瘦相间的外观,但是国家安全标准不允许添加硝酸盐或者亚硝酸盐改善其调理肉制品色泽等感官特征。而对于腌腊肉制品而言,加入适量的硝酸盐和亚硝酸盐在其腌渍处理过程中,不仅可以使瘦肉呈现鲜艳的颜色同时能够抑制肉毒梭菌的繁殖能力防止食用者肉毒素中毒还可使肉类本身具备良好的风味,但是值得警惕的是,硝酸盐亚硝酸盐的过量添加,可使摄入者人体血红蛋白中的Fe离子失去携氧能力,同时分解产生的-NO可与肉中胺结合生成具有致癌性的亚硝胺,同时腌腊肉制品食用前的高温加工方式如油炸、烧烤、煎炒会对致癌物氮二甲基亚硝胺的生成产生积极地促进作用 [5]。《GB2760-2014 食品安全国家标准 食品添加剂使用标准》对08.02预制肉制品的硝酸盐、亚硝酸盐的使用有明确的规定:08.02.01调理肉制品(生肉添加调理料)中不允许添加硝酸盐和亚硝酸盐,08.02.02腌腊肉制品(咸肉、腊肉、板鸭、中式火腿、腊肠)中硝酸盐最大使用量0.5 g/kg残留量 ≤ 30 mg/kg,亚硝酸盐(以亚硝酸钠计)最大使用量0.15 g/kg残留量(以亚硝酸钠计) ≤ 30 mg/kg。阴离子的检测方法有比浊法、比色法、滴定法、紫外可见分光光度法、离子选择电极法等 [6] [7],这类传统方法操作繁琐、灵敏度低、干扰因素多、费时费力,无法满足实际工作中大批量的检验检测,而离子色谱法操作简便、灵敏快速 [8],已经广泛应用于环境及食品的水质分析当中 [9] - [15],在预制肉中的检测应用鲜见报道,有待研究人员进一步开发与利用。
2. 材料与方法
2.1. 试验材料
2.1.1. 样品
腌腊肉肠国家标准物质MA-MP-002 [硝酸盐:30 mg/kg ± 2.1 mg/kg;亚硝酸盐:10 mg/kg ± 0.7 mg/kg]。
2.1.2. 试剂及主要仪器设备
硝酸盐标准溶液BW3058:1000 mg/L;
亚硝酸盐标准溶液GBW(E)080223:100 mg/L;
氢氧化钠(优级纯):天津风船化学试剂科技有限公司;
Potassium Hydroxide:Thermo;
万分之一分析天平(0.0001 g):METTLER TOLEDO;
SCQ-7201E双频加热型超声波清洗机:上海声彦超声波仪器有限公司;
DIONEX ICS-5000 DP离子色谱仪:Thermo;
DIONEX AS-AP自动进样器:Thermo;
Smasher均质器:梅特勒;
UPT-Ⅱ-20T超纯水制备机:成都超纯科技有限公司;
Frontier 5000离心机:OHAUS;
UB-10酸度计:美国赛多利斯;
13 mm NYL 0.20 μm滤头:希波氏;
钠柱:Cleanert IC-Na;Ag柱:Cleanert IC-Ag;去有机物柱:Cleanert IC-RP;
所有使用的玻璃器皿使用前均需依次用2 mol/L氢氧化钾和水分别浸泡4 h,然后用水冲洗3次,晾干使用。
2.2. 试验方法
2.2.1. 提取液pH值对样品中硝酸盐、亚硝酸盐含量测定的影响
1) 样品前处理
取国家标准物质腌腊肉肠样品经均质机均质后,分别称取3 g样品(精确至0.001 g)于150 mL具塞锥形瓶中,分别加入80 mL pH 4.5、pH 5.5、pH 6.5、pH 7.5、pH 8.5、pH 9.5的KOH水溶液在35℃的超声波中提取,提取时间10 min,取出具塞锥形瓶晾至室温后转移定容至100 mL容量瓶中,加水稀释至刻度,混匀。取部分溶液于8000 r/min离心机上离心10 min。用10 mL针管注射器抽取上清液依次过Cleanert IC-Ag柱、Cleanert IC-Na柱、Cleanert IC-RP柱,上机检测。
2) 上机条件
采用KOH淋洗液梯度洗脱,浓度为10 mmol/L 3 min,40 mmol/L 15 min,10 mmol/L 5 min,离子交换柱使用阴离子柱DIONEX IONPACTM AS19 4 × 250 mm,检测器使用电导检测器,抑制电流60 mA,检测池温度35℃。测定方法:外标法。
3) 结果计算
试样中硝酸盐含量、亚硝酸盐含量计算公式如下:
——试样中亚硝酸根离子或者硝酸根离子含量,mg/kg;
——测定用试液中的亚硝酸根离子或者硝酸根离子浓度,mg/L;
——试剂空白液中亚硝酸根离子或硝酸根离子浓度,mg/L;
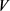 ——试样溶液体积,mL;
——试样溶液体积,mL;
——试样溶液稀释倍数;
1000——换算系数;
——试样取样量,g。
试样中测得的亚硝酸根离子含量乘以换算系数1.5为亚硝酸盐(以亚硝酸钠计)含量;试样中测得的硝酸根离子含量乘以换算系数1.37为硝酸盐(以硝酸钠计)含量。
2.2.2. 提取液温度对样品中硝酸盐、亚硝酸盐含量测定的影响
取国家标准物质腌腊肉肠样品经均质机均质后,分别称取3 g样品(精确至0.001 g)于150 mL具塞锥形瓶中,分5组试验,加入2.2.1. 1)的最佳pH值的溶液,选取超声波40 kHz,提取温度25℃、35℃、45℃、55℃、65℃进行试验,提取时间10 min,取出具塞锥形瓶晾至室温后转移定容至100 mL容量瓶中,加水稀释至刻度,混匀。取部分溶液于8000 r/min离心机上离心10 min。用10 mL针管注射器抽取上清液依次过Clean ert IC-Ag柱、Cleanert IC-Na柱、Cleanert IC-RP柱,上机检测,结果计算按照2.2.1进行。
2.2.3. 提取时间对样品中硝酸盐、亚硝酸盐含量测定的影响
按照2.1.1. 1)称量样品,分4组试验,选择2.2.1和2.2.2的最佳pH值的溶液,最佳的提取温度进行试验,提取时间5 min、10 min、15 min、20 min,取出具塞锥形瓶晾至室温后转移定容至100 mL容量瓶中,加水稀释至刻度,混匀。取部分溶液于8000 r/min离心机上离心10 min。用10 mL针管注射器抽取上清液依次过Clean ert IC-Ag柱、Cleanert IC-Na柱、Cleanert IC-RP柱,上机检测,结果计算按照2.2.1进行。
2.2.4. 离心机转速对样品中硝酸盐、亚硝酸盐含量测定的影响
按照2.1.1. 1)称量样品,分6组试验,选择2.2.1、2.2.2、2.2.3的最佳pH值的溶液,最佳的提取温度、最佳的提取时间进行试验,取出具塞锥形瓶晾至室温后转移定容至100 mL容量瓶中,加水稀释至刻度,混匀。取部分溶液于5000 r/min、6000 r/min、7000 r/min、8000 r/min、9000 r/min、10,000 r/min离心机上离心10 min。用10 mL针管注射器抽取上清液依次过Clean ert IC-Ag柱、Cleanert IC-Na柱、Cleanert IC-RP柱,上机检测,结果计算按照2.2.1进行。
2.2.5. KOH淋洗液浓度对样品中硝酸盐、亚硝酸盐含量测定的影响
按照2.1.1. 1)称量样品,选择2.2.1~2.2.3中最佳的pH值溶液,最佳的提取温度、最佳的提取时间进行样品处理,取出具塞锥形瓶晾至室温后转移定容至100 mL容量瓶中,加水稀释至刻度,混匀。选取2.2.4中最佳的离心机转速处理样品,用10 mL针管注射器抽取上清液依次过Clean ert IC-Ag柱、Cleanert IC-Na柱、Cleanert IC-RP柱,上机检测,检测淋洗液浓度选择5 mmoL~100 mmoL之间调整变化,结果计算按照2.2.1进行。
3. 结果
3.1. 提取液中pH值变化对样品中硝酸盐、亚硝酸盐含量测定的影响
试验发现KOH提取液pH值对试样的提取测定影响大。当pH值在8.5时能使试验结果更加可靠,而提取液pH值在6.5以下会使试验结果不可靠,因此该步骤筛选提取液pH值为8.5时为最佳条件。结果见表1。

Table 1. The effect of the extract pH on determination of nitrate and nitrite content in samples
表1. KOH提取液pH值对样品中硝酸盐和亚硝酸盐含量测定的影响
3.2. 提取液温度对样品中硝酸盐、亚硝酸盐含量测定的影响
试验发现提取液温度对试样的提取测定影响不显著,在超声波提取、提取液pH值8.5的状态下,提取液温度在35℃时即可有效的提取试样中的硝酸根和亚硝酸根离子。从节省能源角度考虑,选取提取液温度35℃进行试验即可得到理想的效果。结果见表2。

Table 2. The effect of the extract temperature on determination of nitrate and nitrite content in samples
表2. KOH提取液温度对样品中硝酸盐和亚硝酸盐含量测定的影响
3.3. 提取液提取时间对样品中硝酸盐、亚硝酸盐含量测定的影响
试验发现提取液提取时间对试验的提取测定影响较为显著,提取时间超过10 min,样品的提取测定可以达到较好的效果。与国家标准前处理相比,缩短了试验时间,提高了前处理的效率。结果见表3。

Table 3. The effect of the extract time in KOH solution on determination of nitrate and nitrite content in samples
表3. KOH提取液提取时间对样品中硝酸盐和亚硝酸盐含量测定的影响
3.4. 离心机离心转速对样品中硝酸盐、亚硝酸盐含量测定的影响
试验发现提取溶液经过离心处理可使肉质样品与提取目标物质硝酸盐与亚硝酸盐的澄清溶液有效分离,故对离心机离心转速进行试验,离心时间采用3.3中的最佳时间进行,获得快速且有效的分离转速。结果见表4。

Table 4. The effect of centrifugal speed on determination of nitrate and nitrite content in samples
表4. 离心机离心转速对样品中硝酸盐和亚硝酸盐含量测定的影响
3.5. 淋洗液KOH浓度变化对样品中硝酸盐、亚硝酸盐含量测定的影响
本实验分别尝试了
型和OH-型淋洗液,
型淋洗液经过抑制器抑制以后转变为碳酸,电离出的H+、
会增大背景,降低了灵敏度。相比之下,
型淋洗液经过抑制器抑制后转变为H2O,电离背景电导很低,对灵敏度改变较小,所以本次实验最终选择KOH淋洗液在线发生器。
实验比较了KOH溶液浓度分别在5~70 mmoL变化条件下的色谱图,发现在10 mmoL等梯度淋洗条件下,就能达到好的分离度,但是检测时间过长,需要60 min左右。选择KOH梯度洗脱,选择浓度10 mmol/L 3 min、40 mmol/L 15 min,10 mmol/L 3 min,各组分峰形很好,分离度适宜,且
和
的分离度能够使低浓度的
清晰地分离出来,效率很高。如图1所示:

Figure 1. Chromatogram of the standard sample salted sausage
图1. 国家标准物质腌腊肉肠色谱图
4. 讨论
4.1. 提取液中pH值变化对样品中硝酸盐、亚硝酸盐含量测定的影响
实验过程中提取液酸度的变化对硝酸盐、亚硝酸盐的提取影响较大。分析原因主要是因为碱性条件下肉类的脂肪被皂化,进而减少样品被脂肪包埋作用,使硝酸根、亚硝酸根更容易被提取到水溶液中。提取液在碱性条件下,硝酸根、亚硝酸根以离子形式存在,易溶于水且状态稳定。如果溶液偏酸性,形成的HNO3在温度升高状态下易挥发、也容易分解,会造成一定量的损失。而酸性条件下,亚硝酸盐易与赖氨酸中的ξ-氨基发生反应,还可与α-氨基形成N2,影响亚硝酸盐与硝酸盐的测定。通过实验发现,pH值在8.5时提取效果快速可靠。
4.2. 提取液温度对样品中硝酸盐、亚硝酸盐含量测定的影响
使用频率40 kHz的超声波提取器在不同温度下对样品中硝酸盐亚硝酸盐进行提取实验,在达到溶解平衡之前的一段范围内,提取硝酸盐和亚硝酸盐的量随着提取温度的升高而迅速增加。J结果显示,本实验提取液温度在35℃时即可有效提取试样中的硝酸根和亚硝酸根离子,温度继续增加,提取率变化不大。超声波加温提取法在食品安全上对于微量、衡量物质的提取作用应用比较广泛,它所具有的机械作用、空化作用、热作用可大大缩短提取时间,促进化学成分向溶剂中溶解,得到的化学成分结构和性质也不会改变。本实验提取条件超声频率40 kHz、温度35℃即可得到较好的提取效果。
4.3. 提取液提取时间对样品中硝酸盐、亚硝酸盐含量测定的影响
随着时间的延长,提取液中的硝酸盐和亚硝酸盐向溶液中扩散,最终达到溶解平衡,硝酸盐、亚硝酸盐获得稳定的提取率。本实验提取时间10 min可对样品中硝酸根离子与亚硝酸根离子有效提取。
4.4. 离心机离心转速对样品中硝酸盐、亚硝酸盐含量测定的影响
传统的过滤方式步骤繁琐,损失量较大。高速离心机产生的高速离心力使样品与提取液迅速分层,肉质浆状提取物经过离心处理后呈现紧实的质地,提取液中提取的硝酸根离子与亚硝酸根离子与样品有效分离。
4.5. 淋洗液KOH浓度变化对样品中硝酸盐、亚硝酸盐含量测定的影响
淋洗液KOH浓度适宜,可以使硝酸根、亚硝酸根离子通过离子交换柱与其它阴离子获得好的分离度。肉制品中的阴离子较多,有
、
、
、
、
等,对
测定影响较大的是
。本实验采用样品上机测定前通过Ag柱能有效地去除
。在设计实验时也尝试调整KOH淋洗溶液浓度使用阴离子柱DIONEX IONPACTM AS19 4 × 250 mm使
与
分离,但分离度在1.5左右效果一般,如果遇到高浓度的
依旧会对
掩蔽。本实验采用Ag柱Cleanert IC-Ag去除钠柱
后继续采用Cleanert IC-Na柱去除
,最后采用Cleanert IC-RP去除有机物,浓度选择10 mmol/L 3 min、40 mmol/L 15 min,10 mmol/L 3 min能够在测定预制肉时使各个阴离子达到理想的分离效果。
4.6. 技术指标
依据上述检测条件,将
、
离子加入检测样品中进行分析测定,得到其校正曲线和相关系数,并测定检出限,结果如表5所示,该方法测定
、
时线性范围宽、相关性好。

Table 5. Linear curves, linear ranges and detection limits of nitrite and nitrate by the method
表5.
、
的工作曲线、线性范围和检出限
5. 讨论
国家标准物质腌腊肉肠为样品,采用碱浸提与超声波提取相结合的方法,通过离子色谱法对预制肉制品中硝酸盐与亚硝酸盐含量进行分析测定。考察了提取液pH值、提取液温度、提取时间、离心机转速、淋洗液浓度等影响因素对测定结果的影响。实验发现提取液pH 8.5、提取液温度35℃、提取时间10 min、离心机转速8000 r/min、KOH淋洗液梯度洗脱(浓度10 mmol/L 3 min、40 mmol/L 15 min,10 mmol/L 3 min)为筛选的最佳条件。此条件显著提高了离子色谱法测定预制肉制品中硝酸盐和亚硝酸盐含量的精确度。该方法明显优于国标方法,简便、快速、可信度高。
本课题研究小组通过对市售的43家预调理肉制品和60家腌腊肉制品进行了抽样检验分析,共发现17批次烧烤夜市中经常经营的预调理肉制品检出亚硝酸盐成分,分别是预调理水制品鲳鱼和预调理肉制品风味羊肉,存在超范围使用添加剂情况。通过对腌腊肉制品抽样检验分析,检出亚硝酸盐批次47批次,但未发现硝酸盐与亚硝酸盐超量使用情况。市售的预调理肉制品是生鲜肉或水产品添加调理料经过生产许可或不经过生产许可以简易包装的形式对外销售的预制肉,市场监管人员特别是农贸市场监管人员应加大对预制肉中预调理肉制品的市场监管力度。
基金项目
河南省重大科技专项子课题161100110700-2高温肉制品生产过程中有害物的生成规律及控制措施。