1. 引言
腊叶标本是将新鲜的植物材料用吸水纸反复压制、使其干燥后装订在台纸上,用来观察植物形态和生态的生物标本。腊叶标本是生动直观的教学材料,是植物分类工作的物质基础,在教学、科研生产中发挥着极其重要的作用。腊叶标本制作简单,但易于被空气中的水汽湿润而霉变、植物材料被压制发生褐变现象、使用效率低、难以保留原色 [1] 。长期以来在标本制作中新方法、新技术应用较少,标本保色及储存问题始终没有很好地解决。如何保持腊叶标本的原色,提高成品的真实感,有效保存珍贵的植物资源,已成为人们制作腊叶标本的关键技术。近年来,有大量的文献报道了植物标本保色的方法,主要是通过物理法 [2] (黄肇宇蒋波覃雪梅,2006) (王强胡志成,2015)、化学法(路军芳,刘研璞,2017) (侯江涛杨丽,2016) (詹爱萍,张彦焘,2013)等保持原色。唐安科、李华德利用最传统的绿色固定液将采集的植物标本浸泡其中,待标本叶绿素中的镁离子被溶液中的氢离子置换后,使其绿色消失并呈黄褐色,紧接着这些去镁叶绿色又快速地与溶液中其他金属铯和铜盐作用口,铜离子大量地进入后填补原来镁原子的位置而使植物标本再次呈现绿色,从绿色开始褪色转变为黄褐色继而开始恢复绿色后,标本着色完成后品质不高,颜色还原度低 [3] 。韩峻等、宁小清改用硫酸铜饱和水溶液700 mL、福尔马林50 mL、水250 mL的混合液。根据植物的老嫩程度选择适宜的浸渍时间。经试验后发现,植物幼苗浸3~5 d即可,而成熟的植物则需浸8~14 d。这种方法保色效果一般,颜色还原度不高 [4] 。针对在腊叶标本制作和保色方面存在的问题,本文在安徽六安天堂寨、蚌埠龙子湖、滁州韭山洞等典型采集地,采集几种有代表性的植物叶片进行研究,采用正交试验的试验方法,定量地进行了腊叶标本制作和保色方面实验研究,对比研究得到较好的保色条件及保色效果。现报道如下。
2. 材料与方法
2.1. 材料
试验用的植物有23种(见表1),根据他们叶片所属不同质地及其珍稀程度选用。主要有结香(Edyeworthia chrysantha)青冈(Cyclobalanopsis sp.)人心药(Za srce)白栎(Belog hrasta)等。分别采于六安天堂寨、蚌埠龙子湖以及滁州韭山洞。采集的植物样品主要有革质:即叶片的质地坚韧而较厚(如青冈)。纸质:即叶片质地柔韧而较薄(如紫薇)。肉质:即叶片的质地较厚而多汁(如兔耳草)。膜质:即叶片的质地柔软而极薄(如襄荷)。

Table 1. Source of experimental materials
表1. 实验材料来源
2.2. 仪器
手持式野外光谱分析仪(FieldSpec HandHeld2,ASD,美国,光谱范围325~1075 nm);电子天平(BSM-220.4 220 g/0.1mg,上海)、烧杯、容量瓶、胶头滴管等。
2.3. 药品
冰乙酸,乙酸铜,硫酸铜,丙三醇,无水乙醇和95%的乙醇。以上试剂购自广州化学试剂厂,均为分析纯(AR)。
2.4. 剂的配制
保色液的配制煮沸保色液配方:醋酸铜浸渍液,将醋酸铜结晶逐渐加入到50%的冰醋酸溶液中,不断搅拌,直至不再溶解,配制成饱和溶液,然后稀释成90%、80%、85%、75%、70%的浓度梯度备用。
2.5. 实验方法
试验采用直接压制干燥和控制单因素变量实验以及正交试验3个处理。(以下处理均在采集过第一次光谱之后。)
1) 直接压制干燥试验,将采集备用的23种植物叶片经过清洗、修剪、整理后,打开标本夹板,放上5张吸水纸,再将植物标本整齐、均匀地摆于吸水纸上。绑时,要注意两对角同时用力,保证四角高低一致,反复加压,压紧标本。将标本放于通风阴凉处。重复更换吸水纸,待标本完全干燥后即可 [5] 。
2) 控制单因素变量实验,即控制固色温度改变保持固色时间与固色液浓度(硫酸铜)不变,可以得到保色效果较好的固色温度 [6] 。同样,可以得到保色效果较好的时间和固色液浓度(硫酸铜)。然后按照上述直接压制干燥的方法进行压制。
3) 正交试验,由三因素三水平组合而成,三因素即固色温度、固色时间、固色液浓度(硫酸铜)。三水平即由实验二可得。列出因素水平表,依次进行实验,结束后按照上述直接压制干燥的方法进行压制 [7] 。
2.5.1. 实验流程
1) 摘取的全部新鲜植物叶片进行光谱的采集。
2) 光谱采集后,每种植物叶片取5~10片按照腊叶标本的制作流程压制,用于对比材料。
3) 实验的材料分为纸质、革质植物叶片,对每种叶片均进行单因素实验,单因素实验流程如下;
a) 固定固色液浓度如80%的醋酸铜和固色时间如6 min,变动温度以5℃为温度梯度(65℃~85℃)进行实验求得较佳纸质植物叶片保色温度。
b) 固定固色液温度如75℃和固色时间如6 min,变动固色液浓度以5%为浓度梯度(70%~90%)进行实验求得较佳纸质植物叶片保色浓度。
c) 固定固色液浓度如80%的醋酸铜和固色温度75℃,变动时间以2 min为时间梯度(4~8 min)进行实验求得较佳纸质植物叶片保色时间。
4) 进行正交实验
a) 选因素,定水平:根据单因素实验获得了纸质植物叶片保色的三个因素较佳保色浓度C、较佳时间R、较佳温度T。每个因素3个水平,列出因素水平表。
b) 选择正交表:此为3水平试验,并不考虑交互作用,有3个因素需要占据3列,预留一个空列作为误差的话,标准正交表L9 (34)是最合适的选择。
c) 表头设计:不考虑交互作用,因素可占据任意列。
d) 排出试验方案。
e) 试验结果的方差分析:为考察试验的误差及精细效果,直接采用SPSS方差分析来对此试验进行结果分析。使用SPSS统计软件包对L9(34)正交试验结果进行数据处理,只要按正交表的设计格式输入实验数据,便可获得所需的统计结果。其操作方便,直观,快捷,结果准确,使研究工作事半功倍,此法也可用来处理其他正交试验的数据 [8] 。
f) 所有的实验结束后植物叶片马上进行压制,等待完全干燥后使用HandHeld2进行光谱的采集,光谱数据处理使用仪器自带软件HH2。
这是以众多曲线中的一对相应曲线,前者是保色液处理前仪器光谱曲线(见图1和图3),而后者则是保色液处理后(见图2和图4)的仪器光谱曲线,这是同一片叶子的经过处理前后的曲线差异,可以很明显的看出在500~560 nm处的曲线一和曲线二在相同取光条件下的对绿色的反射率的不同,从而凸显出了不同保色液对其影响。

Figure 1. Dry absorption spectrum of untreated Edyeworthia chrysantha
图1. 未处理结香(Edyeworthia chrysantha)干燥吸光谱
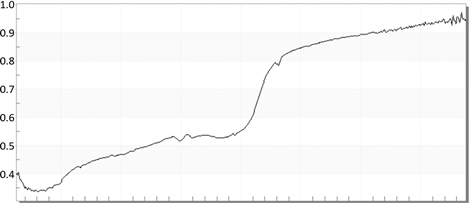
Figure 2. The absorption spectrum of Edyeworthia chrysantha was studied by orthogonal test
图2. 结香(Edyeworthia chrysantha)经正交试验处理后的吸光光谱
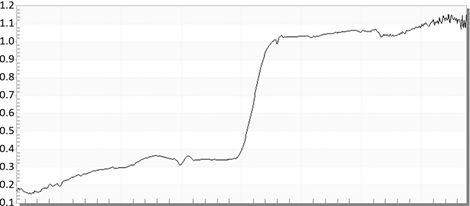
Figure 3. Dry absorption spectrum of untreated Michelia figo
图3. 未处理含笑(Michelia figo)干燥吸光谱

Figure 4. The absorption spectrum of Michelia figo was studied by orthogonal test
图4. 含笑(Michelia figo)经正交试验处理后的吸光光谱
3. 结果与分析
3.1. 单因素实验的结果
时间和浓度不变时,纸质植物叶片得到的较佳的保色温度是80℃,革质植物叶片得到的较佳的保色温度是75℃。
浓度和温度不变时,纸质植物叶片得到的较佳的保色时间是4 min,革质植物叶片得到的较佳的保色时间是8 min。
时间和温度不变时,纸质植物叶片得到的较佳的保色浓度是85%,革质植物叶片得到的较佳的保色浓度是80%。
3.2. 正交实验的结果
已知三因素分别为温度、浓度以及时间,由单因素实验可以获得三水平,设计并实验结果见表2/表3。
4. 结论
正交实验结果:I代表9次实验中同一实验指标温度的平均数,II代表9次实验中同一实验指标时间的平均数III代表9次实验中同一实验指标硫酸铜浓度的平均数。R = max(Ki) − min(Ki)即R值为极差, R(第m列) = 第m列的K1,K2...的各个平均值中的最大值减去最小值之差。Ki为实验指标的平均数。R值越大表示因素对指标的影响越大,因素越重要,由此可知对结香影响因素最大的是浓度,9次试验里采用第二个浓度所得试验结果比较理想。其次影响较大的是时间,9次试验里采用第二个时间所得试验结果比较理想。影响较小的是温度,9次试验里采用第三个温度所得试验结果比较理想。所以结香最佳组合为:时间4 min,温度85℃,浓度85%。在含笑的试验组内,对含笑影响因素最大的是时间,9次试验里采用第三个时间所得试验结果比较理想。其次影响较大的是温度,9次试验里采用第一个温度所得试验结果比较理想。影响较小的是浓度,9次试验里采用第二个浓度所得试验结果比较理想,所以含笑最佳组合为:时间9 min,温度70℃,浓度80%。

Table 2. Results of orthogonal experimental treatment of Edyeworthia chrysantha
表2. 结香(Edyeworthia chrysantha)正交实验处理结果

Table 3. Results of orthogonal experimental treatment of Michelia figo
表3. 含笑(Michelia figo)正交实验数据处理
5. 分析
自然界植物多种多样,少数叶材的色素不容易被分解,如蕨类植物、榆树、槐树叶片及本实验的贴梗海棠,自然干燥与保色处理的效果一样。但大多数叶材自然干燥易变色。铜盐热处理是常用的保持植物绿色的方法,但不是对所有的叶材都适用 [9] 。纸质叶材如酢浆草加热易皱缩变形;而部分革质叶材如荷兰铁、塔柏、油松、铁树、侧柏成熟叶和鹅掌柴成熟叶等不容易复绿。这跟闫德斌等对水寥、山黄莲以及黄肇宇等纸质叶材菠菜、苋菜、小白菜、旱金莲和革质叶材女贞、海桐、桂花、构骨上的研究结果相似 [10] 。赵梁军指出,叶片种类不同,其结构中细胞层次的多少、表皮细胞角质化程度及叶脉排列方式均不同,叶的质地也各不相同。角质膜的存在,使叶材对药液有着不同程度的吸收能力;有些植物叶内含有特殊物质;油松叶含树脂道5~8或更多。可见,叶材的种类影响保色处理的效果 [11] 。用的铜盐试剂一般是硫酸铜和醋酸铜。姜晓莉等和黄艳花指出,用硫酸铜处理后的叶材呈蓝绿色,用醋酸铜处理的叶材更鲜绿。但反应中醋酸铜刺激气味大,通风不良的情况下使用硫酸铜更安全 [12] 。本研究发现不同叶材复绿的效果与硫酸铜浓度,复绿时间以及溶液温度相关,硫酸铜浓度在80%和85%时,叶材复绿时间相同。不同叶材保色所需时间不同,叶材保色干燥后色彩依然会有不同程度的变浅或加深。Chang [13] 等尝试用铬试剂对毛竹进行保色,取得良好效果。可见,今后应针对不同叶材探寻更合理的保色剂。
6. 存在的不足
1) 由于研究时间较短、材料采集的地域较小,种类也较少;
2) 由于吸光光谱采集条件极为苛刻,而实验所提供条件有限,因此,实验中不可避免存在着误差。
参考文献