摘要:
为了研究2种鼠尾草对CdCl2胁迫的耐受性差异并分析这种差异的生理机制,采用水培的方式,研究不同浓度CdCl2(0、60、100、140、180 mg∙L−1)处理对美丽鼠尾草(Salvia meiliensis)、贵州鼠尾草(Salvia. Cavaleriei)生长情况、叶片抗氧化酶活性,根部质膜H+-ATP酶和质膜Ca2+-ATP酶活性以及氮(N)、磷(P)含量的影响。结果显示:1) 贵州鼠尾草地上部分、地下部分以及植株的干重在CdCl2浓度为140 mg∙L−1时低于对照,而美丽鼠尾草地上部分、地下部分以及植株的干重在CdCl2浓度为100 mg∙L−1时就低于对照;2) 随着CdCl2浓度的增加,贵州鼠尾草叶片的过氧化物酶(POD)和过氧化氢酶(CAT)活性受到的促进作用逐渐增强,而美丽鼠尾草POD和CAT活性所受的促进作用分别在CdCl2浓度为100、180 mg∙L−1时开始减弱;3) 2种鼠尾草Ca2+-ATP酶活性均在CdCl2浓度为140 mg∙L−1时受到抑制,但是贵州鼠尾草质膜Ca2+-ATP酶活性受抑制程度小于美丽鼠尾草,贵州鼠尾草质膜H+-ATP酶活性在CdCl2浓度为180 mg∙L−1时受到抑制,而美丽鼠尾草质膜H+-ATP酶活性在CdCl2浓度为100 mg∙L−1时就受到抑制;4) 贵州鼠尾草N、P含量在CdCl2的浓度为180 mg∙L−1时低于对照,而美丽鼠尾草N、P含量在CdCl2的浓度为140 mg∙L−1时就低于对照。研究表明,贵州鼠尾草POD和CAT这2种抗氧化酶对CdCl2胁迫的耐受性高,使其质膜过氧化程度低于美丽鼠尾草,同时贵州鼠尾草根部质膜Ca2+-ATP酶和H+-ATP酶活性对CdCl2胁迫的耐受性强,使其N、P吸收受抑制程度低于美丽鼠尾草;是贵州鼠尾草对CdCl2胁迫的耐受性高于美丽鼠尾草的原因。
Abstract:
Through the water cultivation, effects of treatments with different concentrations of CdCl2(0, 60, 100, 140 and 180 mg∙L−1) on growth, antioxidant enzyme activities of leaves, activities of H+-ATPase and Ca2+-ATPase in the plasma membrane of root, as well as N and P contents of Salvia meiliensis and Salvia cavaleriei were studied in order to compare the tolerance difference between two Salvia to the stress of CaCl2and analyze the physiological mechanism. The result showed that: 1) When the concentration of CdCl2 was 140 mg∙L−1, dry weights of the over ground part, underground part and the plant of S. cavaleriei are lower than those in the control; 2) With the increase of CdCl2 concentration, the accelerating effects on activities of CAT and POD in S. cavaleriei had been gradually enhanced, but the accelerating effects on activities of POD and CAT in S. meiliensis had been weakened respectively when the concentration of CdCl2 was 100 and 180 mg∙L−1; 3) The activity of Ca2+-ATPase both in two kinds of salvia was inhibited when the concentration of CdCl2 was 140 mg∙L−1. But the degree of inhibition on the activity of Ca2+-ATPase in S. cavaleriei was less than that in S. meiliensis. The activity of H+-ATPase in the plasma membrane of S. cavaleriei was inhibited when the concentration of CdCl2 was 180 mg∙L−1. However, the activity of H+-ATPase in the plasma membrane of S. meiliensis was inhibited just when the concentration of CdCl2 was 100 mg∙L−1; 4) N and P contents of S. cavaleriei had lower than those in the control when the concentration of CdCl2 was 180 mg∙L−1. But N and P contents of S. meiliensis were lower than those in the control just when the concentration of CdCl2 is 140 mg∙L−1. This research shows that the tolerance levels of POD and CAT, these two kinds of antioxidase, in S. cavaleriei to the stress of CdCl2 were very high so that the peroxidation degree of its plasma membrane is lower than that of S. meiliensis. Besides, the tolerance of activities of Ca2+-ATPase and H+-ATPase in the root plasma membrane of S. cavaleriei to the stress of CdCl2 is very strong so that its degree of inhibition on N and P absorption is lower than that on S. meiliensis. It’s also the reason why the tolerance of S. cavaleriei to the stress of CdCl2 is higher than that of S. meiliensis.
1. 引言
当今社会工农业生产发展迅速,工业“三废”排放量日益增大,农业生产中农药化肥的使用量逐步提高,使土壤中镉(Cadmium, Cd)含量不断上升,Cd污染已经成为最严重的环境污染之一 [1] 。Cd污染能引起植物的生理代谢紊乱,抑制其正常生长发育,从而降低产量与质量 [2] 。质膜作为植物与周围环境的屏障,是植物体最早受到重金属影响而引起胁迫反应的部位 [3] 。Cd2+能影响植物抗氧化系统的正常工作,诱导质膜过氧化,因此抗氧化酶活性的维持和提高常作为植物耐Cd2+胁迫能力的参考 [4] [5] [6] 。质膜ATP酶是质膜上由ATP驱动的阳离子泵,其群体含有多个与重金属离子跨膜运输有关的酶,在离子运输(质膜H+-ATP酶)、信号转导(质膜Ca2+-ATP酶)等方面作用显著 [7] 。多项研究表明,Cd2+胁迫会抑制质膜ATP酶的活性,但是植物种类的不同,质膜ATP酶活性受抑制的Cd2+浓度也不同 [8] [9] [10] 。Cd2+进入植物体内会对营养元素的吸收造成影响,不同种类植物的Cd2+耐受程度不同,其营养元素的吸收能力受Cd2+的影响也存在差异 [11] 。营养元素的吸收发生变化可以影响到植物的生长情况,这可以为研究植物对Cd2+的耐受能力提供参考。
美丽鼠尾草(Salvia meiliensis)和贵州鼠尾草(Salvia. cavaleriei)同属于唇形科(Labiatae)鼠尾草属(Salvia)荔枝草亚属(Subg. Sclarea)丹参组(Sect. Drymosphace)中的植物 [12] 。近年来鼠尾草属植物因其适应性强,花期长而集中,被用于道路旁边、河湖岸边、园林等的绿化装饰 [12] 。美丽鼠尾草和贵州鼠尾草不但有很高的药用价值 [12] [13] [14] ,而且花期较长、生态适应能力较强,也可以被引种、栽培和驯化作为观赏性植物。目前,关于美丽鼠尾草和贵州鼠尾草对CdCl2胁迫的耐受机制的研究尚未见报道。因此,本试验以这2种鼠尾草为材料,采用水培方法,研究不同浓度的CdCl2对这2种鼠尾草幼苗的生长、抗氧化酶活性、MDA含量、根部质膜H+-ATP酶和质膜Ca2+-ATP酶活性以及N、P含量的影响,并分析了2种鼠尾草对CdCl2耐受性差异的生理机制,以期为2种鼠尾草的引种、栽培等提供一定的理论基础和参考依据。
2. 材料与方法
2.1. 试验材料
美丽鼠尾草和贵州鼠尾草分别引种自安徽省岳西县郊外和湖南张家界市,供试材料均为一年生的实生苗,栽植于北京师范大学珠海分校苗圃。
2.2. 试验方法
选择选择生长良好,长势基本一致的美丽鼠尾草和贵州鼠尾草各15株,置于水培缸中,用霍格兰氏(Hoagland)营养液进行培养。待植株恢复生长后,设5个CdCl2处理浓度0、60、100、140、180 mg∙L−1,每个处理3次重复,进行一次性CdCl2处理20 min。处理后随机排列于温室进行培养,7 d后收获不同处理水平下的植株,测量生长指标,取2种鼠尾草植株第7片叶立即测定MDA含量,取第3片叶与部分根密封于封口袋后立即保存于−70℃冰箱中,叶片用于测定抗氧化酶活性、根用于测定质膜H+-ATP酶活性、质膜Ca2+-ATP酶活性,剩下的根烘干后用于测定N、P含量。
2.3. 测定方法
2.3.1. 生长指标的测定
将植株分为地上部(叶片、径干)与地下部(根系),用去离子水清洗,吸水纸吸干水分后,在103℃烘箱内杀青30 min,再在75℃下烘干至恒重,计算单株鼠尾草地上和地下部生物量。
2.3.2. MDA含量的测定
取叶片1.0 g,加入少量石英砂和10%三氯乙酸2 ml,研磨至匀浆,再加8 ml 10%三氯乙酸进一步研磨,匀浆以4000 r/min离心10 min,其上清液为MDA提取液。MDA含量测定采用Heath和Packer的方法 [15] 。提取液与硫代巴比妥酸(TBA)在酸性条件下加热可发生显色反应,反应溶液在532 nm、600 nm和450 nm波长处测定吸光度值,公式:
可算出中MDA含量(μmol∙g−1FW)
2.3.3. 抗氧化酶活性的测定
取叶片1.0 g置与预冷的研钵中,加入适量预冷的pH7.0磷酸缓冲液和少量石英砂冰浴研磨成匀浆后,转入10 ml容量瓶中,并用缓冲液冲洗研钵数次,合并冲洗液,并定容到10 ml。取提取液5 ml于离心管中,经4℃冷冻离心机15,000 ×g下离心15 min,上清液为抗氧化酶粗提液,4℃下保存备用。CAT活性采用Aebi的紫外吸收法 [16] 测定,以每分钟内A240降低0.1的酶量为1个酶活单位(u)来表示。POD活性采用Polle的愈创木酚法 [17] 测定,以每分钟内A470变化0.01为1个过氧化物酶活性单位(u)表示。
2.3.4. 根部质膜H+-ATP酶和质膜Ca2+-ATP活性测定
质膜H+-ATP酶和质膜Ca2+-ATP提取参照Wang等 [18] 的方法,取0.5 g根部样品加入2倍(m/V)体积预冷的磷酸盐缓冲液(PBS),冰浴研磨。研磨液经4层纱布过滤,滤液经4℃冷冻离心机13,000 × g离心30 min,取上清液测定ATP酶活性。参照Wang等 [18] 的方法测定质膜H+-ATP酶活性(μg∙mg−1∙h−1);参照Ohnish等 [19] 的方法测定质膜Ca2+-ATP酶活性(μg∙mg−1∙h−1)。
2.3.5. 营养元素N、P的测定
将烘干至恒重的根部粉碎至粉末,称取0.5 g于250 ml消煮管,加入0.2 g硫酸铜、6 g硫酸钾及20 mL硫酸用消化炉(上海纤检HYP-320二十孔智能消化炉)在200℃~350℃消煮至澄清,放冷后,移入100 mL容量瓶中定容混匀备用。采用Anantakrishnan等 [20] 的凯氏定氮法利用定氮仪(上海纤检KDN-103F凯氏定氮仪)测定N含量(mg∙g−1)。采用María等 [21] 的磷钼蓝比色法测定P含量(mg∙g−1)。
2.4. 数据分析
利用SPSS 22.0统计软件进行One-way ANVOA方差分析,并进行Duncan多重比较;对根部质膜H+-ATP酶和质膜Ca2+-ATP酶活性与叶片中N、P含量进行Pearson相关性分析。用Microsoft Excel 2013绘制图表。
3. 结果与分析
3.1. CdCl2胁迫对两种鼠尾草生长的影响
由图1可知,在60、100 mg∙L−1 CdCl2胁迫下促进了贵州鼠尾草的生长,使其地上部分、地下部分以及


 注:同一折线上不同字母表示差异显著(P < 0.05),下同。
注:同一折线上不同字母表示差异显著(P < 0.05),下同。
Figure 1. Growth of Salvia cavaleriei and Salvia meiliensis under CdCl2 treatments
图1. 不同浓度CdCl2处理对贵州鼠尾草和美丽鼠尾草生长发育影响
植株的干重升高,而美丽鼠尾草的生长仅在CdCl2浓度为60 mg∙L−1时受到促进,在CdCl2浓度为100 mg∙L−1时生长受到抑制,其地上部分、地下部分以及植株的干重均显著降低。美丽鼠尾草在CdCl2浓度为140 mg∙L−1时地上部分、地下部分以及植株的干重较对照分别降低35.06%、20.83%、26.40%,贵州鼠尾草3项指标在CdCl2浓度为140 mg∙L−1时较对照分别降低9.09%、18.18%、13.00%。
3.2. CdCl2胁迫对两种鼠尾草叶片抗氧化酶活性与MDA含量的影响
由图2可知,CdCl2对2种鼠尾草CAT与POD的活性产生了促进作用。贵州鼠尾草CAT与POD的活性受到的促进作用随着CdCl2浓度的升高而增强,而美丽鼠尾草CAT活性受到的促进作用在CdCl2浓度为180 mg∙L−1时开始减弱,其POD活性受到促进作用在CdCl2浓度为100 mg∙L−1时开始减弱。2种鼠尾草MDA含量随着CdCl2浓度的增加而逐渐上升,在CdCl2浓度为60、100、140、180 mg∙L−1时美丽鼠尾草MDA含量分别比对照高106.47%、138.81%,236.68%、310.61%,贵州鼠尾草MDA含量分别比对照高77.47%、121.31%、211.23%、245.82%,美丽鼠尾草MDA含量的上升幅度在各CdCl2浓度下均高于贵州鼠尾草。


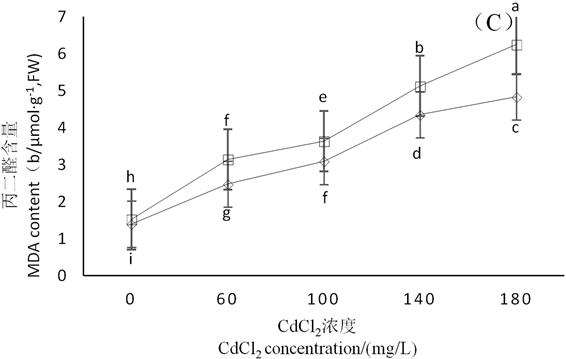
Figure 2. Effects of different concentrations of CdCl2 on MDA content,POD and CAT activity in leaves of S. meiliensis and S. cavalerier
图2. CdCl2胁迫对美丽鼠尾草和贵州鼠尾草叶片MDA含量以及POD和CAT活性的影响
3.3. CdCl2胁迫对两种鼠尾草根部质膜H+-ATP酶和质膜Ca2+-ATP酶活性的影响
由图3可知,随着CdCl2浓度升高,2种鼠尾草根部质膜H+-ATP酶和质膜Ca2+-ATP酶活性先受到促进后受到抑制。在CdCl2浓度为60、100、140 mg∙L−1时贵州鼠尾草质膜H+-ATP酶活性受到不同程度的促进,而美丽鼠尾草质膜H+-ATP酶活性仅在CdCl2浓度为60 mg∙L−1时受到促进。在CdCl2浓度为60、100 mg∙L−1时,2种鼠尾草质膜Ca2+-ATP酶活性均受到促进,在CdCl2浓度为140 mg∙L−1时,2种鼠尾草Ca2+-ATP酶活性均开始受到抑制,但是美丽鼠尾草质膜Ca2+-ATP酶活性所受抑制程度高于贵州鼠尾草。
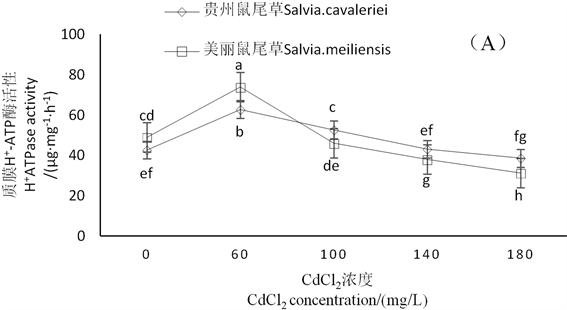
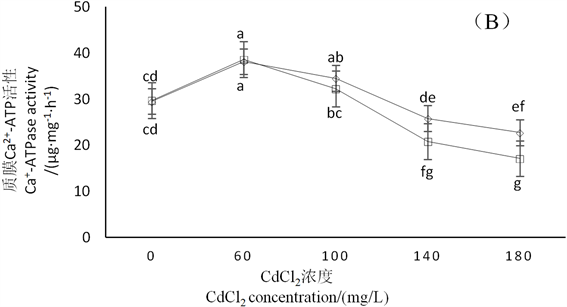
Figure 3. Effects of different concentrations of CdCl2 on Ca2+-ATPase and H+-ATPase activities in root of S. meiliensis and S. cavalerier
图3. 不同浓度CdCl2胁迫对美丽鼠尾草和贵州鼠尾草根部质膜Ca2+-ATP酶与H+-ATP酶活性的影响
3.4. CdCl2胁迫对两种鼠尾草根部N、P含量的影响
由图4可知,随着CdCl2浓度的增加,2种鼠尾草N、P的含量均先升高后降低。贵州鼠尾草N含量在CdCl2浓度为100 mg∙L−1时最大,P含量在CdCl2浓度为60 mg∙L−1时最大,其N与P的含量在CdCl2浓度为180 mg∙L−1时才低于对照。美丽鼠尾草N、P的含量在CdCl2浓度为60 mg∙L−1时最大,在CdCl2浓度为140 mg∙L−1时就低于对照。在CdCl2浓度为140 mg∙L−1时,贵州鼠尾草N、P含量分别比对照高
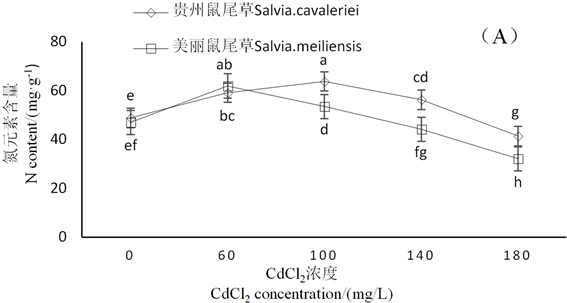

Figure 4. Effects of different concentrations of Cd on N and P in root S. meiliensis and S. cavalerier
图4. 不同浓度CdCl2胁迫对美丽鼠尾草和贵州鼠尾草根部N、P含量的影响
13.23%、3.28%,美丽鼠尾草N、P含量分别比对照低5.95%、11.60%。
3.5. 2种鼠尾草根部质膜H+-ATP酶活性、Ca2+-ATP酶活性、N含量 以及P含量之间的相关性分析

Table 1. Correlation analysis between plasma membrane H+-ATPase, Ca2+-ATPase activity, N content and P content in two Salvia species (n = 30)
表1. 2种鼠尾草根部质膜H+-ATP酶、Ca2+-ATP酶活性、N含量以及P含量之间的相关性分析(n = 30)
注:表中“**”表示在0.01水平显著相关。
从表1可知,2种鼠尾草根部质膜H+-ATP酶活性、Ca2+-ATP酶活性活性、N含量以及P含量之间均呈极显著正相关(P < 0.01)。
4. 讨论与结论
MDA含量常被作为植物细胞过氧化水平和受损程度的判断指标 [22] [23] [24] 。CAT和POD是细胞中重要的抗氧化酶,它们可以将H2O2转化为H2O,从而有效阻止H2O2的积累,防止质膜过氧化 [25] [26] [27] 。有研究表明,植物细胞内活性氧的产生速率超过了活性氧的清除速率,会使得植物膜质过氧化程度加重,MDA含量上升 [28] 。本研究,贵州鼠尾草和美丽鼠尾草MDA含量随着CdCl2浓度的增加而持续升高,表明2种鼠尾草细胞内H2O2的清除速率小于H2O2的生成速率,导致2种鼠尾草质膜受到伤害程度逐渐加大。随着CdCl2浓度增加,贵州鼠尾草POD和CAT活性受到的促进作用逐渐增强,但美丽鼠尾草POD和CAT活性所受的促进作用分别在CdCl2浓度为100、180 mg∙L−1时开始减弱。表明贵州鼠尾草POD和CAT这2种抗氧化酶对CdCl2胁迫的耐受性高,使得贵州鼠尾草质膜过氧化程度低于美丽鼠尾草,MDA含量的上升幅度小于美丽鼠尾草。
质膜H+-ATP酶是细胞上重要的功能蛋白,它能为物质跨膜转运提供驱动力,带动一系列次级运输体系对各种营养物质、离子的转运 [29] [30] [31] 。质膜Ca2+-ATP酶能对细胞内Ca2+平衡起微调作用,Ca2+可以通过信号传递影响质膜H+-ATP酶活性 [7] [10] 。有研究表明,Cd2+进入植物细胞会造成Ca2+浓度上升,同时使质膜Ca2+-ATP酶活性下降,Ca2+无法有效泵出细胞,于是通过信号传递降低质膜H+-ATP酶mRNA的转录水平,导致质膜H+-ATP酶活性降低 [10] 。本研究的结果证实了上述结论,2种鼠尾草质膜Ca2+-ATP酶活性和质膜H+-ATP酶活性呈极显著正相关,质膜Ca2+-ATP酶活性和质膜H+-ATP酶活性与N、P的含量也呈极显著正相关。2种鼠尾草质膜Ca2+-ATP酶活性在CdCl2浓度为140 mg∙L−1时受到抑制,但是贵州鼠尾草Ca2+-ATP酶活性受抑制程度小于美丽鼠尾草,这说明贵州鼠尾草质膜Ca2+-ATP酶对CdCl2胁迫的耐受性强。贵州鼠尾草质膜H+-ATP酶活性在CdCl2浓度为100 mg∙L−1时仍受促进,但美丽鼠尾草质膜H+-ATP酶活性在此浓度下已受到抑制,这说明贵州鼠尾草质膜H+-ATP酶对CdCl2胁迫的耐受性强于美丽鼠尾草,因此表现为贵州鼠尾草N、P含量在CdCl2浓度为180 mg∙L−1时才低于对照,而美丽鼠尾草N、P含量在CdCl2浓度为140 mg∙L−1时就低于对照;在生长上表现为贵州鼠尾草地上部分、地下部分以及植株的干重在CdCl2浓度为140 mg∙L−1低于对照,美丽鼠尾草地上部分、地下部分以及植株的干重在CdCl2浓度为100 mg∙L−1时就低于对照。2种鼠尾草根部质膜H+-ATP酶活性、质膜Ca2+-ATP酶活性、N含量、P含量以及地上部分、地下部分和植株的干重所受抑制时的CdCl2浓度并未完全吻合,说明质膜H+-ATP酶和质膜Ca2+-ATP酶的活性只是影响植物N、P吸收的一部分原因,并且N、P的含量也只是影响植物生长的一部分原因。
综上所述,美丽鼠尾草POD和CAT这两种抗氧化酶对CdCl2胁迫的耐受性低于贵州鼠尾草,使其质膜过氧化程度高于贵州鼠尾草,这是美丽鼠尾草对CdCl2耐受性低于贵州鼠尾草的原因之一;美丽鼠尾草质膜H+-ATP酶和质膜Ca2+-ATP酶对CdCl2胁迫耐受性低于贵州鼠尾草,使其对N、P的吸收更容易受到抑制,这是美丽鼠尾草对CdCl2胁迫的耐受性低于贵州鼠尾草的原因之二。本研究初步比较了2种鼠尾草对CdCl2胁迫耐受差异,为这2种鼠尾草作为观赏植物进行引种、栽培提供了参考。基于贵州鼠尾草对CdCl2胁迫有着较高的耐受性,可以进一步研究其对Cd2+的吸收、解毒机理以及相关抗逆性基因的表达,探究其能否作为一种Cd超积累植物,用于对土壤Cd污染的修复。
基金项目
本研究由1、中国科学院战略生物资源科技支撑体系运行专项(CZBZX-1);2、上海市绿化和市容局辰山专项课题(G172410, G182409)资助。