1. 前言
在大家日益关注的环境问题中,水体富营养化是最严峻的污染问题之一。人类活动导致了过量的氮、磷等营养元素进入水体,引起蓝藻水华的爆发 [1] 。蓝藻水华爆发的优势藻种中能产生毒素的主要有微囊藻属(Microcystis)、鱼腥藻属(Anabaena)等 [2] 。据不完全统计,有害蓝藻水华爆发事件发生率逐年升高,且发生的范围、持续时间、产毒藻种等都呈上升趋势,渔业生产受到影响,水体生态系统受到破坏,饮用水质量下降,人类健康安全受到威胁 [3] 。
科学家发现植物化感物质能有效抑制蓝藻水华,因此利用化感作用的抑藻技术已成为治理水华的研究热点。化感物质是植物释放的次生代谢物质,化感作用是指化感物质能影响其他植物的生长 [4] 。化感物质能有效抑制藻类生长的作用机理有一般被认为有3种途径:影响藻类的光合作用、破坏藻类的细胞膜、影响藻细胞的酶活性 [5] 。
光合作用属于蓝藻生长繁殖最基础的过程之一。有研究表明,粉绿狐尾藻能释放出降低叶绿素a和藻胆蛋白各组分含量的化感物质,进而有效的抑制铜绿微囊藻的生长 [6] 。三种乔木落叶的水浸出液能降低微囊藻细胞中叶绿素a和光合作用主要荧光参数Fv/Fm、Yield、ETRmax,抑制微囊藻的生长 [7] 。叶绿素a和藻胆蛋白起着光能的吸收、传递和转化功能,荧光参数Fv/Fm、Yield、ETRmax表示光合作用中电子传递效率,化感物质抑制了叶绿素a和藻胆蛋白的合成,抑制藻的荧光参数,导致电子传递链阻断,光合作用速率受到抑制,光合产物减少,抑制藻类的生产繁殖 [8] 。
酶在生物体内起着至关重要的作用,能影响生物的正常生理过程。研究人员发现,菖蒲会增加铜绿微囊藻的超氧化物歧化酶(SOD)等抗氧化酶的活性,造成脂质过氧化作用,使藻细胞加速衰老 [9] 。化感物质通过激发或抑制藻类体内酶的活性,使藻类生理功能紊乱,达到化感作用抑藻效应 [10] 。
近年来不少研究表明,植物天然产物黄酮类化合物具有显著抑藻作用 [11] 。本研究选用黄酮类化合物槲皮素作为抑藻成分,将槲皮素与壳聚糖结合制作成槲皮素–壳聚糖抑藻剂小球。将水华鱼腥藻作为试验对象,研究不同剂量的槲皮素–壳聚糖抑藻剂小球对水华鱼腥藻的生长影响,并分析槲皮素抑藻的机理。希望能研究出抑藻效果好、安全性高的抑藻剂,为研发抑藻剂技术提供参考依据。
2. 材料与方法
2.1. 试验藻种
试验藻种选用水华鱼腥藻(Anabena flos-aquae),藻种购自中国科学院水生生物研究所淡水藻种库。
2.2. 藻种培养
本试验藻种采用BG11培养基培养 [12] ,配方见表1。在500 ml锥形瓶中加入100 ml培养基,然后接入水华鱼腥藻藻种,摇匀培养。将水华鱼腥藻在培养箱中培养4~5 d后,即可长到对数增长期,用于试验。
培养条件:温度(25 ± 1)℃,光照4000 lx,光暗比12 h:12 h,藻液每天摇动3~5次。
2.3. 抑藻剂小球的制备
槲皮素(quercetin,纯度 > 99%))购自中国药品生物制品检定所,壳聚糖(脱乙酰度 > 80%)购自国药集团化学试剂有限公司。
文本参考专利发明制作抑藻剂小球 [13] 。取10.0 g壳聚糖和6.5 g槲皮素溶于200 mL水中。溶液在25℃的条件下200 r/min恒温振荡60 min。溶液振荡后用慢速滤纸过滤,得到的沉淀物在25℃下真空干燥24 h。即可得到槲皮素–壳聚糖抑藻剂小球。
2.4. 抑藻实验
取500 mL三角瓶,洗净消毒烘干,每个瓶中加入250 mL水华鱼腥藻的藻液,藻液初始细胞密度约为106 cells∙L−1。在每个瓶中分别加入1、5、10、25、50 mg/L的槲皮素–壳聚糖抑藻剂小球,记为0 h,分别在培养0、6、12、24、36、48、96 h后,检测水华鱼腥藻的各项指标。每组3个平行样,培养条件同2.2所述。
2.5. 叶绿素a测定(热乙醇法)
试验采用热乙醇法进行叶绿素a测定 [14] 。
将50 ml水华鱼腥藻藻液过滤,滤膜放入5 ml的离心管中,−20℃下放置24 h。

Table 1. The composition of BG11 medium
表1. BG11培养基成分
取一定量的90%乙醇放在烧杯中,在80℃~85℃水浴锅中预热。在滤膜的离心管中分别加入4 ml热乙醇,80℃~85℃下水浴2 min。离心管放置在避光室温下,进行6 h萃取。萃取液用25 mm的玻璃纤维滤膜进行过滤,然后用90%乙醇将萃取液定容至10 mL。
参比液为90%乙醇,用分光光度计对萃取液进行比色。样品分别在波长665 nm和750 nm处测消光率,得到E665和E750。比色皿中直接加入1滴1 mol/L的盐酸,加盖摇匀,酸化1 min后分别在波长665 nm和750 nm处测消光率,得到A665和A750。
将数据带入公式中,计算叶绿素a浓度。
其中,Chl a为叶绿素a的浓度,mg/L;V乙醇为萃取液定容时用的乙醇的体积,ml;V样品是初始藻液未进行过滤时的体积,L。
2.6. 藻细胞MDA含量
丙二醛(malondialdehyde, MDA)检测试剂盒购买自南京建成生物工程研究所,测试方法按试剂盒说明书操作。
2.7. 藻胆蛋白测定
水华鱼腥藻的藻胆蛋白包括藻红蛋白(PE)、藻蓝蛋白(PC)和别藻蓝蛋白(APC)。根据参考文献对其进行测定 [15] 。
取3 mL水华鱼腥藻藻样,在10,000 rpm下离心5 min,离心后弃上清液,加入3 ml PBS (0.05 M, pH6.8) 打散混匀。样品存放在液氮中,8 h后拿出,放置在避光室温下溶解,如此反复冻溶4次。然后将样品在10,000 rpm下离心5 min,取上清液,分别测定波长620 nm、650 nm和565 nm下的光吸收值。根据公式计算藻胆蛋白的含量:
2.8. 藻细胞抗氧化酶SOD活性测定
超氧化物歧化酶(superoxide dismutase, SOD)检测试剂盒购买自南京建成生物工程研究所,测试方法按试剂盒说明书操作。
2.9. 藻类叶绿素荧光参数测定
试验选用叶绿素荧光仪(PHYTO-PAM, Walz, Germany)对水华鱼腥藻的叶绿素荧光参数测定。将2 mL水华鱼腥藻藻液避光5 min后,叶绿素荧光仪检测最小荧光F0和最大荧光Fm,得到可变荧光Fv (即Fm-F0),计算可以得到光系统II的最大光化学量子产量Fv/Fm。用仪器的饱和脉冲测定水华鱼腥藻的实际光化学量子产量Yield。仪器间隔性逐渐增大光化光,检测记录光量子产量,通过快速光响应曲线,得到最大电子传递速率ETRmax。
2.10. 数据统计分析
试验样品设置3组平行样,3次重复实验结果均以平均值 ± 标准偏差表示,数据统计学分析采用SPSS (V18)软件进行,绘图处理运用Microsoft Excel2007软件进行。
3. 结果
3.1. 槲皮素对叶绿素a含量影响
水华鱼腥藻藻液中加入槲皮素–壳聚糖抑藻剂小球培养,叶绿素a含量的变化如图1所示。培养96 h后,叶绿素a含量与0 h相比,均有显著下降(p < 0.01);1 mg/L剂量组的叶绿素a含量降低为0 h的58%;50 mg/L剂量组的叶绿素a含量降低为0 h的83%。水华鱼腥藻的叶绿素a含量随着槲皮素–壳聚糖抑藻剂小球的加入量和培养时间呈现出时间-剂量效应变化。
3.2. 槲皮素对藻胆蛋白含量影响
水华鱼腥藻的藻胆蛋白包括藻红蛋白(PE)、藻蓝蛋白(PC)和别藻蓝蛋白(APC),他们是藻类的光合系统II (PS II)中重要捕光功能团,能把吸收的能量传递给叶绿素a [16] 。图2~4中表示的为水华鱼腥藻经槲皮素–壳聚糖抑藻剂小球培养后,不同培养时间和不同剂量组中藻胆蛋白含量的变化。
由图2可以看出,1 mg/L剂量组在开始时,PE的含量有稍微的起伏趋势,在12 h时,PE的含量比0h增加了1%,随后又降低呈平稳趋势。其他剂量组中的PE含量并没有随着培养时间的增加发生明显变化。
图3中,PC含量的变化趋势非常明显。在96 h时,1、5、10、25、50 mg/L剂量组,PC含量比0 h分别增加了35% (p < 0.01)、30% (p < 0.01)、25% (p < 0.5)、23% (p < 0.5)、17% (p < 0.5)。说明水华鱼腥藻的PC含量随着抑藻剂小球培养时间的增加,呈现递增趋势;但是其增长的趋势随着剂量的增高而降低。
图4表示的APC含量变化,随着培养时间的延长和抑藻剂小球剂量的增加呈现了增长趋势。经槲皮素–壳聚糖抑藻剂小球培养后,水华鱼腥藻的APC含量在96 h时1、5、10、25、50 mg/L剂量组比0 h分别增加了18% (p < 0.01)、15% (p < 0.01)、12% (p < 0.01)、10% (p < 0.01)、8% (p < 0.01)。在96 h时,1 mg/L剂量组的APC含量比50 mg/L剂量组高出8%。数据表明水华鱼腥藻的APC含量在抑藻剂小球的影响下,随着剂量的增加和培养时间的延长而增加,且低剂量组中的增长量高于高剂量组。

Figure 1. Effect of alginicide beads on chlorophyll a content in Anabena flos-aquae
图1. 抑藻剂小球对水华鱼腥藻叶绿素a含量的影响

Figure 2. Effect of alginicide beads on phycoerythrin content in Anabena flos-aquae
图2. 抑藻剂小球对水华鱼腥藻藻红蛋白含量的影响

Figure 3. Effect of alginicide beads on phycocyanin content in Anabena flos-aquae
图3. 抑藻剂小球对水华鱼腥藻藻蓝蛋白含量的影响
Figure 4. Effect of alginicide beads on allophycocyanin content in Anabena flos-aquae
图4. 抑藻剂小球对水华鱼腥藻别藻蓝蛋白含量的影响
3.3. 槲皮素对抗氧化酶SOD活性影响
超氧化物歧化酶SOD是重要的抗氧化酶。图5所示的是水华鱼腥藻经槲皮素–壳聚糖抑藻剂小球培养后,各剂量组内SOD活性的变化。
由图可见,SOD活性随着时间的延长出现先增强后减弱的趋势,最后低于正常水平。在低剂量组1 mg/L和5 mg/L,SOD活性在24 h前呈上升趋势,24 h时比0 h增长了21% (P < 0.5)和36% (P < 0.5);随后出现下降趋势,在96 h时比24 h降低了48% (P < 0.01)和43% (P < 0.01),比0 h降低了34% (P < 0.01)和18% (P < 0.01)。10 mg/L剂量组中,SOD活性在36 h时比0 h增长了68% (P < 0.01),在96 h降低到0 h水平。高剂量组25 mg/L和50 mg/L,SOD活性在12 h时比0 h增加了39% (P < 0.01)和53% (P < 0.01),在96 h时比0 h降低了28% (P < 0.5)和51% (P < 0.01)。
3.4. 槲皮素对MDA含量影响
丙二醛MDA 含量是判断膜脂过氧化作用强弱的重要指标。不同剂量的槲皮素–壳聚糖抑藻剂小球处理水华鱼腥藻后,MDA含量变化如图6所示。
图中显示,1 mg/L剂量组中,MDA含量一直呈上升趋势,96 h比0 h增长了48% (P < 0.01)。其他剂量组中,MDA含量都表现出先上升后下降的趋势。5 mg/L剂量组中,MDA含量在48 h比0 h增长了47% (P < 0.01),在96%比0 h增长了41% (P < 0.01),96 h的MDA含量比48 h有所下降。10 mg/L、25 mg/L、50 mg/L剂量组中,MDA含量在36 h比0 h增加了42% (P < 0.01)、49% (P < 0.01)、54% (P < 0.01),在96 h比0 h增加了29% (P < 0.01)、32% (P < 0.01)、32% (P < 0.01)。从数据可知,当抑藻剂小球剂量较低或者培养时间较短时,MDA含量呈现增长趋势,当剂量高且培养时间延长后,MDA含量出现减少的情况,不过相比较正常水平还是有所升高。
3.5. 槲皮素对叶绿素荧光参数的影响
最大光化学量子产量Fv/Fm、实际光化学量子产量Yield、最大电子传递速率ETRmax是重要的叶绿素荧光参数。槲皮素–壳聚糖抑藻剂小球处理水华鱼腥藻后,不同剂量组中叶绿素荧光参数的变化如图7~9所示。
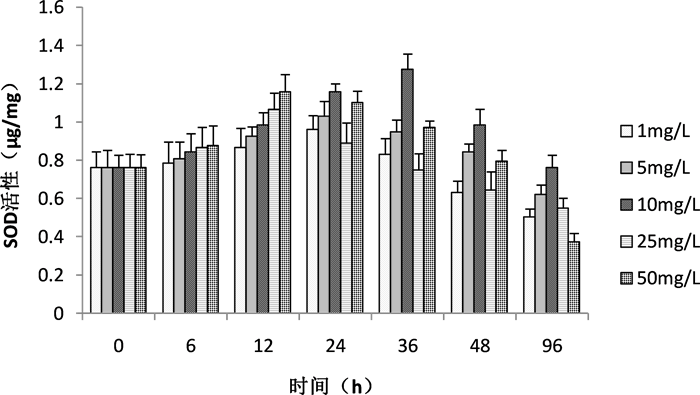
Figure 5. Effect of alginicide beads on SOD activity in Anabena flos-aquae
图5. 抑藻剂小球对水华鱼腥藻SOD活性的影响
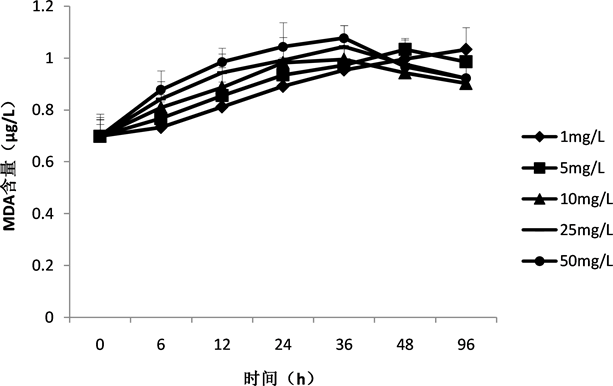
Figure 6. Effect of alginicide beads on MDA content in Anabena flos-aquae
图6. 抑藻剂小球对水华鱼腥藻MDA含量的影响

Figure 7. Effect of alginicide beads on Fv/Fm in Anabena flos-aquae
图7. 抑藻剂小球对水华鱼腥藻Fv/Fm的影响

Figure 8. Effect of alginicide beads on Yield in Anabena flos-aquae
图8. 抑藻剂小球对水华鱼腥藻Yield的影响

Figure 9. Effect of alginicide beads on ETRmax in Anabena flos-aquae
图9. 抑藻剂小球对水华鱼腥藻ETRmax的影响
从图中可以明显看出,随着抑藻剂小球剂量的增加和处理时间的延长,水华鱼腥藻的叶绿素荧光参数出现明显的下降趋势,具有显著的时间-剂量效应。培养96 h后,在1 mg/L剂量组,Fv/Fm、Yield、ETRmax比0 h分别降低了48% (P < 0.01)、29% (P < 0.01)、44% (P < 0.01);在50 mg/L剂量组,三种叶绿素荧光参数比0 h分别降低了83% (P < 0.01)、85% (P < 0.01)、78% (P < 0.01)。
4. 讨论
蓝藻是原核生物,藻细胞内没有叶绿体,但是有光系统I (PS I)、光系统II (PS II)及ATP合成酶等蛋白复合体,可以进行光合作用。研究表明,最常见的抑藻机理是通过破坏PS II,减少电子传递,影响藻类的光合作用,从而抑制藻类正常生理作用 [17] 。蓝藻中存在着藻胆蛋白,其包括藻红蛋白(PE)、藻蓝蛋白(PC)、藻红蓝蛋白(PEC)和异藻蓝蛋白(APC)。不同的藻胆蛋白组成藻胆体,成为光合作用中PS II的捕光色素系统,起到收集光能的作用,并将能量传递给叶绿素a [18] 。本研究数据表明,水华鱼腥藻经槲皮素–壳聚糖抑藻剂小球处理后,叶绿素a含量呈现出时间-剂量效应变化,50 mg/L剂量组的叶绿素a含量在96 h降低为0 h的83%;PC和APC的含量随着抑藻剂处理时间的延长和剂量的增加,相对缓慢上升;而PE没有出现明显的变化。说明经槲皮素–壳聚糖抑藻剂小球抑制了水华鱼腥藻叶绿素a的合成,藻胆蛋白含量构成发生混乱,PS II反应中心受到损伤。同时,水华鱼腥藻经抑藻剂小球处理后,叶绿素荧光参数Fv/Fm、Yield、ETRmax在50 mg/L剂量组,比0 h分别降低了83%、85%、78%。该数据也进一步证明了水华鱼腥藻PS II反应中心的电子传递受阻,光合量子产率下降,光合作用受到抑制。有研究人员表明,高浓度的大蒜水提液能阻遏铜绿微囊藻叶绿素a的合成,扰乱铜绿微囊藻中藻胆蛋白各组分的构成,降低藻细胞内光反应效率,抑制藻类的生长繁殖,致使其死亡 [16] 。另有研究发现,水生观赏植物红掌对铜绿微囊藻有生长抑制作用,藻细胞的叶绿素a含量下降,Fv/Fm、Yield降低;浓度为4.00 g∙L−1时,ETRmax几乎为0,表明铜绿微囊藻藻细胞PS II被严重破坏,光合作用被中止,导致藻类的死亡 [19] 。因此,槲皮素–壳聚糖抑藻剂小球抑制水华鱼腥藻生长的机理是通过抑制叶绿素a的合成,扰乱藻胆蛋白含量,破坏PS II反应中心,阻止光合作用的电子传递,使水华鱼腥藻光合作用效率降低,抑制了正常生长繁殖。
研究表明,连苯三酚会引起铜绿微囊藻的氧化损伤,细胞内部产生大量的ROS,抗氧化酶的活性大幅提高,随着浓度的增加,抗氧化酶的活性会随之降低 [15] 。本研究显示,水华鱼腥藻经槲皮素–壳聚糖抑藻剂小球培养后,高剂量组25 mg/L和50 mg/L,SOD的活性在12 h时比0 h增加了39% (P < 0.01)和53% (P < 0.01),在96 h时比0 h降低了28% (P < 0.5)和51% (P < 0.01)。SOD活性先开始出现上升趋势,说明水华鱼腥藻细胞内发生氧化损伤,藻细胞内启动防御机制。而随着培养时间的增加和剂量的增高,SOD的活性开始下降,说明华鱼腥藻产生的氧化损伤超出自身防御限值,防御系统出现损伤。丙二醛MDA含量是判断膜脂过氧化作用强弱的重要指标。槲皮素–壳聚糖抑藻剂小球处理水华鱼腥藻后,MDA含量随着处理时间的延长和剂量的增加呈现增长趋势,10 mg/L、25 mg/L、50 mg/L剂量组中,MDA含量在36 h比0 h增加了42% (P < 0.01)、49% (P < 0.01)、54% (P < 0.01)。进一步说明了水华鱼腥藻受到了极大的氧化损伤。
数据表明,香蒲叶浸提液处理水华鱼腥藻,低浓度时叶绿素a呈上升趋势;在50 g/L浓度下培养6 d后叶绿素a含量下降,在12 d时叶绿素a含量下降显著,但总体仍比正常时增加一倍;SOD活性在6 d后上升,但在12 d时开始下降,比正常时降低14% [20] 。黄酮类化合物处理阿氏浮丝藻,4 mg/L 5,4'-DHF处理5 d后,阿氏浮丝藻的rETRmax降低8%;4 mg/L木犀草素处理5 d后,rETRmax降低60%左右 [21] 。本研究中,50 mg/L剂量组,叶绿素a含量在96 h降低为0 h的83%;ETRmax在96 h比0 h降低了78%,说明光合作用被明显抑制。可以看出槲皮素–壳聚糖抑藻剂小球在短期内就能对水华鱼腥藻产生非常显著的生长抑制作用,是一种新型高效的抑藻剂。
5. 结论
1) 槲皮素–壳聚糖抑藻剂小球抑制水华鱼腥藻生长的机理是通过抑制叶绿素a的合成,扰乱藻胆蛋白含量,破坏PS II反应中心,阻止光合作用的电子传递,使水华鱼腥藻光合作用效率降低,抑制了正常生长繁殖。
2) 槲皮素–壳聚糖抑藻剂小球会对水华鱼腥藻造成极大的氧化损伤。
3) 槲皮素–壳聚糖抑藻剂小球是高效的新型抑藻剂,能有效抑制水华鱼腥藻的生长。
NOTES
*通讯作者。