1. 引言
虾夷马粪海胆原产于日本,1989年被引入中国,我国现已掌握室内人工育苗和海上养殖成商品胆技术,但海胆养殖中存在的病害问题尚较难解决。海胆隶属棘皮动物门,棘皮动物的免疫系统主要包括吞噬细胞、补体系统和转录因子等 [1],海胆在受到外源物刺激后机体发生的反应不存在特异性,其免疫应答的机制主要依靠体腔细胞和体腔液中的各种免疫因子 [2],因此对虾夷马粪海胆先天免疫分子水平的研究显得极其重要。先天免疫应答是通过病原性内源基序激活模式识别受体(pattern recognition receptors, PRR)而启动的。这些PRRs包括Toll样受体(Toll-Like receptors, TLRs)、NOD样受体(NOD-like receptors, NLRs)和RIG-I样受体(RIG-I-like receptors, RLRs) [3]。NLRs和TLRs可激活细胞内信号传导途径,引起机体先天免疫和炎症等效应机制 [4]。目前,虾夷马粪海胆NLR家族基因 [5] 和TLR家族基因 [6] 均有与先天免疫分子水平相关的研究,这些研究在一定程度上揭示了虾夷马粪海胆先天免疫机制,但并不十分完善。
TNFAIP3 (Tumor necrosis factor alpha-induced protein 3)基因又称A20基因,是一种具有泛素化和去泛素化双重功能的泛素编辑酶 [7]。TNFAIP3基因的特殊功能与其结构域密切相关,TNFAIP3基因编码的蛋白属于锌指蛋白家族,该家族蛋白具有1个OTU结构域和几个重复的ZnF-A20结构域 [8],N末端OTU结构域是去泛素酶 [9],它与其它去泛素酶家族一样有一个半胱氨酸蛋白酶催化三联体 [10],ZnF-A20结构域赋予TNFAIP3蛋白E3泛素连接酶活性 [11]。TNFAIP3的去泛素酶活性,可以从TRAF2/6和RIP1中拆卸Lys63连接的多泛素链;随后,Lys48连接的多泛素链取代被拆卸掉的泛素链,重新泛素化TRAF2/6和RIP1 [7] [12]。TNFAIP3通过干扰TRAF和RIP1的泛素化水平,继而干扰NF-κB信号通路,并对NF-κB信号通路起负调控作用 [13] [14],在机体的天然免疫过程具有非常重要的调控作用。我们在虾夷马粪海胆转录组测序数据 [15] 的基础上,发现了一个与免疫相关的基因SiTNFAIP3,采用RACE技术将筛选出的部分SiTNFAIP3基因片段进行克隆,扩增后获得一条SiTNFAIP3基因cDNA全长,通过qRT-PCR检测了该基因在虾夷马粪海胆各组织中的表达情况,利用5种不同病原物刺激海胆体腔细胞,分析了体腔细胞中SiTNFAIP3基因在刺激后的不同时间点的相对表达情况。分析讨论后推测该基因可能主要参与了虾夷马粪海胆的NLR信号通路,在先天免疫中发挥重要作用。
2. 材料与方法
2.1. 实验材料
虾夷马粪海胆购自大连市旅顺口区碧龙海珍品加工实业有限公司(平均质量40 g~80 g),实验处理前于大连海洋大学农业部北方海水增养殖重点实验室水族箱中适应一个月,海水温度16℃~23℃,全天持续供氧,根据水温及水质情况及时更换过滤海水,以新鲜海带为饲料,取样前一天停止投喂。
2.2. 实验方法
2.2.1. RNA提取及第一链cDNA合成
参照动物RNA提取试剂盒(天根)说明,提取虾夷马粪海胆组织总RNA,用核酸蛋白检测仪检测RNA浓度,用1%的琼脂糖凝胶检测RNA的完整性。参照第一链cDNA合成试剂盒(全式金)说明反转录合成第一链cDNA。
2.2.2. 基因克隆
根据虾夷马粪海胆转录组数据 [15] 中筛选到的SiTNFAIP3基因部分片断设计3’和5’的RACE引物(表1),以合成的第一链cDNA为模板,扩增TNFAIP3基因序列。反应体系为25 µL,其中2.5 µL LA PCR buffer (10×),2 µL dNTPs,2.5 µL UPM,0.5 µL特异引物,2 µL RACE模板,0.25 µL LA Taq酶,加ddH2O补至25 µL。使用降落PCR进行扩增:94℃预变性5 min;94℃ 30 sec,72℃ 3 min共5个循环;94℃ 30 sec,70℃ 30 sec,72℃ 3 min共5个循环;94℃ 30 sec,65℃ 30 sec,72℃ 3 min共25个循环;72℃ 10 min;4℃保存。1%的琼脂糖凝胶电泳检测并回收与目的基因大小一致的条带,将目的基因与pEASY-T1载体(全式金)相连,并转化到DH5α大肠杆菌感受态细胞(全式金),使用通用引物M13进行菌液PCR扩增,验证后挑选阳性克隆送至上海英骏生物技术有限公司进行测序。

Table 1. Primers and their sequences
表1. 引物名称及序列
2.2.3. SiTNFAIP3基因的生物信息学分析
将测序结果进行序列拼接得到SiTNFAIP3基因cDNA全长,利用NCBI的blastx (https://blast.ncbi.nlm.nih.gov/Blast.cgi)在线工具进行序列比对,确认为目标序列后,将得到的目标序列提交到NCBI的ORF Finder (https://www.ncbi.nlm.nih.gov/orffinder/)查找开放阅读框,在线工具ExPASy (https://www.expasy.org/resources)预测SiTNFAIP3蛋白分子量和等电点,通过NCBI的Protein BLAST (https://blast.ncbi.nlm.nih.gov/Blast.cgi)对所得氨基酸序列进行同源检索,使用MEGA7.0与其它物种进行序列相似性比对并构建系统进化树,用SMART (http://smart.embl-heidelberg.de/)在线工具对SiTNFAIP3蛋白的保守结构域进行预测分析,用Clustal X2对锌指结构域的序列进行比对,做聚类分析。
2.2.4. 组织差异表达分析
选取10只健康的海胆(雌、雄各5只),放入灭菌海水中快速剪下管足(GZ),用无菌注射器抽取虾夷马粪海胆体腔液(CL),4℃冷冻离心后弃上清,留体腔细胞沉淀,对海胆进行活体解剖,获取围口膜(WK)、肠道(GT)、精巢(TE)和卵巢(OV),将组织浸没于RNAlater (Thermofisher)中,于4℃冰箱中浸泡过夜,第二天转移至−80℃超低温冰箱中保存。总RNA提取与cDNA第一链合成参见2.2.1。
采用qRT-PCR检测SiTNFAIP3基因在各组织中的相对表达量,以虾夷马粪海胆18S rRNA为内参基因,每个样品重复3次。qRT-PCR采用20 µL体系:2 × SYBR Realting PCR Master Mix 10 µL,正反向引物rTNFAIP3-s、rTNFAIP3-a (表1)均为0.8 µL,cDNA模板2 µL,RNase free H2O 6 µL。扩增程序采用二步法:95℃ 30 sec预变性;95℃ 5 sec,60℃ 34 sec,40个循环。
2.2.5. 免疫刺激
采用直接注射的方式对150只健康虾夷马粪海胆进行免疫刺激,选取强壮弧菌Vibrio fortis (革兰氏阴性菌),脂多糖LPS、肽聚糖PGN、葡聚糖WGP、聚肌胞苷酸poly I: C为病原刺激物,磷酸缓冲液(PBS)作为对照组。强壮弧菌使用半致死量 [16] 进行注射,为防止虾夷马粪海胆死亡致实验数量不足,注射50只海胆。各免疫刺激物每组注射20只,免疫刺激物注射量依次为LPS:2 mg/只、PGN: 200 µg/mL、poly I: C:2 µg/mL、WGP: 600 µg/mL,PBS注射20只。在注射后6 h、12 h、24 h、48 h、72 h五个时间点进行取样,分别取体腔细胞、肠道、围口膜、精巢、卵巢浸没于RNAlater (Thermofisher)中,于4℃冰箱中浸泡过夜,第二天转移至−80℃超低温冰箱中保存。总RNA提取与cDNA第一链合成参见2.2.1。
免疫刺激后,使用qRT-PCR检测SiTNFAIP3基因在体腔细胞中的表达情况,方法同2.2.4。
采用2−ΔΔCt法计算SiTNFAIP3基因在虾夷马粪海胆各组织和在免疫刺激后体腔细胞中的相对表达量,用SPSS19.0 (P < 0.05)检验显著性。
3. 结果
3.1. SiTNFAIP3基因cDNA全长克隆及生物信息学分析
RACE扩增后获得的序列经BLAST比对分析发现,其氨基酸序列与紫海胆、棘冠海星、囊舌虫的相似度最高,分别为89%、89%、88%,确认该基因为虾夷马粪海胆的肿瘤坏死因子α诱导蛋白3 (Tumor necrosis factor alpha-induced protein 3, TNFAIP3)基因,因此命名为SiTNFAIP3。
SiTNFAIP3基因cDNA全长为3990 bp,5’-UTR为209 bp,开放阅读框为3567 bp,3’-UTR为214 bp,共编码1188个氨基酸。ExPASy预测分子量为131.969 KDa,等电点为8.30,为碱性蛋白。SMART结构域预测结果表明,SiTNFAIP3具有1个OTU结构域,8个ZnF-A20结构域(图1)。利用进化树分析物种间(表2)亲缘关系(图2),14个物种中所有脊椎动物聚为一支,所有无脊椎动物聚为一支,其中虾夷马粪海胆与紫海胆单独聚为一支,表明它们亲缘关系最近。Clustal X2对不同物种(表2) ZnF-A20结构域的比对和聚类(图3,图4)显示,所有物种TNFAIP3的蛋白结构域均具有1个OTU结构域和若干ZnF-A20结构域,各物种的OTU结构域高度保守,而不同物种的ZnF-A20结构域的数量和种类存在差异。

Figure 1. cDNA and amino acid sequences of SiTNFAIP3. Note: OTU domain is indicated by shaded box and ZnF-A20 domain is indicated by box
图1. 虾夷马粪海胆TNFAIP3基因cDNA序列和氨基酸序列。注:OTU结构域用阴影方框标识,ZnF-A20结构域用方框标识
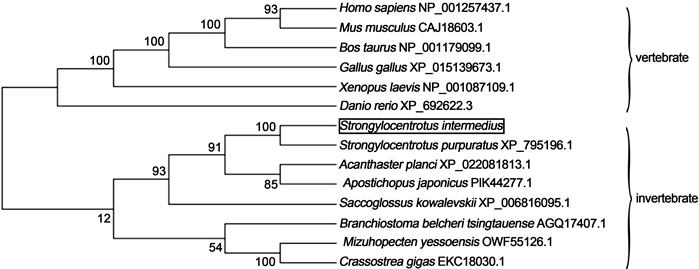
Figure 2. Phylogenetic tree based on amino acid sequences of TNFAIP3 protein (vertebrate refers to vertebrates, invertebrate refers to invertebrates)
图2. 基于TNFAIP3蛋白氨基酸序列构建的系统发育进化树(vertebrate为脊椎动物,invertebrate为无脊椎动物)
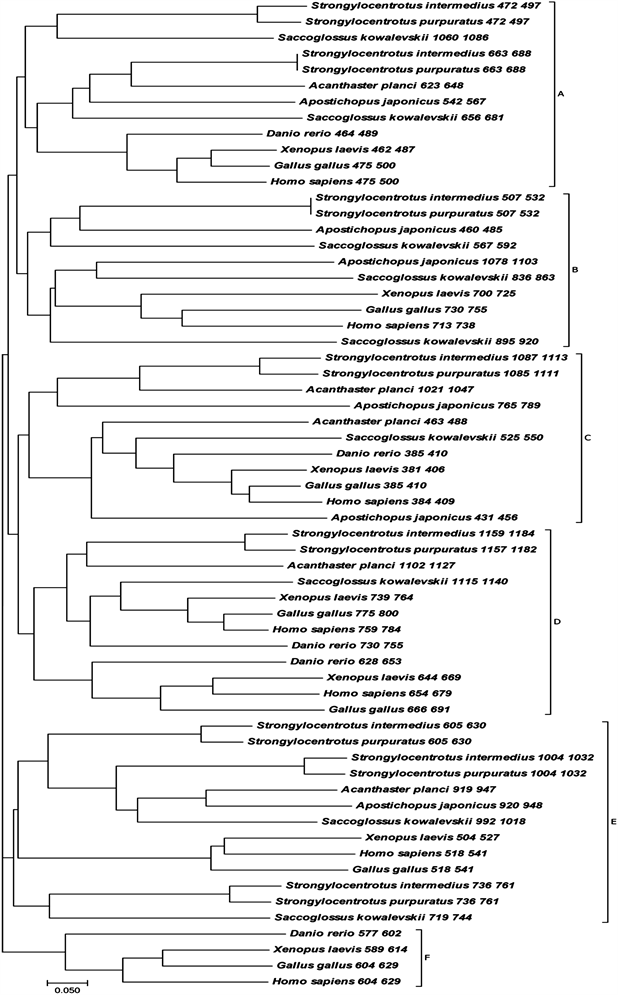
Figure 3. Phylogenetic tree based on ZnF-A20 domains of TNFAIP3 protein (Scale represents genetic distance, A - F represents 6 different ZnF-A20 domains)
图3. 基于TNFAIP3蛋白ZnF-A20结构域的进化树分析(标尺表示遗传距离,A~F代表6种不同的ZnF-A20结构域)

Table 2. NCBI receiver number of species TNFAIP3 protein used in evolutionary analysis
表2. 进化分析使用的物种TNFAIP3蛋白的NCBI接收号
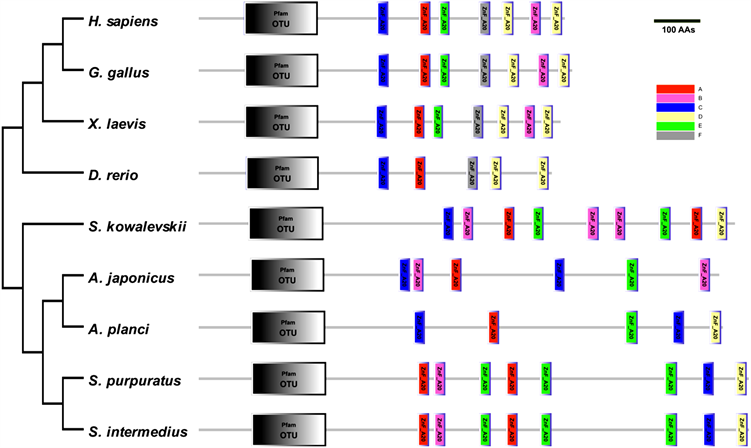
Figure 4. Comparison of protein domain results based on TNFAIP3 amino acid sequence prediction (A - F annotate the clustering results based on ZnF-A20 comparison in Figure 3, scale bar represents 100 amino acids)
图4. 基于TNFAIP3氨基酸序列预测的蛋白结构域结果比较(A~F根据图3中ZnF-A20比对聚类结果标注,标尺为100个氨基酸长度)
3.2. 组织差异表达分析
采用qRT-PCR检测SiTNFAIP3基因在健康虾夷马粪海胆各组织中的表达情况(图5)。实验结果表明,SiTNFAIP3基因在检测的各组织中均有表达,卵巢中的表达量显著高于其它组织(P < 0.05),相对表达量为36.779,其次是体腔细胞和管足,表达量最低的组织为精巢,仅为0.778。

Figure 5. Expression of SiTNFAIP3 gene in different tissues from normal Strongylocentrotus intermedius. Note: GT, CL, WK, GZ, TE and OV denote Intestine, coelomocyte, peristomial membrane, Tube feet, Testis and Ovary, respectively. Duncan’s multiple comparisons were carried out and “a, b, c” indicated significant differences between samples (p < 0.05)
图5. SiTNFAIP3基因在健康虾夷马粪海胆不同组织中的表达情况。注:GT, CL, WK, GZ, TE和OV分别代表肠,体腔细胞,围口膜,管足,精巢和卵巢;使用Duncan法进行多重比较,字母a、b、c...不同表示差异显著(p < 0.05)
3.3. 免疫刺激后SiTNFAIP3基因的相对表达量分析
qRT-PCR结果表明,经LPS刺激后(如图6(a)),SiTNFAIP3基因的表达量在12 h~24 h出现上调,12 h的表达量最高,24 h开始下降。PGN刺激后(如图6(b)),SiTNFAIP3基因在12 h表达量最高,表达量较
0 h增加了6倍,12 h后开始下降,免疫刺激后5个时间点的表达量全部高于0 h。poly I: C刺激后(如图6(c)),SiTNFAIP3基因表达量在6 h~24 h呈上升趋势,12 h出现表达量最高峰,48 h下降到正常水平。WGP刺激后(如图6(d)),SiTNFAIP3基因出现表达下调的情况,48 h表达量最低。强壮弧菌刺激后(如图6(e)),6 h时出现表达上调,但是较0 h变化量很小,12 h出现表达量最高的峰值,表达量较0 h增加了6.5倍。体腔细胞中SiTNFAIP3在除WGP外的4种病原物处理后均出现表达上调,且经PGN、强壮弧菌处理后12 h显著高于其它时间点,PGN刺激后12 h的表达量为6.996,高于强壮弧菌刺激后12 h的表达量;而LPS、poly I: C刺激后,体腔液中SiTNFAIP3表达变化较小,仅在12 h略有升高。
4. 讨论
本实验克隆了虾夷马粪海胆TNFAIP3基因cDNA全长,发现该基因编码的蛋白质含有1个OTU结构域和8个重复的ZnF-A20结构域,这与其它物种TNFAIP3蛋白结构域非常相似。经比对分析可以看到TNFAIP3具有非常高的保守性(图2~4)。所有物种的TNFAIP3都具有1个OTU结构域和5~8个ZnF-A20结构域,这些ZnF-A20结构域在物种内和物种间都非常相似,尤其是都具有四个半胱氨酸。脊椎动物和无脊椎动物ZnF-A20结构域的数量和种类均存在差异,脊椎动物的ZnF-A20结构域相对无脊椎动物排布更加紧密,种类更加多样化,此外,在高等的脊椎动物中ZnF-A20结构域在TNFAIP3蛋白中的排列模式更趋向于保守,而在无脊椎动物中则表现出了多样化的特点。这可能与先天性免疫在高等的脊椎动物和低等的无脊椎动物中的不同进化地位有关。
SiTNFAIP3基因在健康虾夷马粪海胆6种组织中均有表达,精巢的表达量最低,卵巢中的表达量最高。卵巢是海胆繁殖的重要器官,取样时海胆正处于性腺发育成熟时期,TNFAIP3作为重要的免疫基因,在B细胞、T细胞等免疫细胞中表达 [17],推测卵巢中SiTNFAIP3的高表达量可能和保护卵细胞有较大关系。
LPS是细菌内毒素的主要成分,当细菌入侵时作为抗原分子参与TLR信号通路,LPS可以诱导TNF-α参与的免疫过程,通过激活IL-8、趋化因子、抗菌肽等免疫作用,直接清除入侵的病原体,引起机体的免疫反应 [17] [18] [19]。经LPS刺激后体腔细胞中SiTNFAIP3表达呈轻微上调,推测SiTNFAIP3抑制了TLR信号通路,在TLR信号通路中起负调控的作用。最近的研究也证明了这一推测,LPS刺激虹鳟鱼的巨噬细胞后,TNFAIP3基因在6 h~24 h出现表达上调 [20],说明LPS刺激可以提高机体免疫力。LPS刺激河豚鱼后,TNFAIP3基因的表达量在12 h后增加 [21]。PGN是NLR信号通路中NOD2的反应底物,可作为NOD1和NOD2的主要模式识别受体,当NOD1和NOD2配体识别PGN后通过细胞凋亡抑制剂激活RIP2,随后激活促炎症NF-κB信号通路 [22]。经PGN刺激后,虾夷马粪海胆体腔细胞中SiTNFAIP3表达量显著升高,推测SiTNFAIP3基因的高表达量可能是在NOD蛋白识别PGN后,作为细胞凋亡抑制剂抑制NF-κB信号通路,使机体产生免疫反应,清除易对自身造成伤害的物质,达到保护自身健康的目的。poly I:C作为一种模拟RNA病毒的免疫抑制剂刺激体腔细胞,经poly I:C刺激后,体腔细胞中SiTNFAIP3基因在12 h~24 h呈轻微表达上调,表明poly I:C可以诱导SiTNFAIP3基因的表达,我们推测这是SiTNFAIP3对由poly I: C引起的RLR信号通路中炎症反应的负调节作用。Li等证明TNFAIP3 在poly I: C触发的肝脏炎症中发挥保护作用 [23],在人角质细胞中,TNFAIP3 显著抑制了poly I: C诱导的细胞因子的产生,这种作用与NF-κB信号传导的抑制有关,表明TNFAIP3的下调增加了角质形成细胞对外部刺激的易感性 [24]。WGP存在于真菌中,目前WGP作为一种免疫活性增强剂已被广泛应用于水产动物中 [25]。图6中WGP刺激后诱导SiTNFAIP3表达下调,说明SiTNFAIP3基因对WGP无免疫应答,SiTNFAIP3基因不参与由真菌引起的免疫应答的CLR信号通路的调控。强壮弧菌是虾夷马粪海胆的条件致病菌,强壮弧菌刺激海胆体腔细胞后,在12 h SiTNFAIP3基因表达量最高,证明SiTNFAIP3基因对强壮弧菌有免疫应答,由此推测SiTNFAIP3基因参与了由强壮弧菌引起的免疫信号通路的调控,说明SiTNFAIP3基因在先天免疫信号通路中具有调控作用。
本实验克隆获得了SiTNFAIP3基因cDNA全长,生物信息学分析表明该基因编码的蛋白属于锌指蛋白家族,是一个具有泛素化和去泛素化双重编辑作用的酶。实时定量结果表明,SiTNFAIP3在健康海胆的卵巢中表达量最高,免疫刺激后体腔细胞中SiTNFAIP3的不同相对表达量表明,SiTNFAIP3基因参与了虾夷马粪海胆的TLR、NLR、RLR信号通路的负调控,经PGN刺激后,SiTNFAIP3的表达量最高,推测该基因在NLR信号通路的负调控作用强于其它信号通路,即SiTNFAIP3主要参与了NLR信号通路的负调控,在虾夷马粪海胆先天免疫中发挥了重要作用。
基金项目
国家自然科学基金“海胆天然免疫分子NLR家族的免疫应答机制研究”(31101923),辽宁省自然科学基金“海胆抗菌肽的基因克隆、表达特征分析及原核表达”(2015020761),农业部北方海水增养殖重点实验室开放课题(2014-MSENC-KF-08)。
NOTES
*通讯作者。