1. 引言
萜类物质(terpenoids)是广泛分布于生物界的一类天然产物,无论是单萜、倍半萜、双萜还是三萜四萜,都在生物体内起着极其重要的作用,参与形成酯类、防御毒剂、生长激素等。烟草的重要次生代谢途径之一是萜类分子的代谢。萜类物质一般由若干个异戊二烯单位构成,根据其数目的多少可分为单萜、倍半萜、双萜、三萜、四萜、多萜等不同的类型分子。其中三萜、四萜分子往往是初生代谢产物,这包括类胡萝卜素、赤霉素、脱落酸、叶绿素、甾醇等,为烟草生长发育所必需;而单萜、倍半萜、双萜则是次生代谢产物,它们是烟叶挥发物和烟草腺体分泌物的主要组成成分,与烟叶的抗性和香气品质密切相关 [1] [2] [3] [4] ,这也表明增加低分子量的萜类分子的含量将有助于提高烟叶的香味。要实现这一目的,提高其前体异戊烯基焦磷酸(IPP)的含量是十分必要的。IPP是由质体中的DXPS途径形成的,并参与单萜、双萜、四萜生物的合成。因此利用基因工程手段提高烟叶香气可以考虑对DXPS途径进行分子调控。1-脱氧木酮糖-5-磷酸合成酶((1-deoxyxylulose-5-phosphate synthase)DXS)参与该途径的第一个催化步骤,催化丙酮酸与甘油醛-3-磷酸合成脱氧木酮糖-5-磷酸。DXS也是该途径的重要限速酶之一,其过量表达会在宏观上增加低分子量萜类分子的含量,可使得这些与香气密切相关的物质在烟叶中过量积累,进而提升烟叶的香气,同时烟草原有风味也得到了保证。
在烤烟制作过程中使用了降焦工艺,烟气中香气也被降低,这一定程度上影响到香烟的品质。目前在实际生产中多通过杂交选育新品种、优化栽培条件等措施提高烟叶香气量,而利用基因工程手段改良烟叶香气将为烟草业的发展提供一个崭新的途径。目前转化DXS基因的转基因烟草在国内外尚未见报道。本研究拟克隆烟草DXS基因的全长序列,并研究其组织表达特异性,为通过基因工程途径改良烟叶香气品质奠定基础。
2. 材料和方法
2.1. 材料
实验材料为中烟90,该烟草品种是中国农科院烟草研究所通过三亲杂交,定向培育的烤烟新品种。
2.2. 主要试剂
Trizol (Invitrogen, USA), SMARTTM RACE cDNA Amplification Kit (BD Bioscience Clontech Company, USA), SMARTTM PCR cDNA Synthesis Kit (BD Bioscience Clontech Company, USA), pGEM-T Vector (Promega, USA);其它常规试剂均为国产分析纯。
2.3. 总RNA的提取及RACE-Ready cDNA的合成
利用Trizol法提取烟草叶片总RNA,用SMARTTM RACE cDNA Amplification Kit分别合成5′ RACE-Ready cDNA和3′ RACE-Ready cDNA。合成前者的反应体系为10 μL,含有1 μL的5′-RACE CDS Primer A,1 μL的BD SMART IITM A Oligonucleotide,1 μL总RNA(1 μg/μL),2 μL去离子水,2 μL的5×First-Strand Buffer,1 μL的20 mmol/L二硫苏糖醇(DTT),1 μL的10 mmol/L dNTP Mix和1 μL BD PowerScript反转录酶。3′cDNA合成的反应体系为10 μL,含有1 μL的3′-RACE CDS Primer A,1 μL总RNA(1 μg/μL),3 μL的去离子水,2 μL的5 × First-Strand Buffer,1 μL的20 mmol/L DTT,1 μL的10 mmol/L dNTP Mix和1 μL BD PowerScript反转录酶。将反应体系在42℃温育1.5 hr以保证cDNA第一链的合成反应完成。再用Tricine-EDTA缓冲液把反应体系稀释10倍待用。
2.4. 快速扩增cDNA末端(5′和3′ RACE)
根据烟草的1-脱氧木酮糖-5-磷酸合成酶(DXS)基因核心序列(登录号:AJ291721),利用Primer3在线工具(http://frodo.wi.mit.edu/primer3/)设计基因特异性引物GSP1和GSP2。GSP1: 5′-GCGTCGGACCATCTGCTCCAACAAGA-3′;GSP2:5′-CGCTATGGGTGGTGGGACCGGTATGA-3′。
扩增5′cDNA末端的反应总体积为15 μL,其中含有10.6 μL ddH2O,1.5 μL 10 × BD Advantage 2 PCR Buffer,0.3 μL的10 mmol/L dNTP Mix,0.2 μL的50 × BD Advantage 2 Polymerase Mix,0.6 μL的5′RACE- Ready cDNA,0.6 μL的10 × UPM,0.3 μL的10 μmol/L GSP1。扩增3′cDNA末端的反应体系为15 μL,含有10.6 μL ddH2O,1.5 μL的10 × BD Advantage 2 PCR Buffer,0.3 μL的10 mmol/L dNTP Mix,0.2 μL的50 × BD Advantage 2 Polymerase Mix,0.6 μL的3′RACE- Ready cDNA,0.6 μL的10 × UPM,0.3 μL的10 μmol/L GSP2。使用Touchdown PCR反应程序:94℃预变性3 min;94℃变性30 s,72℃ 3 min,进行5轮循环;接着94℃ 30 s,70℃ 30 s,72℃ 3 min,循环5轮;94℃ 30 s,68℃ 30 s,72℃ 3 min,共28轮循环;72℃延伸10 min。扩增产物在1.0%的琼脂糖凝胶上电泳分开,根据分子量标准判断并回收目的DNA片段,连入pGEM-T vector,转化大肠杆菌DH5α感受态细胞,筛选重组子并测序。对来源于5'和3' RACE的扩增产物分别测4个以上的克隆,通过比较测序结果消除因PCR反应可能出现的错配碱基。
2.5. DXS cDNA及其编码的氨基酸序列的分析
使用DNAtools 6软件进行核苷酸序列的翻译。使用Clustal X v1.8 [5] 软件进行氨基酸序列的比对分析。蛋白质理论等电点和分子量使用Compute pI/MW在线工具(http://us.expasy.org/tools/pi_tool.html)进行预测。蛋白质前体的信号肽使用SignalP 3.0 Server在线工具(http://www.cbs.dtu.dk/services/SignalP)进行预测。分子系统树使用ClustalX v1.8软件中的N–J选项(自举检验次数=1000)进行构建 [6] 。此外蛋白质序列中可能存在的磷酸化位点使用NetPhos 2.0 server (http://www.cbs.dtu.dk/services/NetPhos/)进行预测 [7] 。
2.6. DXS基因的组织表达特异性检测
利用Trizol法提取烟草幼茎、叶片、根尖和花朵的总RNA。按文献 [8] 的方法进行Northern 转膜和杂交。将各样品的总RNA(20 μg)在1.5%(w/v)的变性琼脂糖胶上电泳分开,转到硝酸纤维素膜上,以α-[32P]dCTP标记的5′cDNA片段为探针,进行分子杂交。杂交条件为65℃ 16 hr;洗膜条件:用1 × SSC,0.2%(w/v)SDS于65℃洗15 min,再用0.5 × SSC,0.1% (w/v) SDS于65℃洗15 min;将洗好的膜与X光片夹于增感屏中,置于−20℃曝光7 d。
3. 结果与分析
3.1. 烟草1-脱氧木酮糖-5-磷酸合成酶(DXS)基因cDNA的克隆
通过SMART-RACE扩增到DXS基因的5′cDNA片段和3′cDNA片段见图1,大小分别约为1.9 Kb和1.2 Kb。测序后经拼接获得了DXS基因的全长cDNA序列。
3.2. 由cDNA预测的蛋白质序列分析
该cDNA序列全长为2386 bp,所含的开放阅读框(ORF)编码718个氨基酸残基(图2)。在cDNA的3'末端有28个脱氧核苷酸组成的poly (A)。该cDNA全长序列已被登录到GenBank数据库(GenBank accession number: CBA12009)。
经预测,该蛋白序列中潜在的磷酸化位点可能有19个丝氨酸、11个苏氨酸和10个酪氨酸的磷酸化位点,它们分别是第24、51、57、59、87、107、159、174、176、248、269、273、315、346、392、549、634、645和683位的丝氨酸残基,第71、102、132、152、160、171、219、316、349、359和570位的苏氨酸残基,第64、65、128、178、224、232、305、375、553和678位的酪氨酸残基。这些位点的磷酸化可能对于酶分子空间构象的维持及行使其正常功能是必需的。预测表明该蛋白序列中不存在跨膜结构域,而其理论等电点和分子量分别为7.31和77.413 kDa。
将烟草的DXS与其它植物的DXS的氨基酸序列进行同源性比较,结果显示烟草的DXS与辣椒的
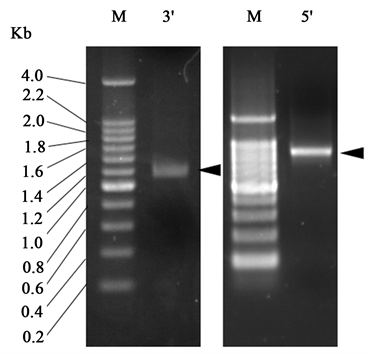
Figure 1. Amplification of a DXS gene from N. tabacum with RACE. M: 200 bp Ladder
图1. 利用RACE克隆烟草DXS基因。M:DNA分子量标准
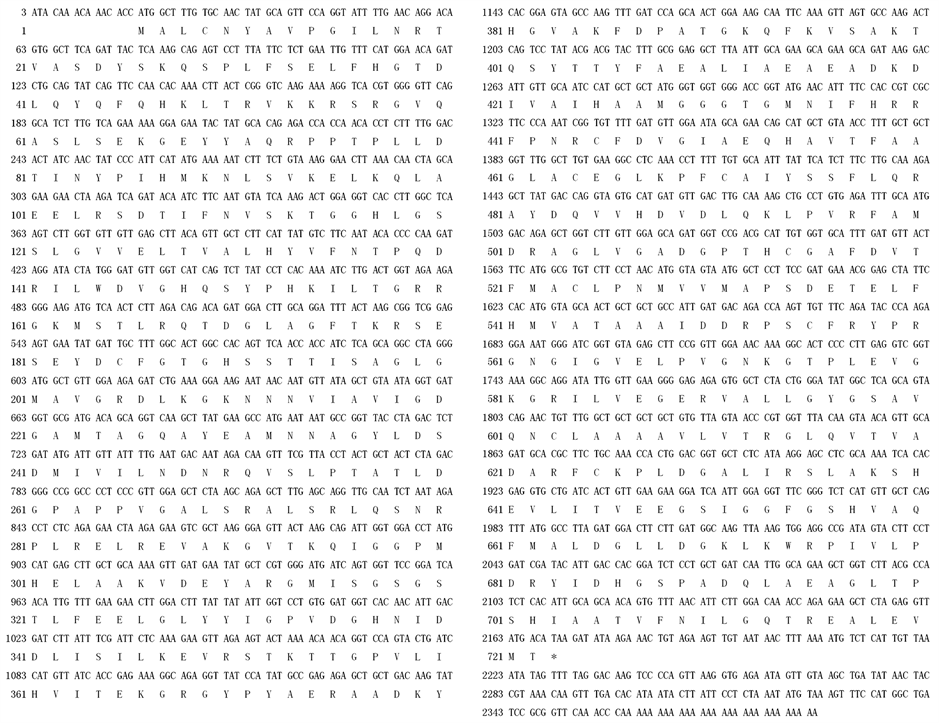
Figure 2. Nucleotide and the deduced amino acid sequence of DXS cDNA from N. tabacum
图2. 烟草DXS基因的cDNA序列及推导的氨基酸序列
DXS (登录号:O78328)的相似性最高,氨基酸同源性达96%;其次是番茄的DXS(登录号:AAD38941),达95% (图3)。
根据同源序列分析烟草DXS与其它9种植物的DXS的进化关系。从进化树(图4)可以看出,来自植物的10个DXS可分为3大类,其中烟草的DXS与4种植物的DXS属于同一大类,而在这一大类中,烟草与辣椒,番茄的DXS关系最密切,它们形成一个独立的分支,暗示了它们可能由一个共同的祖先进化而来 [8] [9] [10] ,在长期的进化过程中相当保守。系统分析结果还表明,植物的DXS基因及其编码的蛋白质在进化过程中发生了重大分化。
3.3. 对DXS基因表达的Northern印迹杂交分析
通过Northern印迹杂交检测了DXS基因在烟草的根、茎、叶和花器官中的表达水平(图5)。从图5可以看出,在叶片中,DXS基因的表达水平最高,其次是在幼茎中,而在根和花器官中该基因的表达水平很低,仅检测到微弱的杂交信号。
4. 讨论
目前,植物萜类物质在其生存和生长发育过程中的重要作用,以及对疾病治疗和保健方面的有效性逐渐为人们所认识。萜类物质是通过异戊二烯代谢途径合成的,首个关键酶DXS的研究虽仅有10余年

Figure 3. Deduced amino acid sequence and homology of N. tabacum DXS. Shown is the homology of the deduced DXS (CBA12009) with the other two DXSs: Capsicum annuum DXS (O78328) and Solanum lycopersicum DXS (AAD38941). Identical amino acids are indicated by asterisks and conservative substitutions by dots
图3. 烟草DXS的氨基酸同源性序列比对分析。图中显示的是烟草的DXS (CBA12009)与辣椒的DXS (O78328)以及番茄的DXS (AAD38941)序列比对结果。其中完全保守的氨基酸用星号标识,较保守的氨基酸用双点标识,而一般保守的氨基酸用单点标识

Figure 4. Phylogenetic tree of N. tabacum DXS with other plant DXS sequences constructed by the neighbor-joining method. Sequences used: Nitab: N. tabacum, GenBank accession number: CBA12009; Caann: C. annuum, O78328; Solyc: S. lycopersicum, AAD38941; Samil: Salvia miltiorrhiza, ACF21004; Arann: Artemisia annua, AAD56390; Metru: Medicago truncatula, CAD22530; Pumon: Pueraria montana, AAQ84169; Glmax: Glycine max, ACO72582; Ricom: Ricinus communis, EEF45457; Elgui: Ricinus communis, EEF45457. The tree was constructed with the highly conserved region of N. tabacum DXS. The bootstrap values with 1000 trials are shown on branches. The scale bar represents 0.01 nucleotide substitutions every site. The name is composed of a species abbreviation (the first two letters of the genus plus the first three letters of the specific name)
图4. 使用邻接法构建的包含烟草的DXS与其它9种植物的DXS的进化树关系图。Nitab:烟草,GenBank登录号:CBA12009;Caann:辣椒,O78328;Solyc:番茄,AAD38941;Samil:红参,ACF21004;Arann:黄花蒿,AAD56390;Metru:苜蓿,CAD22530;Pumon:山葛,AAQ84169;Glmax:大豆,ACO72582;Ricom:蓖麻,EEF45457;Elgui:油棕,EEF45457。1000次的自举检验置信度值标于分支线上。比例尺代表每位点0.01个核苷酸的替换。名称用属名的前两个字母加上种名的前三个字母表示

Figure 5. Detection of DXS gene expression by Northern blot hybridization, using the RNA samples extracted from the indicated tissues of N. tabacum, respectively. S: stem; R: root; L: leaf; F: flower. Total RNA acts as inner reference. The italic words “DXS” represent probes used in the hybridization experiment. “28S” and “18S” represent “28S rRNA” and “18S rRNA” from total RNA are indicated
图5. Northern blot杂交分析。探针为5′末端的cDNA片段;L、S、F和R分别代表烟草的叶、茎、花和根。以每个泳道中的rRNA作为内参。斜体“DXS”代表用于杂交中的基因探针。“28S”和“28S”分别代表总RNA中的“28S rRNA”和“18S rRNA”
历史,但已经取得了令人瞩目的成就 [11] 。
在异戊二烯代谢途径中,3-羟基-3-甲基戊二酰辅酶A还原酶(HMGR)是关键酶,而1-脱氧木酮酸-5-磷酸酯合成酶(DXS)、5-磷酸脱氧木酮糖还原异构酶(DXR)均为萜类分子代谢途径中的限速酶。如Chappell等曾报道烟草倍半萜化合物会因为HMGR受到抑制而明显减少 [12] 。利用CaMV 35S启动子驱动薄荷的DXR基因并导入薄荷中,转基因植株的薄荷精油的含量会显著提高,甚至可达50% [13] [14] 。
我们知道烟叶香气是衡量其质量的重要因素之一,但是烟草中香味成分复杂且繁多,而且含量较低,如果增加单一物质的含量并不能显著提高香味,而且有可能导致香气组分发生改变,使得烟叶香气发生质的改变。鉴于此,要通过遗传修饰的方式改良烟草香味,需要考虑把HMGR、DXS和DXR等基因同时进行转移,筛选出香味浓郁的转基因植株,实现对多酚类化合物合成关键基因表达的人为调控,从整体上来影响烟叶类黄酮化合物的含量,增加烟叶的香气量。
烟草的DXR和HMGR基因全长cDNA序列(登录号分别为:DQ839130和U60452)已获得。本研究通过RACE技术成功获得了烟草DXS基因的全长cDNA序列,并通过Northern印迹杂交证实了烟草DXS基因在绿色组织主要在叶片中高水平表达,为研究该基因的功能及通过转基因方式调控其表达,及进一步改良烟草香气品质打下了良好基础。
基金项目
湖北省教育厅重点项目(D20091007)和湖北省科技厅基金项目面上项目(2010CDB04504)。
NOTES
*通讯作者。