1. 引言
胃癌是一种常见的恶性肿瘤疾病,严重影响患者的生命健康。在我国,胃癌的发病率和死亡率都较高,而且近年来,其发病时间有年轻化趋势 [1]。胃癌的侵袭性较高,且发病多比较隐匿,很多患者在初次确诊时已经发现远处转移,错过了手术治疗的最佳时机,是胃癌患者高死亡率的主要原因 [2] [3]。外科手术是目前最有效的胃癌治疗策略,随着医学技术的发展,胃癌的诊断和治疗有所改善,但是患者的预后仍较差,尤其是有远处转移的患者 [4] [5]。因此,研究更多有效的肿瘤防治手段,改善患者预后状况,对于提高胃癌患者的生存率及术后疗效意义重大。
MicroRNA (miRNA)是一类由内源基因编码的长度约为22个核苷酸的非编码单链RNA分子 [6] [7]。大量研究已经证实 [8],许多miRNA通过调控原癌或抑癌基因的表达,对肿瘤细胞的生物学行为进行调控。miRNA的异常表达与多种人类恶性肿瘤的发生、发展密切相关 [9]。近来有研究表明,miR-1294在食管鳞状细胞癌、卵巢癌、胶质瘤等肿瘤中存在差异性表达现象 [10] [11] [12]。同时,Shi等人 [13] 研究报道称,miR-1294在胃癌细胞中的表达水平显著降低,但目前对其与临床意义及对生物学功能的相关研究甚少。
本研究通过分析比较miR-1294在胃癌组织及癌旁组织中的表达情况及其对胃癌细胞生命活动的影响,旨在探讨miR-1294表达的预后价值及其在肿瘤进展中的生物学功能。
2. 材料与方法
2.1. 一般资料
收集2006年10月至2010年10月在福州市第一医院收治的121例胃癌患者的肿瘤组织及癌旁正常组织的标本。根据UICC的临床标准,所有标本均取得至少2名病理学专家明确的病理诊断。所有患者术前均未接受其他抗癌治疗,且临床资料完整。本研究经福州市第一医院伦理委员会的批准,所有患者均知情同意。对患者进行为期5年的术后随访,记录患者的生存情况及临床病理学资料。
2.2. 细胞培养与转染
人胃癌细胞系(SGC-7901,MGC-803,HGC-27,AGS)和正常胃粘膜细胞系(GES-1)购于中国上海细胞研究所。细胞系用含有10%胎牛血清的RPMI1640培养基培养,在37℃,5% CO2培养箱中进行。细胞培养至对数生长期后,进行细胞转染实验。转染载体为:miR-1294 mimic (miR-1294模拟物)和miR-1294 inhibitor (miR-1294抑制物)以及对应的阴性对照(mimic NC和inhibitor NC)。细胞转染实验使用Lipofectamine 2000 (Invitrogen,美国)完成。
2.3. RNA提取及实时荧光定量PCR (qRT-PCR)
使用TRIzol试剂(Invitrogen,美国)对胃癌组织和细胞中的总RNA进行提取,使用反转录试剂盒(TaKaRa,美国)将RNA反转录成单链cDNA,并保存于−20℃备用。以U6为内参,使用qRT-PCR检测组织和细胞中miR-1294的表达量,采用SYBR Premix Ex TaqTM试剂盒(购自美国Biosystems公司)以及Applied Biosystems 7500 Sequence检测系统进行分析检测。PCR反应条件为:94℃预变性5 min,然后94℃变性40 s,60℃退火1 min,72℃延伸10 min,进行40个循环。反应结束后,使用2−ΔΔCt方法对miR-1294的相对表达量进行计算。引物序列如下:miR-1294 forward, 5’-TGTGAGGTTGGCATTGTTGTCTGT-3’, reverse, 5’-GTGCAGGGTCCGAGGTATTC-3’; U6 forward, 5’-GCTTCGGCAGCACATATACT-3’, reverse, 5’-GTGCAGGGTCCGAGGTATTC-3’。
2.4. MTT法检测细胞增殖能力
将对数生长期的各组细胞接种于96孔细胞培养板,使细胞浓度为5 × 103/mL,放置于37℃,5% CO2培养箱中培养3天,每24 h向培养孔中加入20 μL MTT溶液(浓度为5 g/L),并继续培养4 h。培养结束后,吸出上清液,向每孔再加入150 μl DMSO,水平震荡10分钟,避光下进行。最后使用酶标仪检测培养物在490 mm处的吸光度值,用来评估细胞的增殖能力。
2.5. Transwell方法检测细胞转移和侵袭能力
使用Transwell法检测胃癌细胞的迁移和侵袭能力。在细胞迁移实验中,将细胞接种于Transwell上室,而细胞侵袭实验则是将细胞接种于预先包被基质胶的Transwell上室。上室均使用无血清培养基填充,下室使用含有10%血清的培养基填充。接种稳定转染的细胞(细胞密度为2 × 105/mL)于上室,并置于37℃,5% CO2培养箱,经过48 h孵育后,将下室中的细胞进行甲醇固定,结晶紫染色,显微镜下计数细胞量,评估细胞的转移和侵袭能力。
2.6. 统计学分析
使用SPSS 19.0和GraphPad Prism 5.0软件进行数据处理。使用Student’s t test或方差分析对组间差异进行比较。miR-1294表达量与患者临床病理特征之间的关系使用卡方检验分析,Kaplan-Meier法和log-rank检验对患者的生存率进行分析。多因素Cox回归分析对miR-1294在胃癌中的预后价值进行评估。P < 0.05表示差异具有统计学意义。
3. 结果
3.1. miR-1294在胃癌组织和细胞中的表达水平
通过qRT-PCR对胃癌组织和细胞中miR-1294的表达水平分别进行检测,结果显示,miR-1294在胃癌组织中的表达水平显著低于癌旁正常组织,且差异显著(P < 0.001,图1(A))。此外,所检测四种胃癌细胞系中的miR-1294的表达水平均显著低于正常胃粘膜细胞系(P < 0.001,图1(B))。
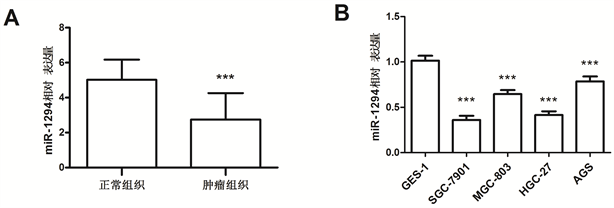
Figure 1. Relative expression of miR-1294 in gastric cancer tissues and cells (***P < 0.001)
图1. miR-1294在胃癌组织和细胞中的相对表达量(***P < 0.001)
3.2. miR-1294表达量与癌症患者临床病理特征之间的关系
进一步对miR-1294表达量与胃癌患者临床病理特征之间的关系进行了分析。根据患者胃癌组织中miR-1294的平均表达量进行了分组:miR-1294高表达组(n = 52)和miR-1294低表达组(n = 69)。结果显示,miR-1294表达量与TNM分期、肿瘤组织分化程度及淋巴结转移均显著相关(P < 0.05),而与患者年龄和性别无显著相关性(P > 0.05),见表1。


Table 1. Relationship between miR-1294 expression and clinicopathological features of gastric cancer patients
表1. miR-1294表达量与胃癌患者临床病理特征的关系
注:*P < 0.05。
3.3. miR-1294在癌症患者中的预后价值
对121名胃癌患者进行术后5年随访,并根据其生存情况及miR-1294的表达量绘制生存曲线(图2),发现miR-1294低表达的胃癌患者较高表达患者总体生存率更差,且该差异具有统计学意义(log-rank P < 0.01)。
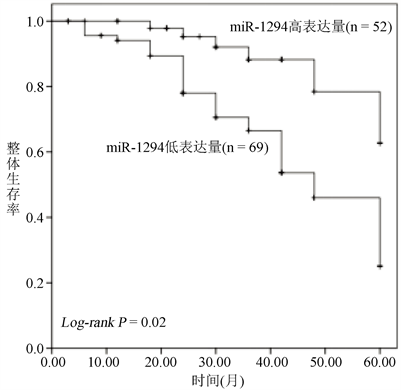
Figure 2. Kaplan-Meier survival curves for gastric cancer patients with different miR-1294 expression
图2. 不同miR-1294表达量的胃癌患者的Kaplan-Meier生存曲线
本研究进一步进行了多因素Cox回归分析,探讨miR-1294及其他临床病理特征指标对胃癌患者生存率的独立影响。结果显示,miR-1294是胃癌的独立预后因子(表2)。
3.4. miR-1294对胃癌细胞生命活动的影响
以SGC-7901,HGC-27两个胃癌细胞系为研究对象,对miR-1294在胃癌发展过程中的生物学功能进行了研究。两个胃癌细胞系分别转染miR-1294模拟物和抑制物(图3(A)),qRT-PCR结果显示,转染模拟物组的miR-1294表达量显著增加(P < 0.001),而转染抑制物组的miR-1294表达量则显著降低(P < 0.05)。

Table 2. Multivariate Cox analysis for miR-1294 expression in gastric cancer patients
表2. 胃癌患者miR-1294表达量的多因素Cox分析
注:*P < 0.05。
对转染后胃癌细胞的增殖能力进行检测,结果显示miR-1294模拟物组(miR-1294 mimic)细胞增殖能力显著降低,而miR-1294 inhibitor组细胞增殖能力显著增加(P < 0.05,图3(B))。
进一步利用Transwell侵袭实验对细胞转染后的胃癌细胞的迁移和侵袭能力进行了检测,结果显示,miR-1294 mimic组癌细胞迁移和侵袭能力显著降低,而miR-1294 inhibitor组癌细胞迁移和侵袭能力显著上升(P < 0.05,图3(C),图3(D))。
结果表明,miR-1294对胃癌细胞的增殖、迁移和侵袭具有抑制作用。

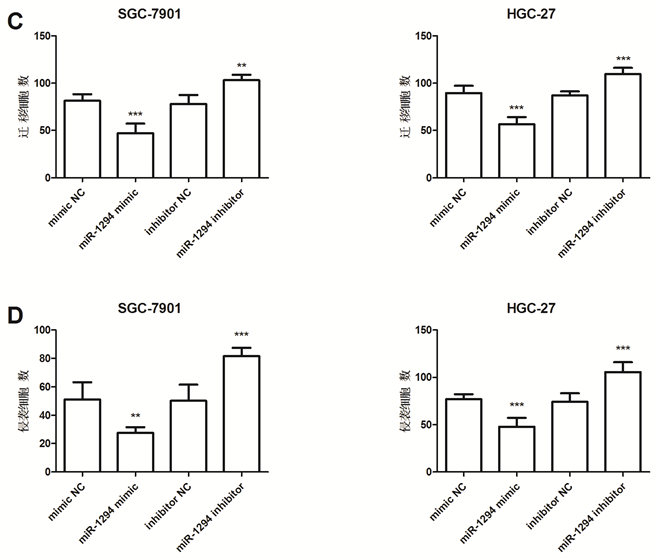 *P < 0.05, **P < 0.01, ***P < 0.001。
*P < 0.05, **P < 0.01, ***P < 0.001。
Figure 3. Effects of miR-1294 expression on gastric cancer cell proliferation, migration and invasion
图3. miR-1294表达量对胃癌细胞增殖、迁移和侵袭能力的影响
4. 讨论
胃癌是一种发病率较高的恶性肿瘤,具有诊断率低及复发风险高的特点。侵袭和转移是肿瘤恶性转变的一个重要标志,是影响胃癌患者预后的主要原因 [14]。癌细胞的迁移和侵袭是一个复杂的生物学过程,由多种因素综合调控 [15] [16] [17]。近期的研究发现,一些参与肿瘤进展的分子可以作为生物标记,用于癌症的诊断和预后 [18] [19]。越来越多的研究证明miRNA在肿瘤的侵袭和转移过程中发挥着重要的作用,其在各种恶性肿瘤中的临床意义备受关注 [20]。本研究通过临床分析和细胞实验,旨在探索miR-1294在胃癌中的表达水平、预后价值及其在肿瘤进展中的生物学功能,为胃癌的治疗提供新的研究思路。
MiRNA是一类内生的、长度约20~24个核苷酸的小RNA。MiRNA通过作用于靶基因调节其表达,进而参与生命活动的调控。据推测,miRNA调节着人类三分之一的基因。迄今为止,多种miRNAs已被报道与癌症的发生、发展及预后密切相关,因此,miRNA有望成为肿瘤诊断和预后的新的标志物或分子指标 [21] [22]。MiRNA-1294是miRNAs的一员,已有报道显示miRNA-1294在多种癌细胞中存在差异性表达。Wang等人报道,miRNA-1294通过靶向c-Myc抑制口腔鳞状细胞癌的生长 [23]。Liu等人也称,低表达miRNA-1294与食管鳞状细胞癌的不良预后显著相关 [10]。目前miRNA-1294与胃癌的相关研究并不多。Shi等人发现 [13],miR-1294在胃癌细胞中的表达水平显著降低,miR-1294可能是胃癌的一个预后因子。
本研究对121例胃癌患者胃癌组织中及癌旁正常组织中的miR-1294表达水平进行了检测,结果证实,胃癌组织中miR-1294的表达水平显著低于癌旁正常组织,miR-1294可能发挥了抑癌基因的作用,与Shi等人的研究结果一致 [13]。此外,miR-1294表达量与肿瘤组织分化程度及淋巴结转移、TNM分期均显著相关,说明miR-1294可能参与了胃癌的发展过程。为了进一步分析miR-1294潜在的临床意义,本研究通过建立生存曲线及多因素Cox回归分析证实,miR-1294是胃癌的独立预后因子。miR-1294的预后价值在其它癌症中已有报道。例如,在口腔鳞状细胞癌中,癌细胞中的miR-1294表达水平显著降低,过表达miR-1294可抑制癌细胞的增殖和迁移 [23]。胶质瘤中同样发现低表达的miR-1294,miR-1294抑制肿瘤细胞的增殖,提高其化学敏感性,可以作为胶质瘤一个潜在的诊断和预后标记 [12]。以上研究均表明,miR-1294在人类肿瘤疾病中是一个潜在的生物标志物。
为了进一步明确miR-1294在胃癌进展中的生物学功能,本研究使用胃癌细胞系为研究对象,分析了miR-1294对癌细胞增殖、迁移和侵袭能力的影响。经过分析发现,miR-1294过表达能显著抑制胃癌细胞的增殖、迁移和侵袭。总之,本研究阐明了miR-1294对胃癌进展的影响,但是其发挥生物学功能所涉及的分子机制尚不清楚,我们后期将做更加深入的研究。
综上所述,miR-1294在胃癌组织中的表达水平显著降低,低表达miR-1294促进胃癌细胞的增殖、侵袭和迁移,并与胃癌的不良预后密切相关。miR-1294有望成为一个新的治疗靶点,为胃癌的靶向治疗提供新方法和新思路。
基金项目
福州省自然科学基金资助项目(2017J01342)。
NOTES
*通讯作者。